高選擇性過氧化亞硝酰熒光探針的合成及性能研究
后際挺 王冰雅 鄭凌云
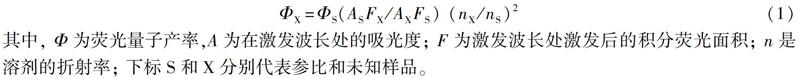
摘?要?過氧化亞硝酰(ONOO)是生物體系中重要活性氧之一,對其高效檢測一直備受關注。本研究以4-二乙基氨基水楊醛和6-甲氧基-1-萘滿酮為原料,經一步有機反應,合成了一種帶氧鎓正離子的熒光探針PFP,用于檢測ONOO。通過紫外-可見吸收光譜和熒光發射光譜系統考察了探針PFP對ONOO的光學響應。結果表明,此探針具有選擇性好、靈敏度高(檢出限為15.5 nmol/L)、響應快速(數秒內)、Stokes位移較大(42 nm)、水溶性好等優點。細胞毒性實驗表明,探針PFP具有良好的生物相容性,探針濃度為20 μmol/L時,細胞存活率>95%。激光掃描共聚焦顯微成像結果表明,此探針可用于活細胞中外源性和內源性ONOO的熒光成像研究。
關鍵詞?熒光探針; 活性氧; 過氧化亞硝酰; 細胞成像
1?引 言
作為細胞內活性氧(Reactive oxygen species,ROS)之一,過氧化亞硝酰(ONOO)是由一氧化氮(NO)和超氧根自由基(O·2)以1∶1的化學計量比,通過擴散控制的反應方式生成(k = 0.4×1010~1.9 ×1010 L/(mol s))[1]。由于其強氧化性,ONOO具有抗微生物和抗菌活性[2]; 同時,ONOO在細胞信號傳導過程中起著重要作用[3]。然而,細胞內過度表達的ONOO可引起生物大分子損傷,如DNA和蛋白質的硝化失活[4~6]; 另外,ONOO還可引起線粒體功能失調。近年的研究表明, ONOO參與多種病理生理過程,如心血管疾病、炎癥、癌癥、藥物引起的肝中毒等[7~10],因此,ONOO被認為是一種疾病診斷的生物標志物[10]。
基于ONOO重要的生理功能,開發可靠有效的ONOO檢測手段具有十分重要的意義。目前,由于其高靈敏性、非侵入性成像、高時空分辨率等優點[11~15],熒光分析法已成為檢測生物體系中ONOO的最有效手段[16~18]。自2006年Yang等首次報道高選擇性ONOO熒光探針以來[19],研究者合成了許多不同性能的熒光探針, 用于ONOO的檢測及生物成像研究[20~32]。這些探針與ONOO的作用模式主要有:硫屬化合物的氧化[20,21]、硼酸或硼酸酯的氧化水解[22,23]、肼的氧化水解[24,25]、活性CC雙鍵的氧化裂解[26,27]和N-氧化去芳基化[28,29]。雖然這些探針對ONOO表現出良好的光學響應,且已在生物體系中得到了較為廣泛的應用,但都存在一些問題。例如,硼酸酯或硼酸類探針的水溶性較差并且易受HOCl和H2O2的干擾[18]; 含活性CC雙鍵的探針則易受親核性物質(如SO23)的影響[33,34]。此外,目前報道的大多數ONOO熒光探針的最大發射波長λmax<600 nm,易受細胞內背景熒光信號干擾,不利于活體成像。因此,開發具有良好水溶性、高選擇性及長波發射(λem>600 nm)的熒光探針用于ONOO的生物成像,仍然具有挑戰性。
自2014年以來,本研究組先后以香豆素-吡啶鹽和香豆素-喹啉鹽為探針平臺,通過活性CC雙鍵的氧化裂解途徑,實現了ONOO的熒光檢測[35,36]。該系列探針具有良好的水溶性和選擇性,但其λmax僅約為490 nm,不利于高信噪比熒光成像。最近,本研究組利用吩噻嗪衍生物構建了一個比率熒光探針,與ONOO作用后,λmax可從630 nm藍移至480 nm,然而該探針水溶性較差,需要使用表面活性劑Triton X-100作為助溶劑[37]。
考慮到上述工作的不足,本研究以水楊醛和萘酮為原料,通過一步縮合反應制備了一種檢測ONOO的新型熒光探針PFP。此探針帶有一個正電荷,具有極佳的水溶性; 同時,D-A-D電子結構使此探針在628 nm處具有較強熒光。此探針與ONOO反應后得到無熒光的產物,從而實現對ONOO的長波檢測。此探針被成功用于活細胞中外源性和內源性ONOO的熒光成像,在ONOO生理功能研究方面具有潛在的應用價值。
2?實驗部分
2.1?儀器與試劑
JEOL ECZ600R/S3 600 MHz核磁共振儀(日本Jeol Resonance公司,TMS為內標); Xevo G2-XS QTof質譜儀(美國Waters公司); UV-3900型分光光度計(日本日立公司); ?FLS 1000型熒光光譜儀(英國愛丁堡儀器公司); Leica TCS SP8動態超高分辨單雙光子激光共聚焦聯用系統(德國徠卡公司)。
4-二乙基氨基水楊醛(Ark試劑公司); 6-甲氧基-1-萘滿酮(安耐吉試劑公司); 5-氨基-3-(4-嗎啉基)-1,2,3-惡二唑鎓鹽酸鹽(3-Morpholinosydnonimine,SIN-1,阿拉丁試劑公司); 脂多糖(Lipopolysaccharide,LPS)和干擾素(Interferon-γ, IFN-γ)(北京索萊寶科技有限公司)。實驗用水為二次蒸餾水。
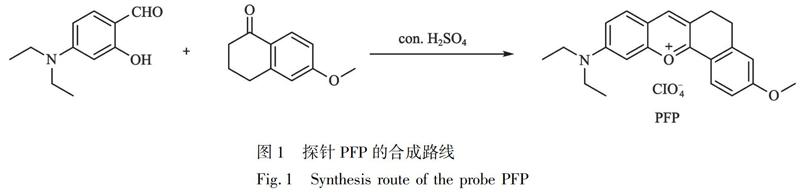
2.2?探針PFP的合成
合成路線參照文獻[38]并稍作改動。具體合成路線如圖1所示,將4-二乙基氨基水楊醛(1.93 g,10 mmol)和6-甲氧基-1-萘滿酮(1.76 g, 10 mmol)溶于20 mL濃H2SO4(98%),Ar保護下于90℃反應5 h。反應結束后,冷卻至室溫,然后倒入約200 g冰中。攪拌下緩慢加入HOCl4(70%,10 mL),將所得沉淀抽濾,并先后用大量水和少量丙酮洗滌濾渣。干燥后,得2.8 g深紅色固體PFP,產率為65%。1H NMR (600 MHz, DMSO-d6) δ (ppm): 8.58 (s, 1H), 8.30 (s, 1H), 7.87 (d, J=9.3 Hz, 1H), 7.39 (d, J=9.1 Hz, 1H), 7.32 (s, 1H), 6.88 (s, 1H), 3.67 (q, J=6.7 Hz, 4H), 3.40 (s, 3H), 2.97 (s, 4H), 1.20 (t, J=6.9 Hz, 6H)。13C NMR(150 MHz, DMSO-d6) δ (ppm): 163.47, 159.73, 158.62, 155.75, 148.66, 146.44, 132.32, 131.55, 126.34, 120.94, 118.37, 118.18, 118.03, 117.45, 96.37, 45.89, 26.81, 25.06, 16.76, 12.98。TOF MS: calcd.?for C22H24NO+2 334.1802, found 334.1811。
2.3?ROS溶液配制
O·2:用CaH2預干燥二甲亞砜(DMSO)過夜,然后將其離心(3000 r/min, 20 min),得到無水DMSO后,加入KO2,超聲溶解。
羥基自由基(·OH):利用FeCl2和過量的H2O2現配現用。
ONOO:將20 mL HCl(0.6 mol/L)和H2O2(0.7 mol/L)的混合溶液與20 mL NaNO2溶液(0.6 mol/L)迅速倒入到冰塊上,1 s內倒入20 mL冷的NaOH溶液(1.2 mol/L)。溶液顏色由無色變為黃色,然后加入30 mg MnO2除去多余的H2O2,密封,置于20℃保存。利用紫外-可見吸收光譜標定其最終濃度(ε302=1670 L/(mol cm))。
H2O2: 將30% H2O2稀釋,通過紫外-可見吸收光譜標定其最終濃度(ε240=43.6 L/(mol·cm))。
ClO: 將5% NaOCl稀釋,通過紫外-可見吸收光譜標定其最終濃度(ε292=350 L/(mol·cm))。
TBHP(tBuOOH): 將70% TBHP溶液稀釋至最終濃度為20 mmol/L。
2.4?探針PFP的合成
熒光量子產率的測定在PBS溶液中進行。使用羅丹明B(ΦS=0.69,甲醇作為溶劑)作為參比。熒光量子產率通過公式(1)計算:
其中, Φ為熒光量子產率,A為在激發波長處的吸光度; F為激發波長處激發后的積分熒光面積; n是溶劑的折射率; 下標S和X分別代表參比和未知樣品。
2.5?光譜測定
配制探針的DMSO母液(5 mmol/L),在磷酸鹽緩沖液(PBS,pH 7.2~7.4,10 mmol/L)中進行光譜測試。探針濃度為10 μmol/L,激發波長為568 nm,激發和發射狹縫寬度均為1 nm。選擇性實驗中,所需各種底物濃度均為100 μmol/L。
2.6?細胞成像實驗
外源性:將人乳腺癌細胞(MCF-7)置于37℃、5% CO2的培養箱中培養。在進行熒光成像實驗之前,細胞用PBS清洗3次,然后加入10 μmol/L PFP培養30 min。用PBS清洗3次后,加入100 μmol/L SIN-1繼續培養30 min,用PBS清洗3次后,在激光共聚焦熒光成像儀下成像。
內源性:將MCF-7細胞置于37℃、5% CO2的培養箱中培養。在進行熒光成像實驗之前,在細胞中加入LPS(1 μg/mL)以及IFN-γ(50 ng/mL)培養 24 h。加入10 μmol/L PFP繼續培養30 min后, 細胞用PBS清洗3次,在激光共聚焦熒光成像儀下成像。
成像所用激發波長為559 nm,收光窗口為600~660 nm。
3?結果與討論
3.1?探針的選擇性
考察了探針PFP對活性物質的選擇性。當探針濃度為10 μmol/L時,PFP在PBS緩沖液中溶解性良好,最大吸收波長位于586 nm(ε=29500 L/(mol·cm))。如圖2所示,向探針溶液加入10倍摩爾比常見的細胞內ROS時,包括O·2、·OH、ONOO、H2O2、ClO及TBHP,發現在ONOO存在下,探針在586 nm處的吸收幾乎完全消失; ClO可以引起探針吸收部分減弱,其它ROS則對探針的吸收光譜不產生影響。由于探針分子中存在氧鎓正離子,因此考察了親核性物質(包括S2、SO23、半胱氨酸(Cys)和谷胱甘肽(GSH))對探針結構的影響。結果表明,這些親核性物質與探針分子不發生反應。熒光發射光譜(圖2B)顯示,PFP在628 nm具有強烈的熒光發射峰,Stokes位移為42 nm。傳統的長波熒光染料(如花菁、甲基藍)通常具有較短Stokes位移(~20 nm),這導致其用于生物熒光成像實驗時常出現竄光干擾。相比之下,PFP具有更大的Stokes位移,有利于熒光成像應用。類似于吸收光譜中的現象,在ONOO作用下,PFP的熒光完全被猝滅(圖3A); ?ClO引起探針熒光強度略微增強,而其它活性物質對探針發射光譜的影響很小,可忽略不計。另外,向ONOO及其它物質的混合溶液中加入探針分子,依然可觀察到明顯的熒光猝滅現象(圖3B),說明探針對ONOO的檢測能力基本不受其它物質的影響。綜上,探針對ONOO具有良好的選擇性和抗干擾檢測能力。
3.2?探針對ONOO的識別性能研究
考察了探針的吸收光譜和發射光譜隨ONOO濃度的變化趨勢。如圖4所示,隨著ONOO濃度從0 μmol/L逐漸增加到200 μmol/L,探針在586 nm處的吸收峰逐漸消失,顏色從紫紅色逐漸變為淺紫色。另一方面,探針在628 nm處的熒光強度也逐漸減弱,熒光量子產率從0.13降至0.03。
由圖5A中的熒光滴定曲線可見,在ONOO作用下,探針熒光的猝滅速率由快到慢; 當ONOO濃度高于50 μmol/L時,探針的熒光強度基本不再變化,此時猝滅效率達到98%,說明探針已與ONOO完全反應。如圖5B所示,當ONOO濃度在0.1~5.0 μmol/L之間時,探針在628 nm處的熒光強度與ONOO濃度呈線性關系,線性方程為y=86.5-24.9x(R2=0.999),檢出限(3σ/k, 其中,σ為掃描探針溶液10次得到的熒光強度的標準偏差,k為探針熒光強度與底物濃度呈線性作用區間的斜率)為15.5 nmol/L, 與文獻報道數值相當(表1),說明此探針對ONOO具有較高靈敏度。
3.3?探針對ONOO的細胞成像實驗
將此探針用于活細胞內ONOO的熒光成像研究。利用四唑鹽(3-(4,5)-Dimethylthiahiazo (-z-y1)-3,5-di-phenytetrazoliumromide,MTT)比色法,對PFP的細胞毒性進行評價。將不同濃度探針與MCF-7細胞培養24 h后,發現探針濃度達到20 μmol/L時,細胞存活率依然大于95%,表明此探針具有良好的生物相容性(圖7)。
考慮到細胞內pH范圍在4~8之間,為了探究細胞內不同區域pH值對探針熒光是否產生影響,在進行細胞成像實驗之前,測試了探針在pH=4和pH=8條件下的穩定性。如圖7B所示,探針在pH值不同的兩種溶液中持續光照1 h后,其熒光強度基本不變,表明PFP適用于細胞內成像。隨后,檢測了探針對細胞外源性ONOO的熒光成像能力。如圖8所示,將MCF-7細胞與10 μmol/L探針培養30 min后,可觀察到細胞內出現強烈的紅色熒光,且熒光主要分布在細胞核外,說明PFP具有良好的細胞膜滲透性。SIN-1在水溶液中易緩慢分解,在O2存在下生成NO和O·2,進而生成ONOO[40]。將細胞與探針預孵育30 min后,再與SIN-1培養30 min,細胞內紅色熒光明顯減弱,說明SIN-1促進了細胞內ONOO濃度升高,從而導致探針被消耗,熒光消失。
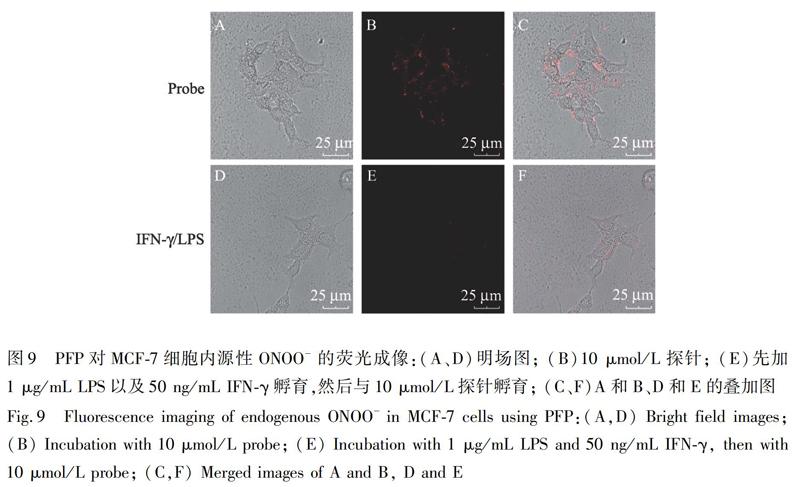
由于ONOO是一種細胞內源性ROS,因此考察了探針對LPS和IFN-γ刺激下細胞內ONOO濃度變化的成像能力。LPS和IFN-γ能夠誘導細胞表達一氧化氮合成酶(NOS2),從而促進細胞內ONOO水平的升高[20]。如圖9所示,將細胞與LPS和IFN-γ孵育24 h后,再與探針培養30 min,紅色熒光幾乎消失,說明探針可以對細胞受刺激下產生的ONOO進行靈敏的熒光成像。
4?結 論
合成了一種帶氧鎓正離子的熒光染料。此染料可發射628 nm強烈紅色熒光,與ONOO反應后, 熒光被猝滅。此探針具有響應快速、選擇性好、靈敏度高、水溶性好、Stokes位移較大、細胞毒性低等優點。可能由于探針與ONOO反應較為復雜,本研究未能成功鑒定氧化產物,反應機制有待深入探究。與熒光增強型探針相比,此探針由于本身具有強熒光,可以直觀地觀察其細胞膜滲透性及細胞內分布等。本研究將此探針成功應用于活細胞中外源性和內源性ONOO的熒光成像研究。此探針在細胞及活體層面上的相關病理生理過程中ONOO的熒光示蹤方面具有潛在的應用價值。
References
1?Szabo C, Ischiropoulos H, Radi R. Nat. Rev. Drug Discov., ?2007, 6(8): 662-680
2?Radi R. J. Biol. Chem., ??2013, ?288(37): 26464-26472
3?Liaudet L, Vassall G, Pacher P. Front. Biosci., ??2009, ?14: 4809-4814
4?Kaur H, Halliwell B. FEBS Lett., ??1994, ?350(1): 9-12
5?Dean R T, Fu S, Stocker R, Davies M J. Biochem. J., ??1997, ?324(1): 1-18
6?Kawasaki H, Ikeda K, Shigenaga A, Baba T, Takamori K, Ogawa H, Yamakura F. Free Radical Biol. Med., ??2011, ?50(3): 419-427
7?Levrand S, Vannay-Bouchiche C, Pesse B, Pacher P, Feihl F, Waeber B, Liaudet L. Free Radical Biol. Med., ??2006, ?41(6): 886-895
8?Wiseman H, Halliwell B. Biochem. J., ??1996, ?313(1): 17-29
9?Kossenjans W, Eis A, Sahay R, Brockman D, Myatt L. Am. J. Physiol-Heart Circ. Physiol., ??2000, ?278(4): H1311-H1319
10?Shuhendler A J, Pu K, Cui L, Uetrecht J P, Rao J. Nat. Biotechnol., ??2014, ?32(4): 373-380
11?Hou J T, Yu K K, Sunwoo K, Kim W Y, Koo S, Wang J, Ren W X, Wang S, Yu X Q, Kim J S. Chem, ??2020, ?6(4): 832-866
12?WANG Xiao-Li, YAO Meng, LI Yin, WEI Chao, WANG Mei. Chinese J. Anal. Chem., ?2019, ?47(12): 1915-1921
王肖莉, 姚 猛, 李 引, 魏 超, 王 美. 分析化學, ??2019, ?47(12): 1915-1921
13?Xiao H, Zhang W, Li P, Zhang W, Wang X, Tang B. Angew. Chem. Int. Ed., ??2020, ?59(11): 4216-4230
14?Wu X, Shi W, Li X, Ma H. Acc. Chem. Res., ??2019, ?52(7), 1892-1904
15?Yang J, Chi Z, Zhu W, Tang B Z, Li Z. Sci. China Chem., ??2019, ?62(9): 1090-1098
16?Prolo C, Rios N, Piacenza L, Alvarez M N, Radi R. Free Radical Biol. Med., ??2018, ?128: 59-68
17?Wang S, Chen L, Jangili P, Sharma A, Li W, Hou J T, Qin C, Yoon J, Kim J S. Coord. Chem. Rev., ??2018, ?374: 36-54
18?Bai X, Ng K K H, Hu J J, Ye S, Yang D. Annu. Rev. Biochem., ??2019, ?88: 605-633
19?Yang D, Wang H L, Sun Z N, Chung N W, Shen J G. J. Am. Chem. Soc., ??2006, ?128(18): 6004-6005
20?Yu F, Li P, Wang B, Han K. J. Am. Chem. Soc., ??2013, ?135(20): 7674-7680
21?Yudhistira T, Mulay T S V, Lee K J, Kim Y, Park H S, Churchill D G. Chem. Asian J., ??2017, ?12(15): 1927-1934
22?Song Z, Mao D, Sung S H P, Kwok R T K, Lam J W Y, Kong D, Ding D, Tang B Z. Adv. Mater., ??2016, ?28(33): 7249-7256
23?Hu J S, Shao C, Wang X, Di X, Xue X, Su Z, Zhao J, Zhu H L, Liu H K, Qian Y. Adv. Sci., ?2019, ?6(15): 1900341
24?Li H, Li X, Wu X, Shi W, Ma H. Anal. Chem., ??2017, ?89(10): 5519-5525
25?Zhu B, Zhang M, Wu L, Zhao Z, Liu C, Wang Z, Duan Q, Wang Y, Jia P. Sens. Actuators B, ??2018, ?257: 436-441
26?Jia X T, Chen Q Q, Yang Y F, Tang Y, Wang R, Xu Y F, Zhu W P, Qian X H. J. Am. Chem. Soc., ?2016, ?138(34): 10778-10781
27?Zhang W, Liu J, Li P, Wang X, Bi S, Zhang J, Zhang W, Wang H, Tang B. Biomaterials, ??2019, ?225: 119499
28?Peng T, Chen X M, Gao L, Zhang T, Wang W, Shen J G, Yang D. Chem. Sci., ??2016, ?7(8): 5407-5413
29?Cheng J, Li D, Sun M, Wang Y, Xu Q Q, Liang X G, Lu Y B, Hu Y, Han F, Li X. Chem. Sci., ??2020, ?11(1): 281-289
30?Cheng D, Peng J, Lv Y, Su D, Liu D, Chen M, Yuan L, Zhang X. J. Am. Chem. Soc., ?2019, ?141(15): 6352-6361
31?Xie X L, Liu G Z, Su X X, Li Y, Liu Y W, Jiao X Y, Wang X, Tang B. Anal. Chem., ??2019, ?91(10): 6872-6879
32?JiangW L, Li Y, Wang W X, Zhao Y T, Fei J, Li C Y. Chem. Commun., ??2019, ?55(95): 14307-14310
33?Zhou X, Kwon Y, Kim G, Ryu J H, Yoon J. Biosens. Bioelectron., ??2015, ?64: 285-291
34?Xu W, Teoh C L, Peng J, Su D, Yuan L, Chang Y T. Biomaterials, ??2015, ?56: 1-9
35?Hou J T, Yang J, Li K, Liao Y X, Yu K K, Xie Y M, Yu X Q. Chem. Commun., ??2014, ?50(69): 9947-9950
36?HOU Ji-Ting, LI Kun, QIN Cai-Qin, YU Xiao-Qi. Sci. Sin. Chim., ??2019, ?49(2): 346-352
后際挺, 李 坤, 覃彩芹, 余孝其. 中國科學: 化學, ??2019, ?49(2): 346-352
37?Hou J T, Wang B, Zhang Y, Cui B, Cao X, Zhang M, Ye Y, Wang S. Chem. Commun., ??2020, ?56(18): 2759-2762
38?Shang H M, Chen H, Tang Y, Ma Y, Lin W. Sens. Actuators B, ??2017, ?95: 81-86
39?Ferrer-Sueta G, Radi R. ACS Chem. Biol., ??2009, ?4(3): 161-177
40?Li C Q, Trudel L J, Wogan G N. Chem. Res. Toxicol., ??2002, ?15: 527-535

