基因剪刀和基因編輯
田地

2020年的諾貝爾化學獎授予美國加州大學伯克利分校教授詹妮弗·杜德納(Jennifer Doudna)和在德國馬克斯·普朗克感染生物學研究所工作的法國教授埃馬紐埃爾·卡彭蒂耶(Emmanuelle Charpentier),以表彰她們發明基因修飾方法CRISPR-Cas9。
基因剪刀和基因編輯的原理
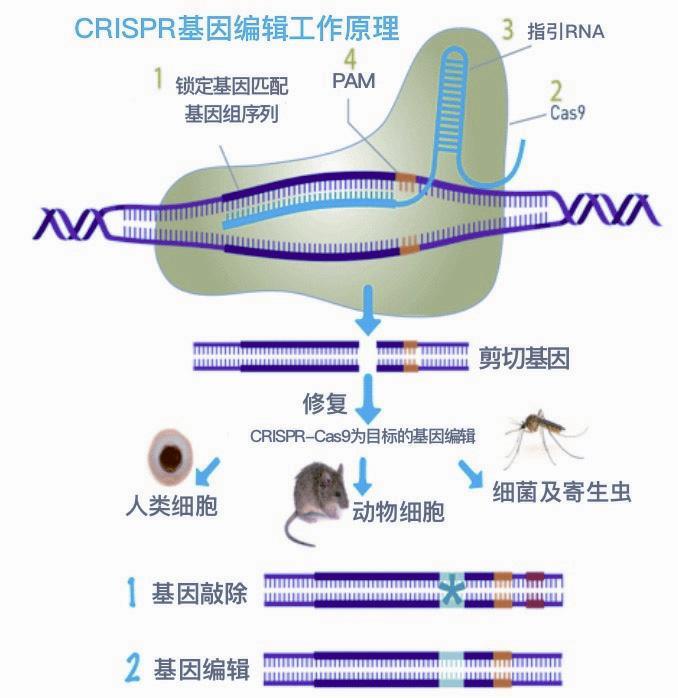
CRISPR的全稱有些拗口,為“規律成簇間隔短回文重復”(Clustered regularly interspaced short palindromic repeats)。Cas是Caspase的簡稱,全稱是含半胱氨酸的天冬氨酸蛋白水解酶。這是一組蛋白酶,Cas9是其中之一。此外,與CRISPR一起發揮功能的還有其他酶,如核酸酶蛋白Cpf1,因此也可稱為CRISPR/Cas系統,包括CRISPR-Cas9、CRISPR-Cpf1、CRISPR-C2c1和CRISPR- C2c2等,它們都是基因剪刀,但應用最多的是CRISPR-Cas9。
CRISPR-Cas9是目前比較精確,而且切割速度較快的一種基因剪刀,利用這把剪刀可以對動物、植物和微生物的DNA進行有目標性的編輯加工(剪切、刪除、位移和增加等),從而治療疾病,尤其是遺傳病,以及獲得人們想要的作物和生物產品。
研究人員早就發現,CRISPR與很多能夠侵入細菌的噬菌體DNA序列相同,噬菌體DNA的這些序列在被轉錄為RNA后,就成為靶向RNA(gRNA),能夠和細菌產生的Cas蛋白形成復合體,并引導Cas蛋白。當復合體檢測到入侵的DNA和靶向RNA序列一致時,Cas蛋白就能夠切割入侵的DNA,據此細菌可以保護自己,防御噬菌體的入侵。可以說,這是生物的一種天生的免疫防御機制。
當CRISPR與Cas9結合成為CRISPRCas9系統時,就成為一種有目標和能精確控制的基因剪刀,能比較準確地切割某種基因。
杜德納和卡彭蒂耶正是因為證明了CRISPR-Cas9基因剪刀的準確和有效而獲得今年的諾貝爾化學獎。卡彭蒂耶在對人類造成極大傷害的化膿性鏈球菌的研究中首先發現一種以前未知的分子—tracrRNA。研究表明,tracrRNA是細菌古老的免疫系統CRISPR/Cas的一部分,該系統通過切割噬菌體的DNA而解除其武裝,從而抵抗噬菌體DNA的侵入。2011年卡彭蒂耶發表了她的研究結果。
同一年,卡彭蒂耶與擁有豐富RNA知識的資深生物化學家杜德納合作,獲得突破性的成果。她們在2012年6月發表的論文中稱,其團隊純化了Cas9蛋白,發現它是雙RNA引導的DNA內切酶,并首次在體外(試管中)證明使用Cas9的CRISPR系統可以切割任意DNA鏈,說明CRISPR在活細胞中有修改基因的能力。同時,她們簡化了基因剪刀的分子成分,創建了CRISPR-Cas9基因剪刀,因此更易于使用。她們是最早把細菌天然免疫系統轉化為CRISPR-Cas9基因剪刀的,并使其具有任意切割基因的功能。后來,卡彭蒂耶和杜德納又用CRISPR-Cas9基因剪刀成功編輯了大腸桿菌的基因,結果表明CRISPR-Cas9比起之前的其他基因剪刀更有效和準確。
發現歷程和爭議
CRISPR被視為一種能改變整個生物領域的工具和成果,在疾病治療、農業生產等方面有極大的應用潛力。但是,CRISPR和CRISPR-Cas9的發現和發明并非只有獲獎者兩個人的貢獻,而是一大批科學家不斷研究、相互印證的結果。
美國的《細胞》雜志曾發文回顧過CRISPR技術的早期發展過程,同時美國麻省理工學院-哈佛大學博德研究所所長埃里克·蘭德也對CRISPR基因編輯技術的發明過程有過總結。結合這兩者及其他研究,可以簡單歸納CRISPR和CRISPR-Cas9的發明過程。
1987年,日本科學家石野良純團隊在分析大腸桿菌iap基因及周邊序列時偶然發現了一段位于3端存在29個核苷酸高度同源的重復序列,它們被含32個核苷酸的序列間隔開,由此揭開了CRISPR的面紗。
1993年,西班牙科學家弗朗西斯科·莫伊卡在嗜鹽古細菌的基因組中發現了大約30個堿基對(bp)長度的回文重復序列(CRISPR),這些序列由36個堿基對的間隔序列隔開。2005年,莫伊卡又發現CRISPR序列中2/3的間隔序列為病毒或外源質粒的序列,因而認定CRISPR系統與細菌的獲得性免疫有關。
2005年,法國科學家吉利斯·維格諾德和俄羅斯科學家亞歷山大·博洛廷也證明,CRISPR與細菌的獲得性免疫有關。
2007年,服務于杜邦公司的法國分子生物學家菲利普·霍瓦特等人在研究生產酸奶的乳酸桿菌對噬菌體的抗性時,發現了Cas7和Cas9蛋白在CRISPR中的作用,Cas7產生間隔和重復序列,Cas9則是核酸酶。

2008年8月,荷蘭科學家范德歐斯特等人鑒定了一系列Cas蛋白,發現這些蛋白需要切割61個堿基對的前體RNA(crRNA)才有功能,由此弄清了crRNA的作用。他們據此人工設計相應的crRNA序列,使細菌獲得了抵抗噬菌體的特性。這是人類首次編輯CRISPR系統。
2008年12月,阿根廷科學家盧西亞諾·馬拉夫尼團隊證實CRISPR系統的底物是DNA,并且提出該系統有可能用于DNA編輯,是一種有效的基因剪刀。
2010年12月,加拿大拉瓦爾大學的西爾萬·莫伊諾證實了Cas9可以在crRNA的指導下切割特定序列的DNA。
2011年7月,立陶宛科學家維吉尼亞斯·斯克斯尼斯在大腸桿菌中重組了嗜熱鏈球菌的CRISPR系統,提出CRISPR-Cas9要成為一把精準有效的基因剪刀至少需要Cas9、crRNA和反式激活crRNA(tracrRNA)。
2012年8月,卡彭蒂耶和杜德納發表論文,揭示CRISPR-Cas9基因剪刀可以進行準確的基因編輯。她們對CRISPR-Cas9系統進行了簡化,將tracrRNA與crRNA嵌合成一條單鏈向導(sgRNA),只需sgRNA和Cas9蛋白兩個組分即可靶向特定的序列,至此CRISPR-Cas9這種高效簡單的基因組編輯技術(基因剪刀)問世。
2013年1月,麻省理工學院教授、華裔科學家張鋒和哈佛大學醫學院教授喬治·邱奇同時在《科學》雜志上分別發表論文,證明CRISPR-Cas9可以編輯哺乳動物細胞基因,而且成功地編輯了小鼠和人類細胞的基因。幾周之后,杜德納實驗室也發表了類似的結果。
因此有人認為,張鋒也有可能因為發現CRISPR-Cas9可應用于人類細胞而獲得諾貝爾獎,并且張鋒與杜德納等人在過去也打了多起關于CRISPR-Cas9技術應用的專利官司,雙方各有勝負。而且石野良純因為首先發現了CRISPR也可能獲獎,另外西班牙的莫伊卡最先認識到CRISPR的重要性,并且對其從結構到功能的揭示都有卓越貢獻,也應當獲獎。但是,在諾貝爾獎委員會看來,在發現CRISPRCas9基因剪刀的過程中,只有卡彭蒂耶和杜德納二人的成果才是最關鍵的核心貢獻。
實際應用
作為一種比較精準而高效的基因剪刀,CRISPR-Cas9在各個領域,如生物、醫學、農業、化學等方面有著廣泛的用武之地。這種基因剪刀可以用來刪除、添加、激活或抑制其他生物體的目標基因,包括人、老鼠、斑馬魚、細菌、果蠅、酵母、線蟲和農作物細胞內的基因,因此,它是一種用途極為廣泛的生物技術。
在農作物方面,人們可以利用這一基因剪刀來生產抵抗霉菌、害蟲和干旱的農作物,而且已經取得了不少成果。2019年,肯尼亞國際熱帶農業研究所的雅因達拉·特里帕斯團隊就采用基因剪刀CRISPR-Cas9剪切了一種大香蕉基因組中的病毒DNA,使其不再讓香蕉產生條紋病。與未經基因編輯的大香蕉相比,經過編輯的大香蕉有75%沒有出現香蕉條紋病毒癥狀,這也意味著即便暴露在干旱壓力下,也能讓這種香蕉不受病毒的侵害,讓香蕉保產和增產。
在改造動物基因方面,基因剪刀也表現出了重要的價值。中國南京醫科大學生殖醫學國家重點實驗室等機構的研究團隊利用CRISPRCas9基因剪刀,首次在全球創造和孕育了兩只靶向基因編輯猴。創造靶向基因編輯猴的目的是建立猴子疾病模型,用來模擬人類、試驗藥物和治療遺傳病,從而降低藥物研究和以人為試驗對象的風險。
研究人員利用CRISPR-Cas9基因剪刀修改了3個基因,即調節代謝的基因Ppar-γ、調節免疫功能的基因Rag1以及調節干細胞和性別決定的基因。研究人員在180多個單細胞期猴胚胎中同時靶向編輯了這3個基因,然后對15個胚胎的基因組進行測序,結果發現其中有8個胚胎顯示出兩個靶基因同時突變的證據。這兩個基因就是調節代謝的基因Ppar-γ和調節免疫功能的基因Rag1。此后,研究人員將這種經過遺傳修飾的胚胎轉移到代孕母猴體內,其中一只母猴分娩出了一對孿生猴。對這對孿生猴的基因組進行檢測后發現,它們的DNA中確實存在兩個突變的靶基因。也因此把這兩只猴稱為靶向基因編輯猴。
2014年,美國貝勒醫學院張普民研究團隊也采用CRISPR-Cas9基因剪刀制造出了能夠產生人類白蛋白的基因編輯豬。
2016年初,包括張鋒在內的多個研究機構的團隊利用CRISPR-Cas9基因剪刀來治療動物的杜興氏肌肉萎縮癥遺傳病,結果提高了它們的預期壽命和生活質量,這顯然是為治療人的杜興氏肌肉萎縮癥進行的動物試驗。
此外,邱奇團隊也正在利用CRISPR-Cas9基因剪刀來大量編輯豬的基因,去除豬的基因中對人有害的微生物,使其可以為人類提供器官,從而解決人體器官移植供不應求的現狀。
倫理和限制
CRISPR-Cas9基因剪刀同樣存在短板和缺陷,最大的短板是它可能脫靶,即這一基因剪刀可能會在DNA錯誤的位置進行剪切,或脫離原有的設計目標,造成意外傷害。如果是用于治療人的疾病,就有可能產生不可預控的嚴重后果。
2018年9月,《自然方法》發表一篇文章指出,在對小鼠的試驗中,CRISPR確實能夠成功矯正引發失明的基因,從而治療小鼠的失明。但是,有兩只接受基因剪刀治療的小鼠的基因組中存在超過1500個單核苷酸突變以及超過100處更大基因片段的缺失和插入。這便是脫靶造成的后果,而且可能危及小鼠的生命。
目前已知有超過4000種遺傳性單基因疾病,影響全球超過1%的新生兒。從理論上講,可以利用CRISPR-Cas9基因剪刀剪掉致病基因,以預防這些疾病,讓每個家庭都獲得健康嬰兒。這顯然比胎兒出生前的基因檢測更先進。
但是,在實際操作中由于CRISPR-Cas9基因剪刀有脫靶的危險,因而用來治療人類疾病有巨大的風險。2015年,中山大學的黃軍就團隊采用基因剪刀CRISPR-Cas9修改導 致β地中海貧血的β珠蛋白基因(將有問題的鳥嘌呤G修改成腺嘌呤A,從而糾正地中海貧血的基因根源)獲得部分成功,但是這一研究結果被英國的《自然》和美國的《科學》雜志拒稿。理由是,這將引發無法預料的風險。對人類胚胎的研究不進行嚴格限制可能會導致不安全和不符合倫理地使用這種技術。
實際情況也表明,黃軍就團隊采用CRISPRCas9基因剪刀的成功率并不高,脫靶明顯。他們對胚胎修改β地中海貧血的致病基因時,試驗了86個廢棄胚胎細胞,最終只有28個的基因被成功編輯修改,成功率約為33%。這個成功率并不足以獲得安全性和成功率的保障,也讓人們對此技術抱有疑慮。
2018年,中國南方科技大學生物系副教授賀建奎團隊利用CRISPR-Cas9基因剪刀編輯了胚胎細胞中與艾滋病免疫有關的CCR5基因,以使嬰兒出生后具備先天性的免疫艾滋病的能力。研究團隊稱,首先是利用猴子胚胎和小鼠來進行CRISPR-Cas9編輯實驗,取得預期的效果,并發現小鼠的組織及行為與正常小鼠沒有顯著差異。2017年3月至2018年11月,賀建奎團隊招募8對夫婦志愿者(艾滋病病毒抗體男方陽性、女方陰性)參與實驗。最終有2名志愿者懷孕,其中一人生下一對化名“露露”“娜娜”的雙胞胎女嬰。
這一事件引發了巨大爭議,由于CRISPRCas9基因剪刀存在不可避免的脫靶后果,將可能對后代產生其他方面的意想不到的危險,因此,這是一種違反醫學倫理的嚴重事件。2019年12月30日,基因編輯嬰兒事件在深圳市南山區人民法院一審公開宣判。賀建奎以非法行醫罪被判3年有期徒刑,并處罰金300萬元人民幣。
CRISPR-Cas9基因剪刀固然有巨大的應用前景,而且也獲得了諾貝爾獎,但是在應用于人和動物時,還存在巨大的風險,需要由人類的倫理和法律來監管。



