MRI動態增強成像聯合DWI鑒別診斷乳腺良惡性腫瘤的臨床價值
謝森
(商丘市第四人民醫院 醫學影像科,河南 商丘 476100)
乳腺癌是女性較為常見的惡性腫瘤,發病率在女性惡性腫瘤中居首位,也是導致女性惡性腫瘤死亡的首要因素,但疾病早期臨床癥狀無特異性,但是疾病早期發現、準確鑒別及診斷臨床分期對治療乳腺癌及改善預后具有重要意義[1]。目前,臨床主要通過鉬靶及B超檢查乳腺疾病,而隨著MRI的不斷發展,對乳腺疾病診斷的敏感性不斷提高,但檢查時在不同乳腺疾病中的形態特點表現無明顯差異,因而對乳腺良惡性疾病的診斷有時出現誤差,臨床實際運用時常采用動態增強掃描、灌注成像及DWI等聯合判斷,提高其診斷率[2]。本研究選取2016年4月至2018年4月于商丘市第四人民醫院治療的80例乳腺腫瘤患者作為研究對象,探討MRI動態增強成像聯合DWI在乳腺良惡性腫瘤鑒別診斷中的應用價值。
1 資料與方法
1.1 一般資料選取2016年4月至2018年4月商丘市第四人民醫院收治的80例乳腺腫瘤患者作為研究對象。年齡32~58歲,平均(45.62±3.17)歲;經穿刺或術后病理顯示,良性病變56例,其中纖維瘤28例,導管纖維瘤17例,炎癥腫塊或結節11例;惡性病變24例,其中浸潤性導管癌11例,浸潤性小葉癌6例,導管內癌3例,導管原位癌4例。
1.2 檢查方法對所有患者首先進行MRI平掃掃描,采用美國GE公司雙梯度1.5 TMRI掃描儀及乳腺相控陣表面線圈。患者取俯臥位,墊高腹部,保持乳房自然懸垂。參數設置:層距4 mm,層間距0.8 mm,層厚6 mm,激勵3次。橫斷面行T1WI、T2WI序列掃描,冠狀面行T2WI掃描,均采取脂肪抑制技術,平掃后行動態增強掃描,肘靜脈注射對比劑,橫斷位掃描,采用三維快速擾相梯度回波聯合脂肪抑制技術。參數設置:層厚3 mm,FOV為11 cm×11 cm,激勵1次,矩陣256×192。DWI掃描采取自旋回波-回波平面成像序列,層厚6 mm,間隔1 mm,b=500、800 s·mm-2橫斷位掃描,FOV設置為32 cm×32 cm,采取脂肪抑制技術。由兩名臨床經驗豐富的醫生進行閱片,分析其臨床癥狀,參照美國放射學會的乳腺影像報告及數據標準進行征象描述。
1.3 觀察指標記錄MRI增強掃描結果,計算DWI表觀擴散系數(apparent diffusion coefficient,ADC)值;根據MRI增強掃描圖像繪制繪制時間-信號強度曲線(time-signal intensity curves,TIC),按照曲線進行分型,分為4種類型,Ⅰ型為信號持續上升,內部信號不斷增加;Ⅱ型為平臺型,即早期持續上升,然后信號突然中斷;Ⅲ型為信號早期持續增加,后期開始逐漸減少;Ⅳ型表示信號無變化(增強或延遲),其中TIC下Ⅰ、Ⅳ型診斷為良性病變,Ⅱ、Ⅲ型診斷為惡性病變。而ADC值診斷時以穿刺或病理診斷結果為參照,采用受試者工作特征(receiver operating characteristic,ROC)曲線來確定ADC值診斷乳腺良惡性病變,以最佳閾值為臨界點,判斷診斷結果。根據診斷結果,以穿刺或術后病理診斷為“金標準”,計算MRI動態增強成像、DWI及聯合診斷下乳腺良惡性病變的檢出符合率。聯合診斷時若任一診斷為惡性,則表示乳腺惡性病變。
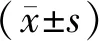
2 結果
2.1 MRI動態增強掃描乳腺良性腫瘤患者病灶形態呈圓形或類圓形、邊緣光滑檢出情況高于乳腺惡性腫瘤患者(P<0.05)。見表1。

表1 MRI動態增強掃描結果[n(%)]
2.2 ADC值診斷當b=800 s·mm-2,惡性腫瘤中DWI擴散受限呈高信號,ADC呈低信號,ADC值為(1.104±0.343)×10-3mm2·s-1;良性腫瘤中14例呈低信號,41例呈高信號,1例炎性肉芽腫病變呈高信號,良性腫瘤中平均ADC值為(1.658±0.335)×10-3mm2·s-1。良性腫瘤ADC值高于惡性腫瘤(t=6.731,P<0.001)。以穿刺或術后病理診斷為“金標準”,繪制ADC值診斷惡性腫瘤的ROC曲線,發現以惡性腫瘤ADC平均值的95% CI上限(1.200×10-3mm2·s-1)作為判斷良惡性病變的診斷界值最佳,敏感度為99.90%。見表2。

表2 ADC值診斷乳腺癌患者ROC曲線分析
2.3 MRI增強掃描診斷結果根據MRI增強掃描下TIC分型結果發現,良性組Ⅰ型(33例)+Ⅳ型(4例)為37例,Ⅱ型(14例)+Ⅲ型(4例)為18例;惡性組Ⅰ型(2例)+Ⅳ型(0例)為2例,Ⅱ型(8例)+Ⅲ型(14例)為22例。
2.4 兩種檢查方式結果DWI診斷以ADC值1.200×10-3mm2·s-1為臨界點,良性組判斷8例為惡性,48例為良性,惡性組21例為惡性,3例為良性。以穿刺或術后病理診斷為“金標準”,聯合診斷下判斷乳腺良惡性病變的檢出符合率高于兩種單項檢測(P<0.05)。見表3。

表3 兩種檢查方式診斷結果比較[n(%)]
3 討論
乳腺癌不僅影響女性身體的完整形態,同時威脅生命安全,近年來,其發病率受生活壓力與環境的影響而逐漸上升。該疾病的臨床診斷方式較多,包括乳腺X線攝影、超聲等技術,雖具有一定的診斷價值,但存在較多的局限性。MRI可進行多參數、多序列成像,為乳腺腫瘤良惡性的鑒別提供詳細信息,提高乳腺疾病的診斷準確性[3]。
MRI平掃時,腫瘤形態及邊緣顯示欠清晰,故而在乳腺腫瘤診斷中意義不大,而MRI動態增強成像可在短時間內清晰顯示腫瘤形態學特征,并反映出腫瘤微循環狀況,臨床應用較為廣泛;DWI可從分子水平層面上,準確反映出人體生理病理狀態下水分子功能變化及空間組成等信息,對組織含水量變化相關的形態學及生理學診斷具有重要價值[4]。本研究對商丘市第四人民醫院收治的乳腺腫瘤患者采取MRI動態增強成像聯合DWI檢查,結果顯示,乳腺良性腫瘤患者病灶形態多呈圓形或類圓形、邊緣光滑,而乳腺惡性腫瘤患者病灶形態多呈不規則或分葉狀,邊緣毛躁,DWI檢查時,當b=800 s·mm-2,乳腺良性腫瘤病變患者ADC值高于惡性腫瘤患者,繪制ROC曲線以ADC平均值的95% CI上限(1.200×10-3mm2·s-1)判斷乳腺腫瘤良惡性;動態增強掃描繪TIC判斷乳腺腫瘤良惡性,以穿刺或術后病理診斷為“金標準”,聯合診斷下判斷乳腺良惡性病變的檢出符合率高于兩種單項檢測。MRI動態增強成像檢查乳腺良性腫瘤病變時,其病灶組織成分簡單,邊界清晰,邊緣光滑,而惡性病變血流豐富,生長到一定階段時,內部可出現鈣化、液化,且呈浸潤性生長,破壞周圍正常組織,進而表現為不規則或分葉狀形態,但部分良性病變具有潛在低度惡性,故而形態上難以區分,單純MRI動態增強掃描時易出現誤診[5]。DWI可通過與正常乳腺腺體組織標準化ADC值,對乳腺病變作出定性診斷,b值越高,對水分子的擴散運動越敏感,但信噪比降低,可產生周圍神經刺激癥狀,影響診斷結果的準確性[6]。由此可以看出,單獨使用MRI動態增強成像或DWI掃描均存在一定的局限性,在形態觀察、ADC值計算時,良惡性病變的判斷可發生重疊,將兩者聯合應用可彌補其不足,提高診斷準確率。
綜上所述,MRI動態增強掃描聯合DWI在乳腺良惡性腫瘤病變的鑒別診斷中具有較高的診斷價值,診斷符合率更高。

