RFA聯合IRIS化療方案治療胃癌術后肝轉移的效果及預后
黃斯誠
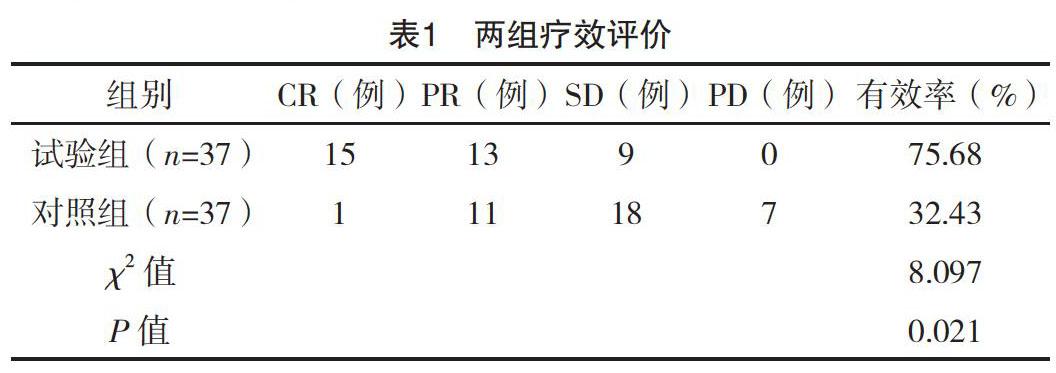
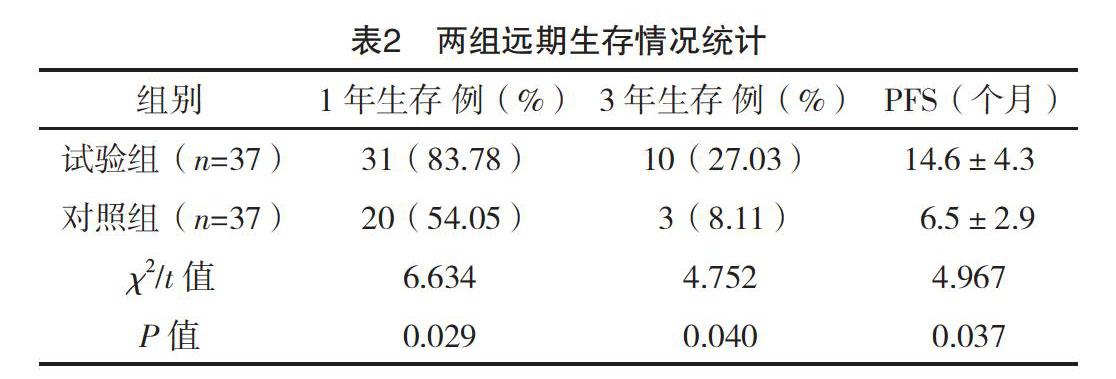
【摘要】 目的:探討胃癌術后肝轉移患者IRIS化療基礎上加用RFA治療的臨床效果及預后。方法:擇取2015年1月-2016年12月本院74例胃癌術后肝轉移患者,隨機分為試驗組(RFA+IRIS化療,37例)和對照組(IRIS化療,37例),觀察兩組療效、遠期隨訪生存期,評價預后。結果:試驗組治療有效率(75.68%)高于對照組(32.43%),隨訪1年生存率(83.78%)、2年生存率(27.03%)、PFS(14.6±4.3)個月,均高于對照組,差異有統計學意義(字2=8.097、6.634、4.752,t=4.967;P<0.05)。結論:RFA治療胃癌術后肝轉移安全有效,以此聯合IRIS化療方案可有效提高治療有效率,臨床效果確切,對延長生存期、改善患者預后具有積極作用,值得推廣使用。
【關鍵詞】 肝轉移癌 RFA IRIS化療 療效 預后
doi:10.14033/j.cnki.cfmr.2020.26.061 文獻標識碼 B 文章編號 1674-6805(2020)26-0-03
The Efficacy and Prognosis of RFA Combined with IRIS Chemotherapy in the Treatment of Liver Metastases after Gastric Cancer/HUANG Sicheng. //Chinese and Foreign Medical Research, 2020, 18(26): -158
[Abstract] Objective: To investigate the clinical effect and prognosis of IRIS chemotherapy plus RFA for patients with liver metastases after gastric cancer. Method: From January 2015 to December 2016, 74 patients with liver metastases from gastric cancer after surgery were randomly divided into the treatment group (RFA+IRIS chemotherapy, 37 patients) and the control group (IRIS chemotherapy, 37 patients). The efficacy, long-term follow-up survival of the two groups were observed, and prognosis was evaluated. Result: The treatment groups treatment efficiency (75.68%) was higher than that of the control group (32.43%). The one-year survival rate (83.78%), three-year survival rate (27.03%), and PFS (14.6±4.3) months were higher than those of the control group, the difference were statistically significant (字2=8.097, 6.634, 4.752, t=4.967; P<0.05). Conclusion: RFA is safe and effective in the treatment of liver metastases after gastric cancer. Combining this with IRIS chemotherapy can effectively improve the treatment efficiency and exact clinical effect. It has a positive effect on prolonging survival and improving the prognosis of patients.
[Key words] Liver metastatic cancer RFA IRIS Chemotherapy Efficacy Prognosis
First-authors address: The First Affiliated Hospital of Fujian Medical University, Fuzhou 350005, China
轉移是惡性腫瘤重要特征。隨著原發腫瘤的生長,腫瘤細胞侵襲周圍組織,穿入淋巴管和血管,隨淋巴液或血液運行至遠處器官停留,并在此增殖和生長,逐漸形成與原發腫瘤類型相同的新腫瘤,即為轉移瘤[1]。肝臟是惡性腫瘤最易發生轉移的器官,有統計數據顯示,轉移性肝癌在各種轉移性腫瘤中占比約40%,其中一半以上原發腫瘤來自消化系統,尤以胃癌和結直腸癌常見,肝轉移發生率超過30%[2]。轉移多見于晚期癌癥患者,往往提示預后不良。化療可以抑制腫瘤細胞擴散轉移,是臨床治療轉移癌常用方法,但目前臨床尚無肝轉移癌全身化療標準方案[3]。IRIS是以伊立替康、替吉奧聯合用藥的化療方案,是目前臨床治療肝轉移癌較常用的化療方法。射頻消融(RFA)指通過電極產生的阻力性電熱效應使腫瘤細胞脫水死亡,進而抑制腫瘤生長,是肝癌局部治療重要手段,屬于介入手術技術,臨床應用優勢諸多[4]。文章現擇取本院近年收治病例,分析探討IRIS化療聯合RFA治療胃癌術后肝轉移的效果與安全性,旨在豐富本病治療策略,為臨床提供參考,具體報道如下。
1 資料與方法
1.1 一般資料
以2015年1月-2016年12月為時限,擇取本院74例胃癌術后肝轉移患者,納入標準:既往胃癌手術病史,后經影像學或穿刺活檢證實肝臟轉移;轉移癌灶數目不超過5個,單個最大徑不超過5 cm;一般狀況良好,ECOG評分0~2分,預計生存期≥3個月;化療及介入術前常規檢查基本正常,治療耐受。排除標準:合并其他嚴重肝臟疾病,或其他重要臟器功能衰竭;肝轉移灶侵犯鄰近臟器,或彌漫多發;合并膽道系急慢性感染,或其他全身性感染;合并膽管或肝內外血管癌栓;嚴重出血傾向、房顫、外周血管斑塊形成或走形異常,研究用藥或成分過敏,存在治療禁忌證;臨床資料不全,或不配合治療及隨訪。隨機分為兩組。試驗組(37例):男20例,女17例;年齡56~79歲,平均(65.7±9.4)歲;轉移灶數目1~5個,平均(2.2±1.7)個;病灶最大徑1.6~4.7 cm,平均(3.1±1.2)cm;高分化腺癌6例,中分化腺癌13例,低分化及黏液腺癌18例,合并腹腔淋巴轉移6例。對照組(37例):男19例,女18例;年齡54~78歲,平均(66.1±9.2)歲;轉移灶數目1~4個,平均(2.3±1.4)個;病灶最大徑1.4~4.8 cm,平均(3.0±1.7)cm;高分化腺癌5例,中分化腺癌12例,低分化及黏液腺癌20例,合并腹腔淋巴結轉移7例。兩組基線資料差異無統計學意義(P>0.05),具有可比性。患者均簽署知情同意書;研究經倫理委員會批準同意。
1.2 方法
1.2.1 對照組(IRIS化療) 注射用鹽酸伊立替康(商品名艾力,江蘇恒瑞,國藥準字H20040711)180 mg/m2,緩慢靜滴,d1,70歲以上老人劑量減少30%。替吉奧片(商品名臻奧,福州海王,國藥準字H20140020)80 mg/m2,口服,2次/d,連用2周。期間密切監測用藥相關不良反應,積極對癥處理,嚴重毒性反應時劑量減少20%,持續2周無改善者停止化療。每3周為一個周期,每完成兩個周期,評價一次療效。疾病無進展、耐受良好者繼續治療,至疾病進展、治療不耐受時退出研究,最多每例完成8個化療周期。
1.2.2 試驗組(RFA+IRIS化療) 本組IRIS化療方案同對照組一致,在此基礎上加用RFA。治療采用冷循環超能射頻腫瘤治療系統,患者常規術前準備,術中超聲造影引導定位,根據腫瘤位置、大小、與周圍臟器毗鄰關系確定穿刺路徑,盡量選擇最短路徑,并注意盡量避開血管和神經。采用一次性射頻消融針,沿預設路徑穿刺肝臟腫瘤,對于較小的病灶,通過適時修正進針角度與針尖位置,使消融針作用范圍能覆蓋腫瘤及瘤旁至少0.5 cm正常組織,行單點單次治療即可,體積過大的病灶,按照由深到淺的順序行多針多點治療,覆蓋范圍同上。術畢原路退針,針道消融滅活。
1.3 觀察指標與評價標準
療程結束后1周,復查肝臟CT或MRI,對比化療前診斷影像,參照實體瘤療效評價標準RECIST(1.1版)評價兩組療效。目標病灶完全消失為完全緩解(CR);目標病灶半徑和較基線減少≥30%為部分緩解(PR);目標病灶半徑和較基線增加≥20%為疾病進展(PD);目標病灶半徑和減少但未至PR標準,或增加但未至PR標準為疾病穩定(SD)[5],計算有效率(CR+PR)。予以兩組長期隨訪,統計兩組生存率與無進展生存期(PFS)。
1.4 統計學處理
以SPSS 21.0軟件統計分析所得數據,計量資料以(x±s)表示,采用t檢驗,計數資料以率(%)表示,采用字2檢驗,P<0.05為差異有統計學意義。
2 結果
試驗組治療有效率高于對照組(P<0.05),見表1。治療后隨訪,試驗組1、3年生存率均高于對照組,PFS長于對照組,差異有統計學意義(P<0.05),見表2。試驗組RFA術后未見相關并發癥,安全性良好。
3 討論
對于胃癌術后肝轉移,目前臨床尚無統一的全身化療標準方案。NCCN指南推薦伊立替康聯合5-氟尿嘧啶為一線方案,有三期臨床試驗報道方案有效率超過40%[6]。其中,伊立替康為半合成水溶性喜樹堿類衍生物,是DNA拓撲異構酶Ⅰ抑制劑,能夠引起DNA單鏈斷裂并抑制RNA合成,從而阻斷腫瘤細胞復制。氟尿嘧啶是核糖核酸一個組分,可轉化為氟尿嘧啶脫氧核苷酸,阻斷受細胞內胸苷酸合成酶轉化為胸苷酸,從而干擾腫瘤細胞NDA與RNA合成。為了減少細胞毒性及相關并發癥,提高依從性,IRIS化療方案在伊立替康治療基礎上,改以第四代氟尿嘧啶口服類抗癌劑替吉奧替代傳統氟尿嘧啶靜脈用藥進行治療 [6]。本品半衰期長,生物利用度良好,可以獲得與5-氟尿嘧啶持續靜注相似的療效,而且毒副作用小,服用方便,尤其適用于老年及胃癌術后進食差、體質虛弱、營養不良的患者[7]。不過值得注意的是,IRIS方案的用藥劑量與療效和毒副作用呈正相關,故適當減量有助于提高患者耐受,延長治療周期,對保證療效具有積極意義[8]。RFA是臨床非手術治療肝癌重要方法,對術后復發、多發轉移等類型肝癌同樣適用。其主要原理是基于影像學定位引導,將可以產生阻力性電熱效應的電極插入腫瘤細胞,利用高溫引起細胞脫水死亡,原位滅活率高,臨床療效得到廣泛肯定[9]。本研究以此聯合化療方案治療胃癌術后肝轉移,結果示治療有效率顯著高于單純化療,患者治療后生存率提升,PFS延長,與文獻[10-13]報道相符,肯定了聯合治療的臨床應用效果與價值。而且,RFA屬于介入手術,創傷小,恢復快,亦不會與化療藥物相互作用,增加毒性反應,安全性高。
綜上,RFA治療胃癌術后肝轉移安全有效,以此聯合IRIS化療方案可有效提高治療有效率,臨床效果確切,對延長生存期、改善患者預后具有積極作用,值得推廣使用。
參考文獻
[1] Richter Michael,Schullian Peter,Buchberger Wolfgang,et al.
Stereotactic radiofrequency ablation for breast cancer liver metastases[J].Journal of Vascular and Interventional Radiology:JVIR,2018,29(2):262-267.
[2]姜彬彬,張仲一,嚴昆,等.經皮超聲引導下射頻消融治療胃癌肝轉移療效分析[J].中國介入影像與治療學,2018,15(1):24-28.
[3]王玉濤,李志華.射頻消融術聯合紫杉醇+替吉奧方案治療胃癌術后肝轉移的療效觀察[J].實用醫技雜志,2018,25(2):192-194.
[4]林淑芝,徐倩,武金玉,等.超聲引導下經皮射頻消融治療惡性腫瘤肝轉移[J].中國介入影像與治療學,2018,15(1):29-32.
[5]景元明,徐昌良,章俞,等.射頻消融聯合放射性125I粒子植入治療胃癌 肝轉移的療效觀察[J/OL].臨床醫藥文獻電子雜志,2018,5(49):15-17,19.
[6]張雪峰.腹腔鏡結直腸癌根治術聯合肝轉移灶射頻消融術治療結直腸癌肝轉移的臨床研究[J].中國肛腸病雜志,2019,39(11):14-16.
[7]郭甲民,劉偉.超聲引導下125I粒子植入聯合射頻消融術對結直腸癌肝轉移的療效研究[J].實用癌癥雜志,2019,34(11):1813-1815.
[8]劉九思.腹腔鏡下結直腸癌切除聯合肝轉移瘤射頻消融術對結直腸癌患者臨床療效及預后的影響分析[J].醫學理論與實踐,2019,32(23):3826-3828.
[9] Daniel Gonganau-Nitu,Radu Scurtu,Calin Precup,et al.An experimental protocol for in situ colorectal liver metastases ablation by radiofrequency toward a standard procedure[J].Journal of Cancer Research and Therapeutics,2019,15(1):164-168.
[10]莫麗,張啟芳,鄧偉.胃癌肝轉移患者術前化療聯合射頻消融保守治療的臨床研究[J].中國腫瘤臨床與康復,2019,26(9):1029-1031.
[11]李紅梅,代曉強.XELOX方案化療聯合微波消融治療胃癌術后肝轉移療效分析[J]. 臨床醫學研究與實踐,2017,2(1):6-8.
[12]段連香,趙愛光,鄭堅. 胃癌肝轉移的多學科綜合治療進展[J].世界華人消化雜志,2015,23(26):4208-4214.
[13]李支援,呂風亞,張英.大腦中動脈狹窄程度與不同急性腦梗死模式的相關性研究[J].國際神經病學神經外科學雜志,2015,42(3):233-237.
(收稿日期:2020-03-20) (本文編輯:何玉勤)

