循環腫瘤細胞在評估傳統及胸腔鏡輔助肺癌切除術治療早期非小細胞肺癌效果的應用
屈志剛,李金波,胡亞鋒,伍 光,田 彥
肺癌是嚴重威脅人類健康的疾病,其病死率居所有惡性腫瘤之首[1-2]。早期手術切除是肺癌最重要的治療方法之一,但部分患者仍存在腫瘤復發或遠處轉移。研究發現循環腫瘤細胞(circulating tumor cells, CTCs)與肺癌分期、發生遠處轉移,甚至與肺癌術后長期生存率密切相關[3];CTCs不僅可有效判斷肺癌患者預后,還能預測和監測輔助治療效果[4-5]。隨著微創技術的進步,除傳統開胸腫瘤切除外,肺癌外科治療還包括電視胸腔鏡腫瘤切除(video-assisted thoracoscopic surgery, VATS),可通過三孔法和單孔法實施[6]。本研究旨在檢測非小細胞肺癌(non-small cell lung carcinoma, NSCLC)患者圍術期行傳統開胸手術及單孔、三孔VATS過程中CTCs水平變化,明確不同手術方式與患者臨床預后的關系。
1 資料與方法
1.1臨床資料 收集2014年8月—2018年2月于河北省涿州市醫院行肺癌切除術的NSCLC 61例,其中傳統手術組24例,單孔VATS組16例,三孔VATS組21例。納入標準:年齡18~80歲;術前或術后病理證實為NSCLC;術前未經放、化療治療。排除標準:有其他惡性腫瘤病史;術前已接受放、化療治療。VATS手術操作步驟:患者采用全麻,雙腔氣管插管、健側單肺通氣,健側臥位,單孔法采用腋前線第4或5肋間切口(約4 cm)作為操作口,腋后線第7肋間切口(1.5 cm)作為觀察口;三孔法在肩胛下角線第7肋間增加1個切口(約2 cm)作輔助操作孔,VATS均為同一術者完成。為避免CTCs播散,操作時先結扎肺靜脈,后結扎肺動脈;先清除肺門及葉尖淋巴結,后清掃肺內淋巴結。此外,研究招募10例良性肺疾病患者及15名健康志愿者作為CTCs檢測的陰性對照組。本研究經醫院倫理委員會批準,所有患者均簽署知情同意書。
1.2圍術期CTCs檢測 分別于術前2 d,術中肺葉切除、淋巴結清掃后,術后2 d采集上述3組肘正中靜脈外周血標本,其中前2 ml用于檢測腫瘤標記物,后7.5 ml用于CTCs檢測。血標本采集后置于檸檬酸抗凝管,4℃保存,18 h內進行CTCs檢測。
1.2.1采用免疫磁珠法富集CTCs:7.5 ml抗凝全血與等比例PBS充分混勻,加7.5 ml人淋巴細胞分離液,室溫800×g離心20 min,棄上清、收集第二層細胞,加5 ml PBS,室溫800×g離心20 min,將細胞沉淀重懸于80 μl磁珠緩沖液,加20 μl CD45抗體(Miltenyi Biotec,德國),混勻后4℃孵育15 min,加2 ml磁珠緩沖液,800×g室溫離心10 min,棄上清,加入500 μl磁珠緩沖液混勻并重懸;將細胞重懸液過磁珠MS分流柱,重復2次,收集從分流柱下流出的液體,800×g室溫離心10 min。
1.2.2采用Envision法檢測CTCs:將細胞懸液均勻涂于載玻片,室溫下風干,用4%多聚甲醛固定10 min,PBS清洗,擦去多余水分,滴加小鼠抗人Pan-CK抗體(1∶100,Cell Signaling,美國),4℃冰箱過夜;PBS清洗后用濾紙擦去多余水分,加Envision二抗(中杉金橋,中國),37℃恒溫孵育20 min;DAB顯色,蘇木素復染,酸乙醇分化、脫水,中性樹膠封片;光學顯微鏡下觀察、照相。
1.2.3CTCs細胞形態學判定標準:細胞呈圓形、橢圓形或長形,長徑>10 μm;光鏡下可見完整細胞形態及細胞核。CTCs細胞光鏡學標準:有完整細胞膜,Pan-CK染色陽性,胞漿呈藍黑色或褐色;細胞長徑>10 μm;核漿比失常。結果判定:由兩位經培訓實驗員在光鏡下獨立觀察細胞并采集相關圖像,有分歧時由兩人共同判定結果[7]。
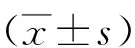
2 結果
2.1NSCLC臨床病理特征及CTCs檢查 本研究共納入61例患者,傳統手術組包括腺鱗癌、大細胞癌各1例,單孔VATS組包括腺鱗癌1例,三孔VATS組包括肺泡細胞癌1例。3組年齡、性別、腫瘤組織類型、吸煙史及臨床分期比較差異無統計學意義(P>0.05)。見表1。61例NSCLC共有44例血標本檢測出2個以上CTCs(圖1),檢測陽性率為72.1%,良性肺疾病患者及健康志愿者未檢測出存在CTCs。

圖1 NSCLC及健康志愿者外周血CTCs檢測(Pan-CK×400)A.NSCLC患者,B.健康志愿者;*代表CTCs,NSCLC為非小細胞肺癌,CTCs為循環腫瘤細胞

表1 3組NSCLC臨床病理特點
2.2圍術期CTCs變化 術前2 d、手術當日3組CTCs數量比較差異無統計學意義(P>0.05);傳統手術組術后2 d CTCs數量顯著多于單孔和三孔VATS組(P<0.05)。見表2,圖2。
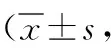
表2 3組NSCLC圍術期CTCs數量比較個/5 ml)

圖2 不同術式對NSCLC圍術期CTCs數量的影響NSCLC為非小細胞肺癌,CTCs為循環腫瘤細胞,VATS為電視胸腔鏡腫瘤切除;與單孔VATS組比較,aP<0.05;與三孔VATS組比較,cP<0.05
2.3不同肺癌切除術式對圍術期CTCs增高情況的影響 3組術前2 d至手術當日所測CTCs數量增高情況不明顯(P>0.05);傳統手術組術前2 d至術后2 d CTCs數量增高情況高于單孔及三孔VATS組(P<0.05),而三孔VATS組CTCs數量增高最少。見表3。
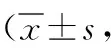
表3 3組NSCLC圍術期CTCs數量增高情況比較個/5 ml)
3 討論
原發性支氣管肺癌是我國最常見、病死率最高的惡性腫瘤之一,對早期NSCLC進行外科手術切除是治療的重要手段,然而患者5年復發率仍高達30%。初診時的常規檢查方法無法探測出的隱匿轉移灶是早期肺癌切除術后腫瘤復發的重要原因[8]。通過淋巴結或循環系統的轉移途徑進入血液循環成為CTCs是肺癌全身轉移的重要環節。近年來CTCs作為液體活檢標本,其定量、動態測量逐漸作為監測腫瘤細胞復發轉移及評估療效和預后的重要手段[9-10]。
微創手術已成為治療早期肺癌的有效手段,隨著手術技術的不斷完善,由三孔法逐漸改進為可以通過單孔進行VATS。臨床研究報道,VATS相比傳統開胸手術存在創傷小、并發癥發生率低、住院時間短、恢復快等優點。然而手術帶來的圍術期CTCs的變化尚未可知。本研究通過免疫磁珠法和免疫細胞化學染色法(Envision法)對傳統手術、單孔和三孔法VATS NSCLC患者圍術期CTCs進行檢測發現,傳統手術組術后2 d CTCs數量顯著多于單孔和三孔VATS組。提示外科手術不可避免地帶來圍術期CTCs數量增加,然而微創VATS手術比傳統開胸手術較少引起CTCs的增加。
CTCs在血液循環中存在數量極少,每106~107白細胞中僅能發現1個CTCs,為了增加其檢出率,我們通過免疫磁珠法對其進行富集。通過制備CD45抗體的免疫磁珠,與CTCs表面上皮細胞黏附分子(EpCAM)抗原結合成為CTCs-抗原/抗體-磁珠復合物,于外在磁場作用下向一定方向移動,從而富集CTCs,再通過Envision法對CTCs進行檢測[11]。本研究中72.1%患者檢測出CTCs,接近既往研究中CTCs的檢測陽性率[12-13]。
盡管手術先結扎肺靜脈,外科機械性操作均不可避免地釋放部分CTCs入外周血,形成CTCs。本研究結果顯示,傳統手術組術前2 d至術后2 d CTCs數量增高情況高于單孔及三孔VATS組。提示胸腔鏡下更好的手術視野、較輕微的機械性操作可能對CTCs變化影響不大;此外,VATS較少刺激免疫系統、進而較少刺激腫瘤細胞增殖可能是CTCs變化較少的原因。其中,三孔VATS操作引起的變化最少[12]。
盡管CTCs的數量與患者遠期復發轉移的關系尚無明確結論,避免圍術期CTCs的波動仍是手術的目標之一[14],本研究明確了VATS在較少干擾CTCs方面的優勢,尤其三孔法不僅可保證淋巴結清掃效果、減輕圍術期并發癥,還顯著減少了CTCs的增加,具有較大優勢。

