添加ω-3多不飽和脂肪酸對結腸癌術后化療患者營養指標、免疫功能的影響
袁宏莉,馬彩娜,余艷平
平煤神馬醫療集團總醫院普外科,河南 平頂山 467000
結腸癌是臨床常見的消化系統腫瘤,患者飲食量和食欲明顯下降,可導致營養成分流失嚴重,降低機體免疫功能,可嚴重影響患者的術后恢復;此外,結腸癌患者術后常需輔助化療以改善治療效果,但由于機體免疫力下降和代謝紊亂可能會影響化療效果和患者的耐受[1]。結腸癌患者術后應采取有效的營養支持并選取恰當的營養支持方案以提高患者的生活質量,對改善患者的預后也有重要意義。
ω-3多不飽和脂肪酸(omega-3 polyunsaturated fatty acid,ω-3PUFA)是一種免疫增強素,相關研究顯示,其在乳腺癌、前列腺癌等多種惡性腫瘤中發揮抑制作用[2-3]。但目前,ω-3PUFA針對結腸癌術后化療的免疫功能及營養影響的研究資料較少。本研究探討腸外營養添加ω-3PUFA對結腸癌根治術后化療患者術后康復的影響,旨在為臨床結腸癌術后化療生活質量和預后的改善提供參考,現報道如下。
1 資料與方法
1.1 一般資料
選取2017年1月至2019年1月在本院手術術后實施化療的結腸癌患者。納入標準:符合2017年中國臨床腫瘤學會(Chinese Society of Clinical Oncology,CSCO)指南中關于結腸癌的診斷標準[4],術前經計算機斷層掃描(CT)、結腸鏡確診,結腸癌根治術后經病理學檢查證實;年齡19~79歲;所有患者均接受術后化療和腸外營養治療。排除標準:卡氏功能狀態(Karnofsky performance status,KPS)評分<70分;合并其他部位惡性腫瘤;合并嚴重的肝腎功能疾病或其他系統重大疾病;合并精神疾病、智力障礙。依據納入和排除標準,本研究共納入120例術后化療的結腸癌患者,依據治療方法分為研究組和對照組,每組60例。研究組中男37例,女 23例;年齡 43~79歲,平均(55.3±7.6)歲;TNM分期:Ⅰ期15例,Ⅱ期32例,Ⅲ期13例;體重指數(body mass index,BMI)為(21.2±2.0)kg/m2;治療前血紅蛋白(hemoglobin,Hb)為(115.8±8.2)g/L;KPS評分為(74.8±2.8)分。對照組中男33例,女26例;年齡38~79歲,平均(54.4±7.0)歲;TNM分期:Ⅰ期16例,Ⅱ期28例,Ⅲ期16例;平均BMI為(21.4±2.1)kg/m2;治療前Hb為(114.5±7.6)g/L;KPS評分為(74.4±2.5)分。兩組患者性別、年齡和TNM分期等臨床特征比較,差異均無統計學意義(P>0.05),具有可比性。
1.2 術后化療和腸外營養方法
兩組術后均接受奧沙利鉑+亞葉酸鈣+5-氟尿嘧啶化療:第1天,奧沙利鉑85 mg/m2靜脈輸注2 h;第1天,亞葉酸鈣400 mg/m2靜脈輸注2 h;第1天,氟尿嘧啶400 mg/m2靜脈推注,然后每天1200 mg/m2持續靜脈輸注(總量2400 mg/m2,共輸注46~48 h),每2周1次,共持續24周。所有患者均同時給予腸外營養,1.2 g/(kg·d)中/長鏈脂肪乳劑2天劑量,研究組患者同時添加10 ml的ω-3PUFA,持續24周。
1.3 觀察指標
所有患者抽血前均禁食8 h以上,入院24 h內及干預后晨起空腹臥位,抽取肘靜脈抽血3 ml,置于EDTA抗凝真空采血管中,靜置30 min后,3000 r/min離心10 min,分離血清,將血清轉移至離心管中,-80℃的冰箱備用。干預前后,采用全自動生化分析儀檢測兩組患者的營養學指標,包括血清總蛋白(total protein,TP)、白蛋白(albumin,ALB)、轉鐵蛋白(transferrin,TF)、Hb水平變化。干預前后,流式細胞儀檢測兩組患者的免疫功能指標,包括免疫球蛋白(IgA、IgG、IgM)和外周血T淋巴細胞(CD3+、CD4+、CD8+)。化療前后,比較兩組患者的KPS評分[5]。
1.4 統計學方法
采用SPSS 21.0軟件對所有數據進行統計分析,計量資料以均數±標準差(±s)表示,組間比較采用t檢驗;計數資料以例數和率(%)表示,組間比較采用χ2檢驗;以P<0.05為差異有統計學意義。
2 結果
2.1 營養學指標的比較
干預前,兩組患者TP、ALB、TF、Hb水平比較,差異均無統計學意義(P>0.05)。干預后,兩組患者TP、ALB、Hb水平均高于本組干預前,TF水平低于本組干預前,且研究組患者的TP、ALB、Hb水平均高于對照組患者,TF水平低于對照組患者,差異均有統計學意義(P<0.05)。(表1)
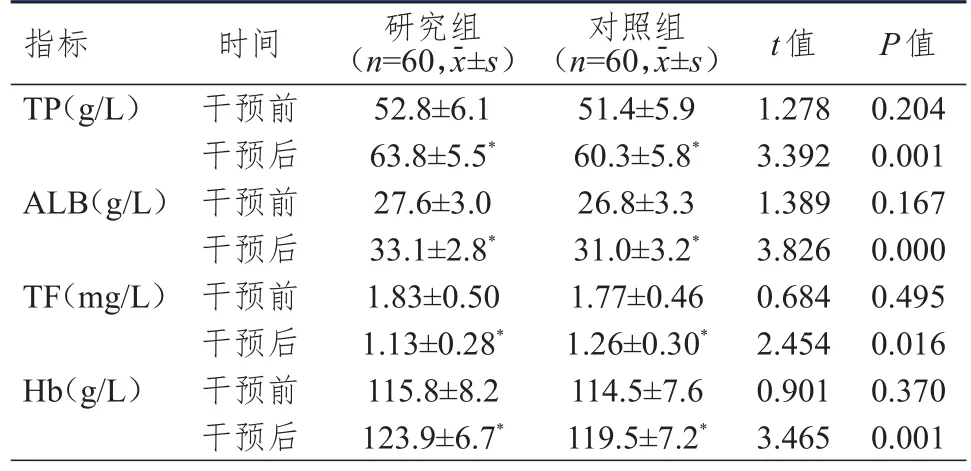
表1 兩組患者干預前后營養學指標的比較
2.2 免疫功能指標的比較
干預前,兩組患者免疫球蛋白水平和外周血T淋巴細胞水平比較,差異均無統計學意義(P>0.05)。干預后,兩組患者IgG、IgM、CD3+、CD4+水平均高于本組干預前,CD8+水平低于本組干預前,且研究組患者IgG、CD3+、CD4+水平均高于對照組患者,差異均有統計學意義(P<0.05)。(表2)
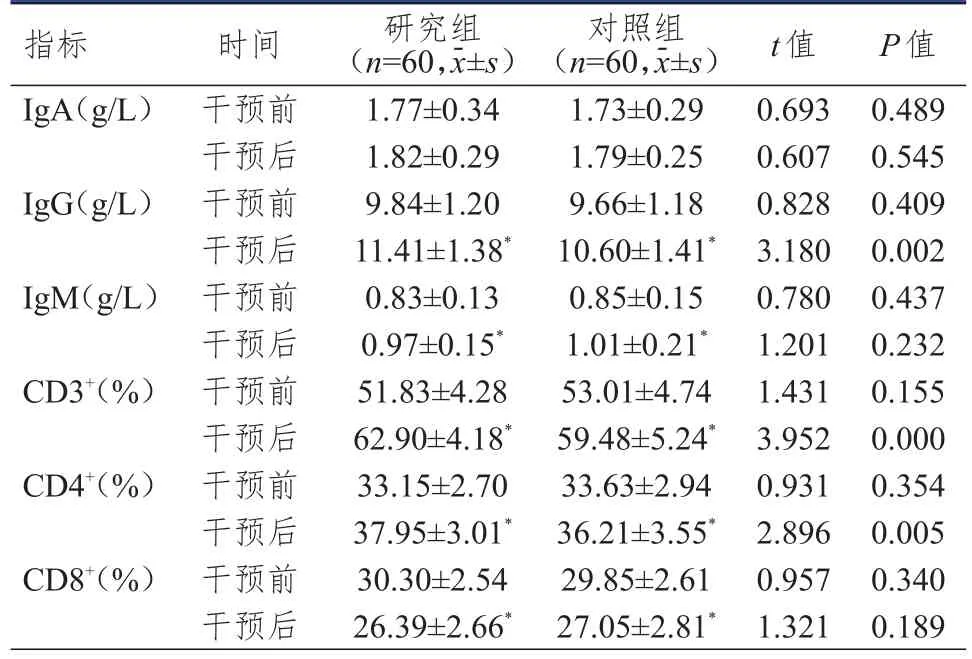
表2 兩組患者干預前后免疫功能指標的比較
2.3 KPS 評分的比較
干預前,研究組患者KPS評分為(74.8±2.8)分,與對照組患者的(74.4±2.5)分比較,差異無統計學意義(t=0.825,P=0.411)。干預后,研究組患者的KPS評分為(77.9±3.1)分,明顯高于對照組患者的(76.2±3.4)分,差異有統計學意義(t=2.862,P=0.005),且兩組患者的KPS評分均明顯高于本組干預前,差異均有統計學意義(t=5.748、3.304,P<0.01)。
3 討論
結腸癌是臨床常見的消化系統惡性腫瘤,患者術后均存在不同程度的脂質過度氧化、胰島素抵抗及營養不良等,因此,更易導致營養不良和免疫功能減退,其中腸道功能障礙是誘發結腸癌患者營養不良的主要原因[6-7]。結腸癌患者手術治療后由于機體長時間禁食、高代謝狀態及腸道黏膜屏障和免疫功能下降等均可使患者的營養狀態進一步惡化,進而影響術后恢復和預后,降低患者生活質量[8-9]。因此,結腸癌術后合理、有效營養支持已成為結腸癌綜合治療的重要部分。
TP、ALB均是機體重要蛋白,能夠在早期反映機體肝臟合成能力,進而反映患者的營養狀態[11-12]。本研究結果顯示,干預后,研究組患者的TP、ALB、Hb水平均高于對照組患者,TF水平低于對照組患者,差異均有統計學意義(P<0.05)。表明結腸癌根治術后化療患者腸外營養添加ω-3PUFA有利于改善患者的營養狀態。研究證實,腫瘤惡液質常由代謝異常和進食減少引起,是腫瘤患者發生營養不良的主要原因[14],主要表現為能量和蛋白質代謝的負平衡,而術后營養不良可降低患者的免疫功能和生活質量。近年來,免疫增強營養素逐漸廣泛應用于臨床并具有一定的臨床效果,其中ω-3PUFA、精氨酸和谷氨酰胺等的應用較多,相關研究提示,長期攝入ω-3PUFA,患者發生結腸癌和乳腺癌等惡性腫瘤的可能性低于普通人群[13],因此,常規營養支持再聯合ω-3PUFA可能更有利于改善腫瘤惡液質的體質,進而改善患者的營養狀態。
本研究結果顯示,干預后,研究組患者IgG、CD3+、CD4+水平高于對照組患者,表明結腸癌術后化療聯合ω-3PUFA營養支持更有助于提高患者的免疫功能。ω-3PUFA調節免疫細胞功能的作用主要包括以下三個方面:①T淋巴細胞,ω-3PUFA可以明顯降低抗原特異性的CD4+T淋巴細胞的增生性反應和IL-2水平。②單核-巨噬細胞,ω-3PUFA可明顯提高血漿中游離脂肪酸和單核細胞脂質n-3和n-6比例,明顯抑制單核細胞受內毒素刺激時腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)、白細胞介素(interleukin,IL)-1、IL-6和IL-8等細胞因子的釋放。③樹突狀細胞,下調大鼠樹突狀細胞的CD18、CD54、CD11a及主要組織相容性復合體(major histocompatibility complex,MHC)等表型,影響抗原呈遞功能,進而提高機體的免疫功能[15]。
本研究結果顯示,干預后,兩組患者的KPS評分高于本組干預前,表明結腸癌根治術后化療患者腸外營養添加ω-3PUFA有利于提高患者的功能評分和健康狀況。胃腸道黏膜中存在人體超過50%的淋巴組織,ω-3PUFA作為腸內營養劑能夠直接為胃腸黏膜提供營養,可保證免疫細胞和腸道淋巴組織所需能力,可促進機體術后恢復免疫功能。此外,ω-3PUFA可通過各種途徑抑制炎癥和結腸癌細胞增生,促進細胞凋亡,并清除腫瘤細胞,提高抗腫瘤治療效果,從而提高機體的功能狀態。
研究顯示,攝入脂肪的種類和數量與惡性腫瘤的發生密切相關[16-17],但動物脂肪和飽和脂肪酸的大量攝入可能增加了前列腺癌、乳腺癌和結腸癌的危險性,但長期服用ω-3PUFA的海產品患惡性腫瘤的危險性明顯降低。也有研究發現,ω-3PUFA可增強某些抗腫瘤藥物的療效,抑制腫瘤的生長、侵襲和轉移,提高治療效果[18],在本研究中也得到了證實。
綜上所述,結腸癌根治術后化療患者腸外營養添加ω-3PUFA有利于改善患者的免疫功能,并進一步提升患者的營養水平,值得在臨床范圍內推廣應用。

