胃癌患者血清miR-22、miR-20a的水平變化及意義
楊煥麗,賈澤博,梁曉萍,王菲,張瑞
1咸陽市中心醫院,陜西咸陽 712000;2西安醫學院
目前胃癌的發病率居惡性腫瘤第5位,病死率居第3位,嚴重影響人們的生命健康[1]。早期胃癌患者的預后較好,且治愈率較高[2]。而中晚期胃癌患者預后較差,易發生遠端轉移和復發,導致患者的生存期縮短,因此提高早期胃癌的檢出率對于胃癌患者的治療及預后改善尤為重要[3]。目前對胃癌的發病機制仍缺乏了解,已有研究顯示,在胃癌發病過程中多種微小RNA(miRNA)表達異常[4]。miRNA是在細胞內廣泛存在的微小RNA分子,通過堿基互補配對與基因的mRNA結合并促進其降解,從而導致基因表達下降[5]。微小RNA-20a(miR-20a)在細胞核和細胞質中均有分布,在乳腺癌和肺癌中表達上調,與腫瘤細胞的增殖和細胞周期進程密切相關[6,7]。miR-22主要分布于細胞核中,在腸癌和宮頸癌中表達下調,與腫瘤侵襲和轉移聯系密切[8,9]。研究顯示,乳腺癌中miR-20a和miR-22表達有一定關系,并在乳腺癌手術患者的預后診斷中有重要意義[6]。但兩者在胃癌中的研究較少。2018年2月—2019年2月,我們觀察了血清miR-22、miR-20a在胃癌中的水平變化,并探討其意義。
1 資料與方法
1.1 臨床資料 選擇2018年2月—2019年2月我院診治的90例胃癌患者(胃癌組)。納入標準:均為首次發病;病理學確診為胃癌;入院前未接受過放化療治療和抗炎治療。排除標準:合并存在其他類型腫瘤;存在全身性炎癥反應;肝腎功能異常;存在自身免疫性疾病。同時選擇同期在我院進行體檢的90例健康者作為對照組。胃癌組男50例、女40例,年齡34~78(61.73±11.24)歲。對照組男51例、女39例,年齡33~79(61.29±10.87)歲。兩組性別比例、年齡比較差異無統計學意義,具有可比性。胃癌組腫瘤直徑≤5 cm 48例,>5 cm 42例;浸潤深度達黏膜層54例,黏膜下層36例;低分化31例,中分化35例,高分化24例;28例有淋巴結轉移,62例無淋巴結轉移;TNM分期為Ⅰ期34例,Ⅱ期30例,Ⅲ期16例,Ⅳ期10例。本研究通過咸陽市中心醫院倫理委員會批準。入組人員均與院方簽署知情同意書。
1.2 血清miR-20a、miR-22水平檢測 于清晨抽取兩組空腹肘靜脈血5 mL,室溫靜置30 min,5 000 r/min離心30 min,保留上清液并將其凍存于-80 ℃保存,待所有血清樣本收集結束后進行統一檢測。血清miRNA提取采用血清miRNA提取試劑盒(新海基因檢測有限公司),按照試劑盒說明書完成操作。miR-20a、miR-22水平檢測采用RT-PCR法,使用逆轉錄試劑盒(美國賽默飛世爾生物科技有限公司)將提取得到的miRNA逆轉錄生成cDNA,用實時熒光定量PCR試劑盒(美國賽默飛世爾生物科技有限公司)對miR-20a和miR-22的表達量進行檢測,配套使用熒光定量PCR儀(美國伯樂科技有限公司)進行檢測,操作方法嚴格按照試劑盒說明書和儀器說明書進行操作。采用mirVana miRNA分離試劑盒提取血清中的miRNA,使用miRNA cDNA合成試劑盒對提取獲得的miRNA進行逆轉錄。逆轉錄體系:miRNA 5 μL,反轉錄緩沖液5 μL,10×miRNA反轉錄引物2 μL,水8 μL。反轉錄條件:37 ℃ 60 min;95 ℃ 5 min。使用mirVana qRT-PCR miRNA檢測試劑盒對cDNA進行定量檢測,反應體系25 μL,包括水16.5 μL,5×PCR buffer 5 μL,50×ROX溶液0.5 μL,DNA聚合酶1 μL,PCR上游引物1 μL,PCR下游引物1 μL。反應條件:95 ℃ 15 s;60 ℃ 30 s,進行35個循環。miR-20a正向引物:5′-GCGGCGGTAAAGTGCTTATAGTG-3′,反向引物:5′-TGCAGGGTCCGAGGTAT-3′。miR-22正向引物:5′-AAGCTGCCAGTTGAAGAACTGTA-3′,反向引物:5′-AGTTGCTAAGATATGCGACAC-3′。以U6作為內參基因,U6正向引物:5′-CCCTCCAGAGAGCGTTATGTGA-3′,反向引物:5′-GTTTCTGAAAATTACAGGGTCATTTGTG-3′。以2-ΔΔCt法計算miR-20a和miR-22的相對表達量。
2 結果
2.1 兩組血清miR-20a、miR-22水平比較 胃癌組、對照組血清miR-20a水平分別為7.09±1.97、4.12±1.33,兩組比較差異有統計學意義(t=11.854,P<0.01);血清miR-22水平分別為4.61±1.28、10.69±3.45,兩組比較差異有統計學意義(t=15.675,P<0.01)。
2.2 血清miR-20a、miR-22水平與胃癌患者臨床病理特征的關系 見表1。
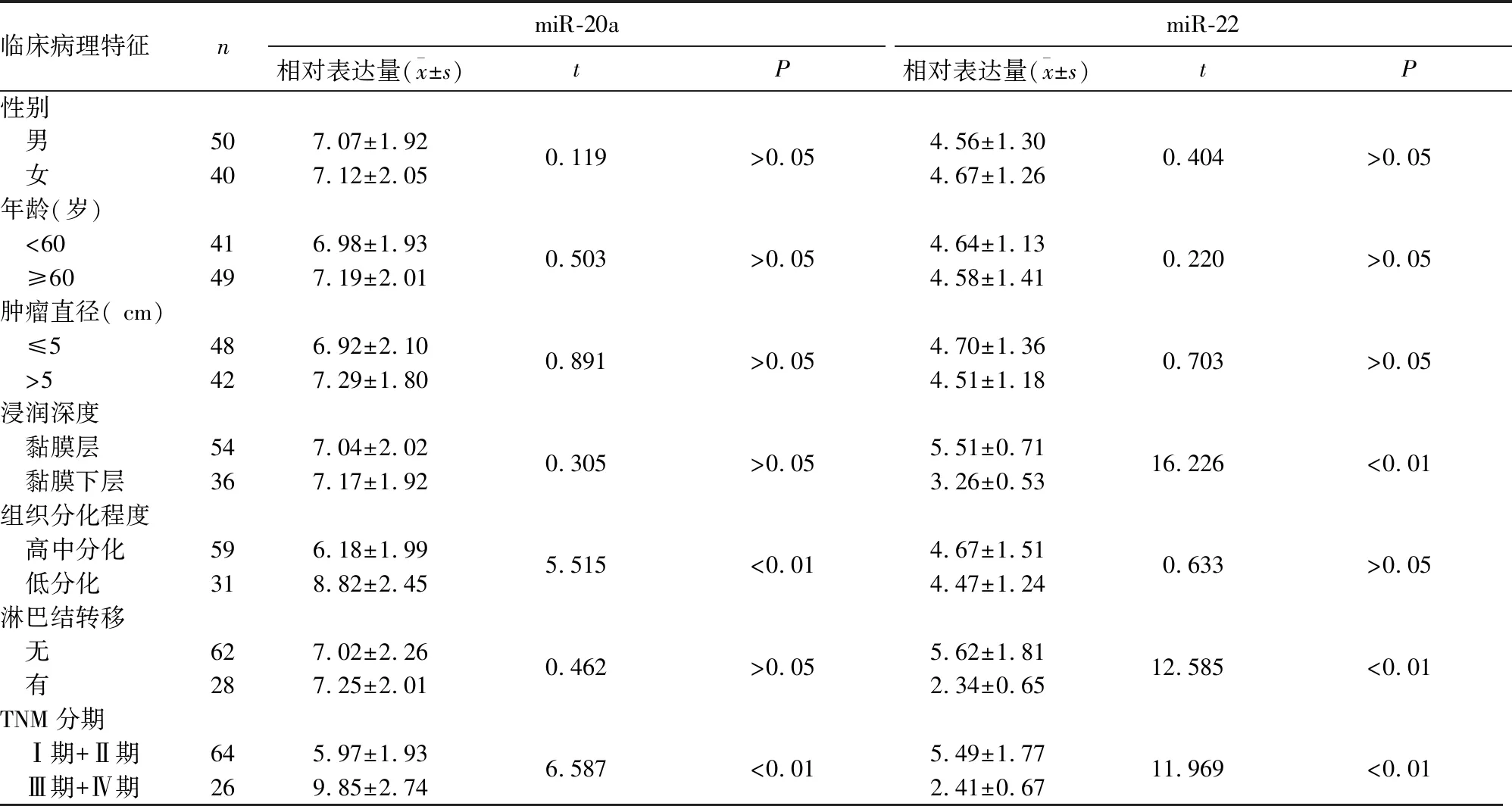
表1 血清miR-20a、miR-22水平與胃癌患者臨床病理特征的關系
2.3 胃癌患者血清miR-20a與miR-22的關系 胃癌患者血清miR-20a水平與miR-22水平呈負相關(r=-0.864,P<0.01)。
2.4 血清miR-20a與miR-22對胃癌的診斷價值 以胃癌組(n=90)為陽性樣本,以對照組(n=90)為陰性樣本,再將miR-20a與miR-22兩指標水平劃分成7~10個組段,建立ROC曲線診斷分析模型。發現兩指標對胃癌具有較高的診斷價值,見表2。

表2 血清miR-20a與miR-22對胃癌的診斷價值
3 討論
miRNA是目前腫瘤領域新興的研究熱點之一,在胃癌發病過程中一系列miRNA表達發生異常,具有作為胃癌診斷和治療靶點的潛力[10]。miR-20a在前列腺癌等腫瘤中表達上調,并能促進腫瘤細胞增殖[11]。本研究發現,胃癌患者血清miR-20a水平上調,并且血清miR-20a水平與胃癌患者組織分化程度和TNM分期有關。Yuan等[12]發現,在多發性骨肉瘤中蛋白酪氨酸磷酸酶基因(PTEN)是miR-20a的直接下游靶點,miR-20a能抑制PTEN表達,從而促進多發性骨肉瘤細胞增殖,抑制腫瘤細胞凋亡。Gao等[13]發現,在乳腺癌細胞中PTEN同源物假基因1(PTENP1)與PTEN能競爭性結合miR-20a,乳腺癌細胞中PTENP1表達量上調促使更多的miR-20a與PTENP1結合,從而解除miR-20a對PTEN表達抑制效應。同時PTEN能夠通過抑制磷脂酰肌醇-3-羥激酶(PI3K)/絲蘇氨酸蛋白激酶(AKT)信號通路抑制乳腺癌細胞增殖。胃癌中miR-20a表達上調能促進miR-20a與PTEN等抑癌基因mRNA的結合并促進其降解,從而導致PTEN等抑癌基因表達下降,使得PTEN對PI3K/AKT信號通路的抑制效應解除,從而激活腫瘤細胞中的PI3K/AKT信號通路,促進腫瘤細胞增殖。另外,miR-20a亦能直接促進TAK1等癌基因的轉錄,使得TAK1等癌基因表達上調,進而促進腫瘤細胞增殖。
miR-22在乳腺癌等腫瘤中表達下調,在腫瘤侵襲和轉移中發揮重要作用[14]。本研究發現,胃癌患者血清miR-22水平下調,并且血清miR-22水平與浸潤深度、淋巴結轉移和TNM分期有關。Wongjampa等[15]發現,宮頸癌中組蛋白脫乙酰基酶(HDAC6)是miR-22直接下游靶點,miR-22與HDAC6基因mRNA的3′-UTR區域結合而抑制HDAC6的反應,從而抑制腫瘤細胞的轉移。Zhang等[16]發現Snail基因是miR-22的作用靶點,miR-22與Snail基因mRNA結合促使Snail的mRNA大量降解,從而導致Snail表達下調。Snail是腫瘤相關轉錄因子,下游靶基因多參與腫瘤間充質轉化,Snail表達與腫瘤間充質轉化和腫瘤轉移密切相關,Snail表達下調會導致腫瘤細胞轉移和侵襲能力下降。Xu等[17]發現,miR-22能下調膀胱癌中絲裂原激活的蛋白激酶1(MAPK1)基因表達,從而抑制MAPK信號通路的活化,導致腫瘤轉移能力下降。胃癌中miR-22表達下降能夠促進HDAC6、Snail和MAPK1等腫瘤轉移相關基因的表達,促進MAPK等腫瘤轉移相關信號通路的活化和腫瘤上皮間充質轉化的發生,從而導致腫瘤轉移能力增強。
本研究進一步發現,胃癌患者血清miR-20a與miR-22呈負相關。這主要是由于胃癌中miR-20a主要起癌基因的作用,而miR-22主要起抑癌基因的作用,二者可能存在相互拮抗。而Li等[18]研究顯示,長鏈非編碼RNA MALAT1能激活T細胞受體信號通路,進而上調miR-20a表達。在胃癌中,長鏈非編碼RNA MALAT1能與miR-22結合并促進miR-22降解,導致患者miR-22水平下降,同時激活T細胞受體信號通路而上調miR-20a表達,從而導致患者血清miR-20a水平升高。本研究發現,相較單項診斷,血清miR-20a與血清miR-22聯合診斷的靈敏度和特異度更高,表明血清miR-20a和miR-22檢測在胃癌診斷中具有一定臨床意義。
綜上所述,胃癌患者血清miR-20a水平升高,而血清miR-22水平降低,二者表達呈負相關;聯合檢測二者水平有助于胃癌診斷。

