血漿IGF-1聯合GOS評分對動脈瘤性蛛網膜下腔出血患者預后的預測價值
秦浩,尹航,張亞波,馮麗君,莊強
棗莊市立醫院,山東棗莊 277100
動脈瘤性蛛網膜下腔出血(aSAH)是導致神經功能缺損甚至死亡的嚴重腦血管疾病,病死率30%~50%,僅30%可恢復到生活自理[1]。近年來,隨著臨床治療技術的提高,aSAH病死率有所下降,但其預后仍不樂觀,多數存活患者可遺留不同程度神經功能缺損,嚴重影響患者生存質量[2]。目前缺少aSAH預后有效預測指標。格拉斯哥預后(GOS)評分是評價嚴重創傷和頭部損傷預后的常用指標,操作簡便,在顱腦損傷、腦出血患者預后評估中有一定價值[3],但受操作者主觀因素影響較大,單獨應用GOS評分存在一定弊端。aSAH患者存在明顯垂體功能障礙和生長激素缺乏,影響神經內分泌系統穩定和患者預后,胰島素樣生長因子-1(IGF-1)具有調節生長激素作用,IGF-1缺乏可能參與了aSAH后垂體功能障礙進程[4]。IGF-1聯合GOS評分是否能有效預測aSAH患者預后尚待探討。2016年6月—2019年6月,我們探討了IGF-1聯合GOS評分預測aSAH患者預后預測的價值。
1 資料與方法
1.1 臨床資料 選擇218例aSAH患者(aSAH組),納入標準:①顱腦CT和MRI提示出血灶,符合2015版《中國蛛網膜下腔出血診治指南》中診斷標準[5];②腦數字減影血管造影(DSA)檢查明確責任動脈瘤;③發病至入院時間<48 h。排除標準:①顱腦外傷、高血壓導致的腦出血、煙霧病、動靜脈畸形、假性動脈瘤;②合并顱內感染、全身感染、心血管疾病、肝腎功能障礙者;③入院48 h內死亡者。218例患者中男126例、女92例,年齡59~73(66.35±4.49)歲。發病至入院時間1~20(3.27±0.45)h,吸煙史100例,飲酒史87例,高血壓110例,糖尿病94例,高脂血癥68例,冠心病38例。動脈瘤位置:頸內動脈84例,前交通動脈75例,大腦中動脈59例;動脈瘤直徑:<5 mm者72例,6~15 mm者99例,>15 mm者47例。Hunt-Hess分級[6]Ⅰ~Ⅱ級125例,Ⅲ~Ⅴ級93例;改良Fisher分級[7]Ⅰ~Ⅱ級137例,Ⅲ~Ⅴ級81例;治療方式:血管介入術75例,開顱夾閉術110例,保守治療28例;入院至手術時間<72 h 111例,≥72 h 107例;術后并發癥:遲發性腦缺血[8]51例,腦出血59例,腦血管痙攣36例,腦積水47例。另選擇同期我院門診93例體檢健康者為對照組,男56例、女37例,年齡55~72(65.19±4.03)歲。兩組受試者年齡、性別比較無統計學差異(P>0.05)。本研究獲得我院倫理會批準,受試者或其家屬均知情同意簽署同意書。
1.2 血生化指標檢測 患者入院24 h內采集空腹肘靜脈血3~5 mL,置于TDZ4-WS低速自動平衡離心機(長沙湘智離心機儀器有限公司)4 ℃條件下離心取血漿,保存于-80 ℃超低溫冰箱(Thermo Fisher公司)。采用意大利BIOBASE2000型全自動酶免分析儀,以酶聯免疫吸附試驗檢測血清IGF-1、C反應蛋白(CRP)水平,試劑盒購自美國Epitope Diagnostics公司。羅氏 Modular全自動生化分析儀檢測總膽固醇(TC)、甘油三酯(TG)、低密度脂蛋白膽固醇(LDL-C)、高密度脂蛋白膽固醇(HDL-C)。雅培I2000全自動化學發光免疫分析儀及配套試劑檢測空腹血糖(FPG)。
1.3 GOS評分 aSAH組出院時進行GOS評分,1分為死亡;2分為植物生存狀態,僅有最小反應;3分為遺留重度殘疾,意識清醒,需要他人照顧;4分為遺留輕度殘疾,可獨立生活或在保護下工作;5分為患者恢復良好,可正常生活,經有輕度缺陷[3]。
1.4 預后判斷 患者出院后均隨訪6個月,采用改良Rankin量表(mRS)[9]評估患者臨床轉歸,0分為無功能受限和遺留癥狀;1分為有癥狀、無明顯功能障礙;2分為輕度殘疾、但生活能自理;3分為中度殘疾;4分為中重度殘疾;5分為重度殘疾。mRS評分≤2分為預后良好組,共150例,mRS評分>2分為預后不良組,共68例。
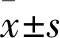
2 結果
2.1 aSAH組與對照組血漿IGF-1水平、GOS評分比較 aSAH組血漿IGF-1水平51~71(60.32±8.59)ng/mL,對照組75~129(92.15±15.46)ng/mL,aSAH組血漿IGF-1水平低于對照組(t=26.296,P<0.01)。aSAH組GOS評分1~5(3.03±0.25)分。
2.2 影響 aSAH預后的單因素分析 預后不良組年齡(66.91±6.34)歲,男40例、女28例,發病至入院時間(3.15±0.34)h,吸煙史31例,飲酒史26例,高血壓39例,糖尿病32例,高脂血癥27例,冠心病12例,動脈瘤位置:頸內動脈28例、前交通動脈24例、大腦中動脈16例,動脈瘤直徑<5mm 22例、6~15mm 30例、>15mm 16例,Hunt-Hess分級Ⅰ~Ⅱ級28例、Ⅲ~Ⅴ級40例,改良Fisher分級Ⅰ~Ⅱ級32例、Ⅲ~Ⅳ級36例,遲發性腦缺血30例,腦出血29例,腦血管痙攣15例,腦積水19例,治療方式:血管介入28例、開顱夾閉術35例、保守治療5例,入院至手術時間<72 h 26例、≥72 h 42例。預后良好組年齡(66.10±6.03)歲,男86例、女64例,發病至入院時間(3.32±0.47)h,吸煙史79例,飲酒史61例,高血壓71例,糖尿病62例,高脂血癥41例,冠心病26例,動脈瘤位置:頸內動脈56例、前交通動脈51例、大腦中動脈43例,動脈瘤直徑<5mm 50例、6~15mm 69例、>15mm 31例,Hunt-Hess分級 Ⅰ~Ⅱ級97例、Ⅲ~Ⅴ級53例,改良Fisher分級Ⅰ~Ⅱ級105例、Ⅲ~Ⅳ級45例,遲發性腦缺血21例,腦出血30例,腦血管痙攣21例,腦積水28例,治療方式 :血管介入47例、開顱夾閉術75例、保守治療23例,入院至手術時間<72 h 85例、≥72 h 65例。預后不良組與預后良好組年齡、性別比例、吸煙史比例、飲酒史比例、高血壓比例、糖尿病比例、高脂血癥比例、冠心病比例、動脈瘤位置、動脈瘤直徑、術后并發腦血管痙攣比例、并發腦積水比例、手術方式、比較差異均無統計學意義(P>0.05),預后不良組Hunt-Hess分級Ⅲ~Ⅳ級占比、改良Fisher分級Ⅲ~Ⅳ級占比、并發遲發性腦缺血比例、并發腦出血比例、入院至手術時間≥72h占比、FPG、血漿CRP高于預后良好組(P<0.05),血漿IGF-1水平、GOS評分低于預后良好組(P<0.05),兩組血生化指標檢測結果見表1。
表1 兩組血生化指標檢測結果
2.3 aSAH預后影響因素的Logisic回歸分析 以aSAH預后為因變量(0=轉歸不良,1=轉歸良好),Hunt-Hess分級(賦值:1=Ⅰ~Ⅱ級,2=Ⅲ~Ⅳ級)、改良Fisher分級(賦值:1=Ⅰ~Ⅱ級,2=Ⅲ~Ⅳ級)、并發遲發性腦缺血(賦值:1=是,0=否)、并發腦出血(賦值:1=是,0=否)、并發腦積水(賦值:1=是,0=否)、入院至手術時間(賦值:1=<72 h,2=≥72 h)、FPG(連續性變量)、CRP(連續性變量)、IGF-1(連續性變量)、GOS評分(連續性變量)為自變量,建立Logistic回歸模型,最終并發遲發性腦缺血、Hunt-Hess分級Ⅳ~Ⅴ級、低血漿IGF-1水平、低GOS評分是aSAH不良預后的獨立危險因素(P均<0.01),見表2。

表2 影響aSAH預后的Logistic回歸分析
2.4 血漿IGF-1水平聯合GOS評分對aSAH預后的預測價值 血漿IGF-1水平、GOS評分、IGF-1+ GOS預測aSAH預后不良的曲線下面積(AUC)分別為0.850、0.771、0.946,IGF-1+ GOS預測aSAH預后不良的AUC高于單獨IGF-1、GOS(Z分別為2.031、3.264,P均<0.05)。血漿IGF-1水平、GOS評分最佳截斷值(cut-off)分別為70.05 ng/mL、3分,血漿IGF-1水平、GOS評分、IGF-1+ GOS預測aSAH預后的效能見表3。
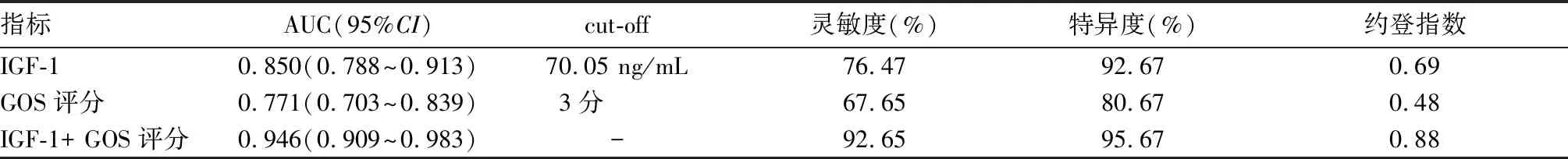
表3 血漿IGF-1水平、GOS評分、IGF-1+ GOS評分預測aSAH預后的效能
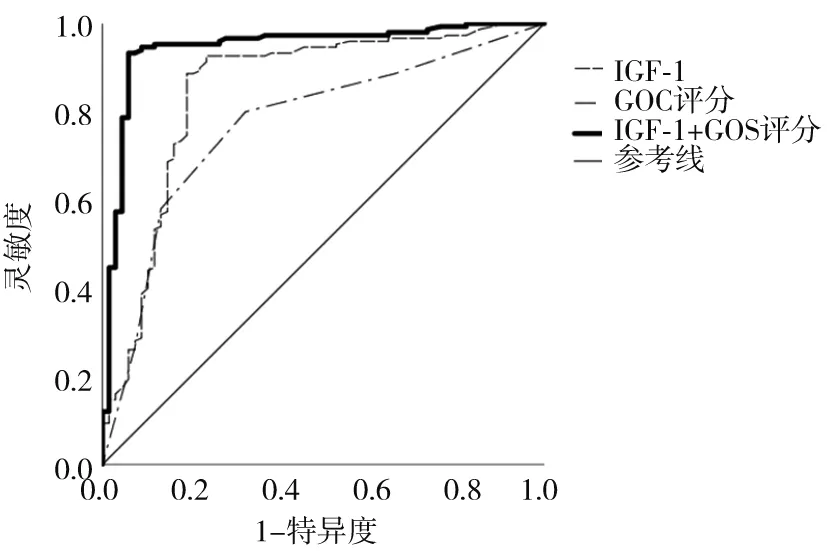
圖1 血漿IGF-1水平、GOS評分、IGF-1+ GOS評分預測aSAH預后的ROC曲線
3 討論
aSAH是動脈瘤破裂導致血液進入蛛網膜下腔引起的腦實質損傷性疾病,吸煙、飲酒、高血壓、遺傳等是aSAH發病的高危因素,aSAH發病急,病情進展迅速且兇險,早期得不到有效救治,可導致不可逆轉的腦損傷或腦死亡等,病死率高[10]。目前aSAH治療以保守治療、介入和手術治療為主,但療效仍不容樂觀,治療后早期出血、腦血管疾病、遲發性腦缺血、腦水腫等均可影響手術治療轉歸,增加病死率[11,12]。GOS評分是評估神經功能的敏感指標,本研究結果顯示,GOS評分降低是aSAH患者不良預后的危險因素之一,說明GOS評分可用于aSAH患者預后評估,但GOS評分對aSAH患者預后預測靈敏度和特異度均偏低,可能與其缺乏年齡、影像學檢查結果及與患者預后密切相關的生物學指標有關[13]。
IGF-1是一種分泌型小肽生長因子,參與機體生長、組織修復、碳水化合物、蛋白質和脂質代謝等多種生理和病理生理過程[14]。IGF-1作為生長激素關鍵調節因子,在生長發育中起重要作用,同時還參與調控中間代謝、組織修復和糖尿病、高血壓等慢性疾病發病機制[15]。近期研究顯示,外傷性腦損傷、aSAH后垂體功能障礙可影響患者認知和整體預后[16],垂體是人體內分泌器官的“頭領”,可分泌多種激素類物質,垂體功能障礙可導致神經內分泌紊亂,約12.1%創傷性腦損傷和aSAH患者血清IGF-1水平明顯下降[17],提示IGF-1缺失與aSAH發病和發展可能存在關聯。目前缺乏IGF-1與aSAH的相關報道,IGF-1是否能為aSAH預后評估提供有效信息尚不清楚。本研究結果顯示,aSAH組血清IGF-1水平低于對照組,且在預后不良組中血清IGF-1水平更低,說明IGF-1缺失可能與aSAH發病和不良預后有關。多因素分析結果顯示,低血清IGF-1水平是aSAH患者出院6個月內神經功能惡化的危險因素,驗證了IGF-1與aSAH患者預后的關系。IGF-1參與aSAH患者病情進展的機制:垂體位于鞍隔下方,被willis環包圍,對缺血敏感,腦組織損傷出血可影響垂體血供,導致垂體功能障礙,影響生長激素分泌,降低外周血IGF-1濃度[18]。IGF-1作為生長激素調節蛋白,具有維持神經元存活和軸突生長功能,在神經內分泌調節中發揮重要作用,IGF-1活性降低或表達缺失不僅影響神經元生長,而且可促使神經細胞凋亡、壞死,導致神經退行性病變和神經功能的惡化[19]。因此 IGF-1水平降低加劇了aSAH病情進展,導致不良預后的發生。
本研究結果顯示,IGF-1預測aSAH患者預后的AUC為0.850,靈敏度76.47%,特異度92.67%,提示IGF-1可作為一種新的生物標記物評價aSAH患者預后。而GOS評分聯合IGF-1預測aSAH患者不良預后的靈敏度和特異度提高,AUC大于GOS評分,說明增加IGF-1評估可彌補GOS評分不足,提高對aSAH患者預后評估的準確性。本研究多因素回歸分析結果顯示,并發遲發性腦缺血、Hunt-Hess分級Ⅳ~Ⅴ級是aSAH患者預后不良危險因素之一,遲發性腦缺血由腦血管痙攣引起,是aSAH的嚴重并發癥,可導致aSAH死亡[20]。Hunt-Hess Ⅳ~Ⅴ級預示較高的再出血和腦血管痙攣風險,臨床病死率高于Ⅰ~Ⅱ級患者[21]。提示對于低IGF-1、低GOS評分、并發遲發性腦缺血、Hunt-Hess Ⅳ~Ⅴ級的aSAH患者,應高度警惕不良預后的發生,加強病情監測和臨床干預以降低神經功能惡化的風險。
綜上所述,血漿IGF-1水平降低、GOS評分低與aSAH患者不良預后密切相關。IGF-1聯合GOS評分可提高對aSAH患者預后的預測價值。

