羊毛甾醇對X射線照射后大鼠晶狀體混濁形成的影響及機制
石圓圓,仇長宇,聶闖,宮玉波,李雨心,羅靈
戰略支援部隊特色醫學中心,北京100101
晶狀體是人體中對放射最敏感的組織之一[1]。既往研究認為,放射性白內障產生的閾值為2 Gy,近年研究認為,放射性白內障的發生可能低于此閾值,甚至是隨機事件[2,3]。而隨著電離輻射技術的廣泛應用,職業性放射性白內障仍不時發生[4~6],但放射性白內障發病機制仍不明確。既往研究提示,γ-射線照射可致大鼠晶狀體中多種晶狀體蛋白發生過氧化,可溶性蛋白含量減少[7~12]。目前普遍認為晶狀體蛋白異常聚合形成不溶的復合物從而形成混濁是先天和老年性白內障發生的主要原因[13]。因此晶狀體蛋白的異常聚合可能存在于放射性白內障的形成過程中。羊毛甾醇可在體外抑制晶狀體上皮細胞(LEC)內多種已知的先天性白內障突變基因編碼的蛋白聚集,從而抑制甚至逆轉白內障的形成。并且玻璃體腔注射羊毛甾醇可逆轉自然發生的狗的白內障,增加透明性[14]。羊毛甾醇能否在X射線引起的放射性晶狀體損傷中發揮抑制晶狀體蛋白的聚集作用,從而抑制白內障形成,目前尚無相關研究。2017年1月—2018年7月,我們探討了羊毛甾醇對X射線照射后大鼠晶狀體混濁形成的影響及機制。
1 材料與方法
1.1 材料 8周齡雄性SD大鼠[350~400 g,許可證號SCXK(京)2019-0010];SRA01/04 人LEC細胞株(美國 ATCC);M199培養液(美國Gibco),羊毛甾醇(美國Sigma),DMSO(上海Solarbio),RIPA裂解液試劑盒(北京雷根生物技術有限公司),BCA試劑盒(北京雷根生物技術有限公司),胎盤藍(美國Sigma);體式顯微鏡(德國Catl Zeiss Stemi 305),Clinac 600C/D直線加速器(美國Varian),離心機(美國 Beckman),酶標儀(美國Rio-Rad)。
1.2 大鼠晶狀體體外培養 選取8周齡SD大鼠,以頸椎脫臼法處死后,摘除眼球,剔除肌肉、筋膜等組織,安爾碘浸泡5 min,生理鹽水沖洗3次,將眼球浸于M199培養液中,體式顯微鏡下自后極部剪開鞏膜壁,取出晶狀體,盡量去除晶狀體表面的玻璃體,將晶狀體放入24孔板中培養,每孔加入1 mL 的含有5×104U/L青霉素和5×104U/L鏈霉素的M199培養液。于37 ℃、5%CO2溫箱中培養,培養1 d后棄去混濁晶狀體,留取透明晶狀體備用。
1.3 晶狀體X射線照射及分組 晶狀體于培養板中用X線加速器進行X射線照射,根據照射劑量分為分為0 Gy組、2 Gy組、4 Gy組、8 Gy組,每組3枚晶狀體。于照射后1、3、5、7 d在體式顯微鏡下觀察晶狀體變化,并拍照記錄。每48小時換液。另設8 Gy-羊毛甾醇組,于照射后即刻加入羊毛甾醇溶液(羊毛甾醇預先用DMSO溶解成混懸液,終濃度為40 μmol/L)。同時為除外滲透壓或DMSO本身的影響,設立8 Gy-DMSO對照組,即照射后加入與羊毛甾醇組相同量的DMSO。
1.4 晶狀體混濁度觀察及計算 晶狀體于培養板中,在體式顯微鏡下照相,照相背景為黑色,照相時使用相同放大倍率。圖片中黑色代表晶狀體透明,灰白色代表混濁。為定量分析羊毛甾醇干預效果,對8 Gy各組各時間點使用Image Pro Plus(IPP)軟件計算灰度值,灰度數值越高,代表晶狀體的混濁程度越重。
1.5 晶狀體總可溶性蛋白濃度測定 對0 Gy組、8 Gy組、8Gy-DMSO組和8Gy-羊毛甾醇組于培養第1、3、5、7天進行蛋白抽提,每組3枚晶狀體。按照裂解液試劑盒說明提取蛋白。主要步驟:將晶狀體用300 μL裂解液于1.5 mL EP管中勻漿裂解,其后加入200 μL裂解液,冰上靜置10 min。置離心機中(4 ℃下,15 000 r/min,15 min)離心取上清。按照BCA試劑盒方法,制作標準曲線。將上述上清液稀釋40倍后加入96孔板中,各孔加入BCA工作液后,37 ℃下溫浴30 min。用酶標儀測定各樣品孔在540 nm處的吸光度,根據標準曲線計算各孔蛋白濃度。
1.6 人LEC培養及X射線照射 采用SRA01/04 LEC細胞株以8.0×104/孔細胞密度接種于24孔培養板,培養36 h后達到90%融合,分為實驗組與對照組;于室溫下用X線加速器照射,照射總劑量分別為0 Gy、2 Gy、4 Gy、8 Gy,照射后更換新完全培養液,置于37 ℃培養箱培養。照射后實驗組立即加入1%DMSO溶解的羊毛甾醇,羊毛甾醇終濃度為40 μmol/L,對照組僅加入等量的DMSO。實驗組及對照組各為4個復孔。
1.7 LEC細胞形態學觀察及活細胞百分率計算 倒置相差顯微鏡下觀察細胞生長狀態及死亡情況,照射后72 h每組選一孔行臺盼藍染色檢查計算活細胞百分率。
1.8 人LEC中總可溶性蛋白濃度測定 照射后72 h對各孔細胞進行蛋白抽提及進行總的可溶性蛋白濃度測定。主要步驟:吸去培養液,每孔細胞加4 ℃預冷的PBS 0.01 mol/L(pH 7.2~7.3),洗滌2次。將PBS棄凈后每孔細胞加50 μL的RIPA裂解液,搖勻后于冰上裂解10 min。將細胞碎片和裂解液移至0.5 mL離心管中。于4 ℃下12 000 r/min離心5 min,將上清液提取用于蛋白濃度測定。按照BCA試劑盒說明進行。主要步驟:首先制作標準曲線。然后將10 μL樣品加入96孔板的樣品孔中,補加PBS至20 μL。各孔加入BCA工作液,37 ℃放置30 min。用酶標儀測定各樣品孔在540 nm處的吸光度,根據標準曲線計算出各孔蛋白濃度。
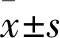
2 結果
2.1 體外培養晶狀體變化 隨著培養時間延長,未經照射即0 Gy組大鼠晶狀體基本保持透明,至第7天僅出現輕微皮質混濁;2 Gy組晶狀體于照射后第5天開始出現輕度皮質混濁;4 Gy組晶狀體于照射后第3天開始出現部分的輕度皮質混濁,第5天出現較為明顯的不均勻皮質混濁;8 Gy組晶狀體及8 Gy-DMSO組于照射后部分晶狀體于第1天即開始出現局部的輕度皮質混濁,第3天不均勻混濁繼續加重,第5天至第7天出現明顯的彌漫皮質混濁。8 Gy-羊毛甾醇組照射后第1天及第3天混濁不明顯,第5天出現彌漫混濁,第7天混濁進一步加重。因此,隨照射劑量的增加,晶狀體混濁出現更早,程度更重;8 Gy-羊毛甾醇組較8 Gy組及8 Gy-DMSO組出現混濁時間延遲。8 Gy組、8 Gy-DMSO組、8 Gy-羊毛甾醇組各時點灰度值比較見表1。
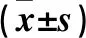
表1 8 Gy組、8 Gy-DMSO組、8 Gy-羊毛甾醇組不同時點灰度值比較
2.2 各組照射后不同時點晶狀體總可溶性蛋白含量比較 0 Gy組、8 Gy組、8 Gy-DMSO組及8 Gy羊毛甾醇組不同時點晶狀體總可溶性蛋白含量比較見表2。
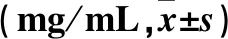
表2 各組不同時點晶狀體總可溶性蛋白含量比較
2.3 照射72 h后LEC細胞形態及活細胞百分率 照射72 h后細胞形態無明顯改變,臺盼藍染色計算活細胞百分率為90%。照射后細胞在96 h開始出現明顯死亡。
2.4 兩組不同照射劑量晶狀體上皮細胞中總可溶性蛋白含量比較 經0、2、4、8 Gy照射后72 h晶狀體上皮細胞中總可溶性蛋白含量比較見表3。
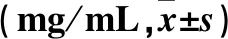
表3 兩組不同照射劑量晶狀體上皮細胞中可溶性蛋白含量比較
3 討論
白內障形成的機制一直未闡明,有觀點認為先天性、老年性白內障發生的機制為各種原因導致晶狀體蛋白聚合成不溶的大分子量復合物,從而形成晶狀體內光散射和混濁[7]。晶狀體蛋白是人類晶狀體細胞漿中主要的結構蛋白,在晶狀體可溶性蛋白中約占90%。它與周圍的細胞骨架蛋白相互結合,整齊排列,保持晶狀體的透明性[8]。近來研究發現羊毛甾醇通過抑制晶狀體蛋白聚集或解聚已聚集的晶狀體蛋白,可以預防或治療白內障[14~16],是白內障藥物治療的重大突破。并且在人白內障標本中亦發現羊毛甾醇合酶活性與皮質性白內障的嚴重程度有相關性[15]。
研究顯示放射也可引起動物晶狀體內蛋白含量和結構的改變。Abdelkawi[7]發現,用γ射線對8周齡Wistar大鼠行單次或分次總劑量為4 Gy全身照射時,24 h后即可觀察到總可溶性蛋白含量降低40%左右,其中α、β和γ晶狀體蛋白均出現含量和分子質量的改變。在蛋白結構上,射線照射會造成晶狀體蛋白的氨基酸位點發生氧化,分子伴侶功能發生下降,從而促進蛋白的聚集[10,12]。此外,基于羊毛甾醇及羊毛甾醇合酶已被證實存在于大鼠晶狀體組織中[17],即具有作用于晶狀體組織的分子基礎,我們設計觀察了羊毛甾醇在X射線照射大鼠晶狀體或人LEC中的作用。
為能夠連續并直觀地觀察晶狀體混濁變化情況,我們選用了體外培養晶狀體的方法。實驗觀察到X射線可促進體外培養的大鼠晶狀體混濁的發生發展,且隨照射劑量的增加,晶狀體混濁發生越早,混濁愈重。其中,8 Gy劑量下在照射后第1天晶狀體就會發生局部輕度混濁,第3天就開始出現較為明顯的混濁,并且在7 d的觀察時間框內發展為嚴重的晶狀體全混濁。而2 Gy和4 Gy劑量時晶狀體混濁出現時間較晚,且程度發展不一。為便于觀察羊毛甾醇的抑制效果,我們選擇予8 Gy劑量照射的晶狀體加入羊毛甾醇溶液。結果顯示,加入羊毛甾醇的晶狀體在照射后第3天時明顯較對照晶狀體的透明度高,即混濁發生時間延遲2 d。此外,對晶狀體內可溶性蛋白含量測定顯示,羊毛甾醇組可溶性蛋白含量,高于對照組,并且羊毛甾醇組可溶性蛋白在第5天方出現明顯降低,而對照組在第3天已出現明顯降低,即可溶性蛋白含量降低羊毛甾醇組遲于對照組。這提示羊毛甾醇可抑制晶狀體混濁的發展,并可以抑制放射性晶狀體損傷中可溶性蛋白含量的減少。但同時,應注意到羊毛甾醇組可溶性蛋白含量仍低于0 Gy組,并且羊毛甾醇組在照射后第5天和第7天晶體混濁程度與對照組差異無統計學意義,提示羊毛甾醇并不能完全阻止晶狀體混濁的發展。我們認為這可能與放射性白內障損傷的復雜性有關。晶狀體透明性的維持,除了需細胞內晶狀體蛋白保持可溶性以外,尚需要細胞的規則排列。既往研究發現射線除造成蛋白的氧化損傷以外,還會直接造成晶狀體上皮細胞的DNA破壞,造成細胞分化異常及細胞死亡,從而破壞晶狀體細胞的規則排列[8];此外放射可造成自由基產生,谷胱甘肽降低,使得氧化和抗氧化失衡,亦會加重細胞膜的損害[7,9]。這些復雜的因素共同促進了放射性白內障的形成。我們在實驗中曾設置加入400 μmol羊毛甾醇的觀察組,但因羊毛甾醇易溶于有機溶劑[18],水溶性極差,高濃度羊毛甾醇溶液形成混懸液,有明顯較大顆粒物質。將其加入晶狀體培養液后,培養液亦呈混濁外觀,有大顆粒懸浮,影響晶體外觀的觀察。并且也并未發現其有明顯的抑制混濁形成的作用。分析原因,考慮較高的藥物濃度可能帶來滲透壓改變,并且在轉運或移動培養板過程中,大顆粒物質與晶狀體之間可能發生機械性摩擦,從而可能反而產生促進白內障的發生的作用。
進一步我們分析了X射線照射人LEC后72 h的可溶性晶狀體蛋白含量。結果顯示隨照射劑量的增加,可溶性晶狀體蛋白含量逐漸降低。而羊毛甾醇可抑制LEC中可溶性蛋白含量的減少。此外我們觀察到照射細胞后96 h開始出現細胞死亡,聯系在晶狀體體外培養模型中照射3 d后晶狀體混濁可見加速發展的現象,細胞死亡可能參與這一過程。
綜上所述,羊毛甾醇可抑制X射線照射誘導的晶狀體混濁的發生,其機制可能為通過降低晶狀體可溶性蛋白的丟失實現。

