湖北和廣西辣椒脈斑駁病毒的檢測(cè)及遺傳多樣性分析
李桑桑 胡榮 羅香文 李詩君 卜珊 張宇 劉勇 張松柏

摘要:【目的】研究辣椒脈斑駁病毒(Pepper veinal mottle virus,PVMV)的分布及遺傳變異,為明確該病毒在我國的流行擴(kuò)散分子機(jī)制提供理論依據(jù)。【方法】利用特異性引物反轉(zhuǎn)錄PCR(RT-PCR)檢測(cè)從湖北宜昌及廣西南寧和百色采集的48份疑似感染PVMV的辣椒樣本;采用常規(guī)Sanger測(cè)序測(cè)定PCR產(chǎn)物序列,序列采用MEGA 5.0構(gòu)建系統(tǒng)發(fā)育進(jìn)化樹,采用RDP等算法分析其可能的重組事件;采用DnaSP v5分析病毒株系不同群體之間的基因流及基因差異。【結(jié)果】從48份辣椒樣本中檢測(cè)到5份樣本被PVMV侵染,檢出率10.42%。基因同源性比對(duì)分析結(jié)果表明,測(cè)定的PVMV湖北和廣西分離物CP基因序列同源性在97.00%以上,與其他地區(qū)分離物的同源性為91.73%~98.78%。系統(tǒng)發(fā)育分析表明,湖北(YC)和廣西(NN)PVMV分離物與我國臺(tái)灣PVMV分離物的親緣關(guān)系最近。重組分析表明,PVMV廣西分離物NN10有2個(gè)重組事件。【結(jié)論】湖北和廣西辣椒的PVMV檢測(cè)結(jié)果表明,該病毒已擴(kuò)散至湖北和廣西;基因突變可能是PVMV湖北分離物遺傳變異的主要方式之一;而基因重組和基因突變可能是PVMV廣西分離物遺傳變異的重要因子。
關(guān)鍵詞: 辣椒脈斑駁病毒;RT-PCR;系統(tǒng)發(fā)育分析;重組;湖北;廣西
中圖分類號(hào): S436.418.1? ? ? ? ? ? ? ? ? ? ? ? ? ?文獻(xiàn)標(biāo)志碼: A 文章編號(hào):2095-1191(2020)07-1693-06
Abstract:【Objective】This study aimed to define the distribution and genetic variation of Pepper veinal mottle virus(PVMV), the results would be contributed to understanding the dispersing molecular mechanism of PVMV in China. 【Method】PVMV was identified by specific primer reverse transcription PCR(RT-PCR) from 48 suspected pepper samples, which collected from Yichang in Hubei, and Nanning and Baise in Guangxi, and amplified products by PCR were sequenced by Sanger sequencing. The phylogenetic tree was constructed by MEGA 5.0. The recombinant events were analyzed by RDP algorithm. The gene flow and gene differentiation of different populations of PVMV isolates was analyzed by DnaSP v5. 【Result】There werefive PVMV positive pepper samples confirmed by RT-PCR among the 48 samples, and the incidence of PVMV in Hubei and Guangxi was 10.42%. According to gene homology detection, the sequences of CP genes of Hubei and Guangxi isolates shared over 97.00% identity with each other, and shared 91.72%-98.78% with isolates from others areas. Phylogenetic analysis showed the relationship of Hubei(YC) and Guangxi(NN) isolates had the closest relation isolates of Taiwan of China. There were two recombinant events detected in PVMV Guangxi isolate NN10. 【Conclusion】The survey and detection of PVMV shows that PVMV has infected pepper plants in Hubei and Guangxi.Gene mutation may be one of key patterns for evolution of PVMV Hubei isolates, and gene mutation and recombinant are probably key factors for PVMV guangxi isolates evolution.
Key words: Pepper veinal mottle virus; RT-PCR; phylogenetic analysis; recombination; Hubei; Guangxi
Foundation item: National Natural Science Foundation of China(317017765)
0 引言
【研究意義】辣椒脈斑駁病毒(Pepper veinal mottle virus,PVMV)是近年來我國辣椒上的一種新發(fā)病毒(Cheng et al.,2011; Zhang et al.,2016)。該病毒侵染辣椒,能導(dǎo)致辣椒整株矮縮、葉片畸形、葉脈暗綠,葉片、花易掉落,果實(shí)畸形或著色不均勻,嚴(yán)重影響辣椒的產(chǎn)品和品質(zhì)(Tsai et al.,2010)。PVMV屬馬鈴薯Y病毒屬(Potyvirus)馬鈴薯病毒科(Potyviridae)成員,該屬植物病毒寄主范圍廣,既能通過傳毒介體蚜蟲傳播,也可通過病株汁液或機(jī)械接觸方式傳播,且傳播速度快,危害嚴(yán)重(Rajam?ki et al.,2004)。因此,明確PVMV在我國辣椒主產(chǎn)區(qū)的發(fā)生情況及不同地區(qū)分離物的遺傳變異,對(duì)于明確該病毒對(duì)我國辣椒的潛在威脅具有非常重要的意義。【前人研究進(jìn)展】PVMV于1971年在加納北部的辣椒和矮牽牛上首次被發(fā)現(xiàn)(Brunt et al.,1978),隨后非洲南部多國報(bào)道PVMV侵染多種茄科重要作物,如番茄、辣椒、茄子和煙草等(Atiri,1986;Alegbejo,1999);此外,該病毒已蔓延到非洲西北部多國,嚴(yán)重影響辣椒和番茄的生產(chǎn)(Moury et al.,2005;Tsai et al.,2010;Arogundade et al.,2012)。在亞洲地區(qū),我國臺(tái)灣省首先報(bào)道該病毒危害辣椒和番茄(Cheng et al.,2009,2011),隨后在我國其他地區(qū)也發(fā)現(xiàn)該病毒為害(Zhang et al.,2016;劉健等,2016;王莉爽等,2017)。目前,有關(guān)PVMV的研究主要集中在基因組序列測(cè)定與分析、病毒與寄主互作分子機(jī)制等方面。Zhang等(2015)研究表明,PVMV分離物存在明顯的區(qū)域分化,侵染我國湖南省辣椒的PVMV分離物與我國臺(tái)灣分離物的親緣關(guān)系最近,湖南分離物可能是一個(gè)新穎的重組子。Akinyemi等(2016)采用高通量測(cè)序技術(shù)研究發(fā)現(xiàn),PVMV與其他植物病毒共同侵染煙草,并組裝了PVMV的全基因組序列。王莉爽等(2017)研究表明,貴州辣椒PVMV分離物與四川和云南分離物的親緣關(guān)系最近,且存在明顯的遺傳變異。Bolou Bi等(2018)發(fā)現(xiàn)侵染辣椒的PVMV不同分離物存在明顯的遺傳分化。Laina等(2019)研究發(fā)現(xiàn)日本PVMV分離物與非洲分離物的親緣關(guān)系最近。Moury等(2020)研究表明,寄主基因eIF4E2是PVMV復(fù)制所必須的寄主因子。以上研究表明,PVMV呈現(xiàn)快速擴(kuò)展態(tài)勢(shì),且不同地區(qū)存在明顯的遺傳變異。【本研究切入點(diǎn)】雖然PVMV在我國多個(gè)省份發(fā)生為害,但在我國的具體分布及其分離物的遺傳變異均需進(jìn)一步研究。【擬解決的關(guān)鍵問題】湖南省植物保護(hù)研究所已報(bào)道PVMV湖南分離物全基因組序列(Zhang et al.,2015),以該基因組序列和GenBank中公布的其他PVMV全基因組序列為模板,設(shè)計(jì)特異性反轉(zhuǎn)錄PCR(RT-PCR)引物擴(kuò)增PVMV CP基因,檢測(cè)從湖北和廣西采集的疑似感染PVMV的辣椒樣本,明確PVMV的分布;采用常規(guī)Sanger測(cè)序測(cè)定PCR產(chǎn)物序列,分析序列的遺傳變異,為揭示該病毒的流行擴(kuò)散分子機(jī)制提供理論依據(jù)。
1 材料與方法
1. 1 試驗(yàn)材料
供試?yán)苯窐颖居?017年7月和2019年8月分別采集自湖北宜昌及廣西南寧和百色。采集的辣椒樣本有明顯的病毒侵染癥狀,包括植株略矮化,葉片畸形、斑駁等。辣椒樣本共計(jì)48份,相關(guān)信息見表1。
TRIzol試劑、一步法RT-PCR試劑盒和凝膠DNA回收試劑盒等均購自北京全式金生物技術(shù)有限公司。
1. 2 試驗(yàn)方法
1. 2. 1 總RNA抽提 辣椒葉片總RNA抽提采用TRIzol試劑,具體步驟參照說明書。
1. 2. 2 RT-PCR檢測(cè) 采用Primer 5.0設(shè)計(jì)PVMV特異性PCR檢測(cè)引物,以PVMV湖南分離物全基因組(GenBank登錄號(hào)KR002568)為模板,設(shè)計(jì)擴(kuò)增PVMV CP基因的特異性引物(CP-F:5'-AATTAAG CCATTGATTGACCA-3',CP-R:5'-AGCGCCAATTA TGAAACCGC-3')。PVMV特異性RT-PCR,采用一步法RT-PCR試劑盒,RT-PCR體系20.0 ?L:RNA模板1.0 ?L,dNTPs(10 mmol/L)1.0 ?L,隨機(jī)六聚體引物(50 ?mol/L)1.0 ?L,PrimeScript II PCR Buffer 4.0 ?L,上、下游引物各0.5 ?L,反轉(zhuǎn)錄/聚合酶混合物0.5 ?L,RNase inhibitor(40 U/?L) 0.5 ?L,加RNase-free ddH2O至20.0 ?L。RT-PCR擴(kuò)增程序:65 ℃ 5 min,42 ℃ 60 min,95 ℃ 5 min;95 ℃ 30 s,56 ℃ 30 s,72 ℃ 1 min,進(jìn)行30個(gè)循環(huán);72 ℃10 min,4 ℃保存。PCR產(chǎn)物采用1.5%瓊脂糖凝膠電泳進(jìn)行檢測(cè)。
1. 2. 3 序列測(cè)定 采用凝膠DNA回收試劑盒回收PCR特異性條帶,具體步驟參照說明書。回收純化的PCR產(chǎn)物由生工生物工程(上海)股份有限公司采用常規(guī)Sanger測(cè)序技術(shù)測(cè)序。
1. 3 核苷酸序列分析
采用CLUSTAL W對(duì)PVMV不同分離物的CP基因序列進(jìn)行多序列聯(lián)配,采用MEGA 5.0構(gòu)建最大似然法(Maximum-likelihood)系統(tǒng)發(fā)育進(jìn)化樹(Tamura et al.,2011)。利用MaxChi(Smith,1992)、GENECONV(Padidam et al.,1999)、SISCAN(Gibbs et al.,2000)、CHIMAERA(Posada and Crandall,2001)、RDP4軟件的BOOTSCAN(Martin et al.,2015)和Recombination Detection Program(RDP)(Martin et al.,2015)進(jìn)行PVMV不同分離物間的序列重組分析。PVMV不同分離物之間的序列突變采用MEGA 5.0分析最大可能性堿基替換(Tamura et al.,2011)。采用DnaSP v5分析PVMV不同群體之間的基因流及基因差異(Librado and Rozas,2009)。
2 結(jié)果與分析
2. 1 PVMV檢出率
對(duì)湖北和廣西的48份辣椒樣本進(jìn)行RT-PCR檢測(cè),得到大小為761 bp的特異性條帶,與預(yù)期結(jié)果一致(圖1)。共有5份PVMV陽性樣本被檢出,其中宜昌遠(yuǎn)安縣2份,其他3個(gè)地區(qū)各1份。湖北和廣西辣椒的PVMV檢出率為10.42%。
2. 2 PVMV序列系統(tǒng)發(fā)育分析結(jié)果
將測(cè)定的PVMV湖北和廣西分離物的CP基因序列片段在GenBank中進(jìn)行核苷酸序列BLAST比對(duì),結(jié)果表明,PVMV湖北和廣西分離物的CP基因序列之間的同源性在97.00%以上,與其他地區(qū)分離物的同源性為91.73%~98.78%。
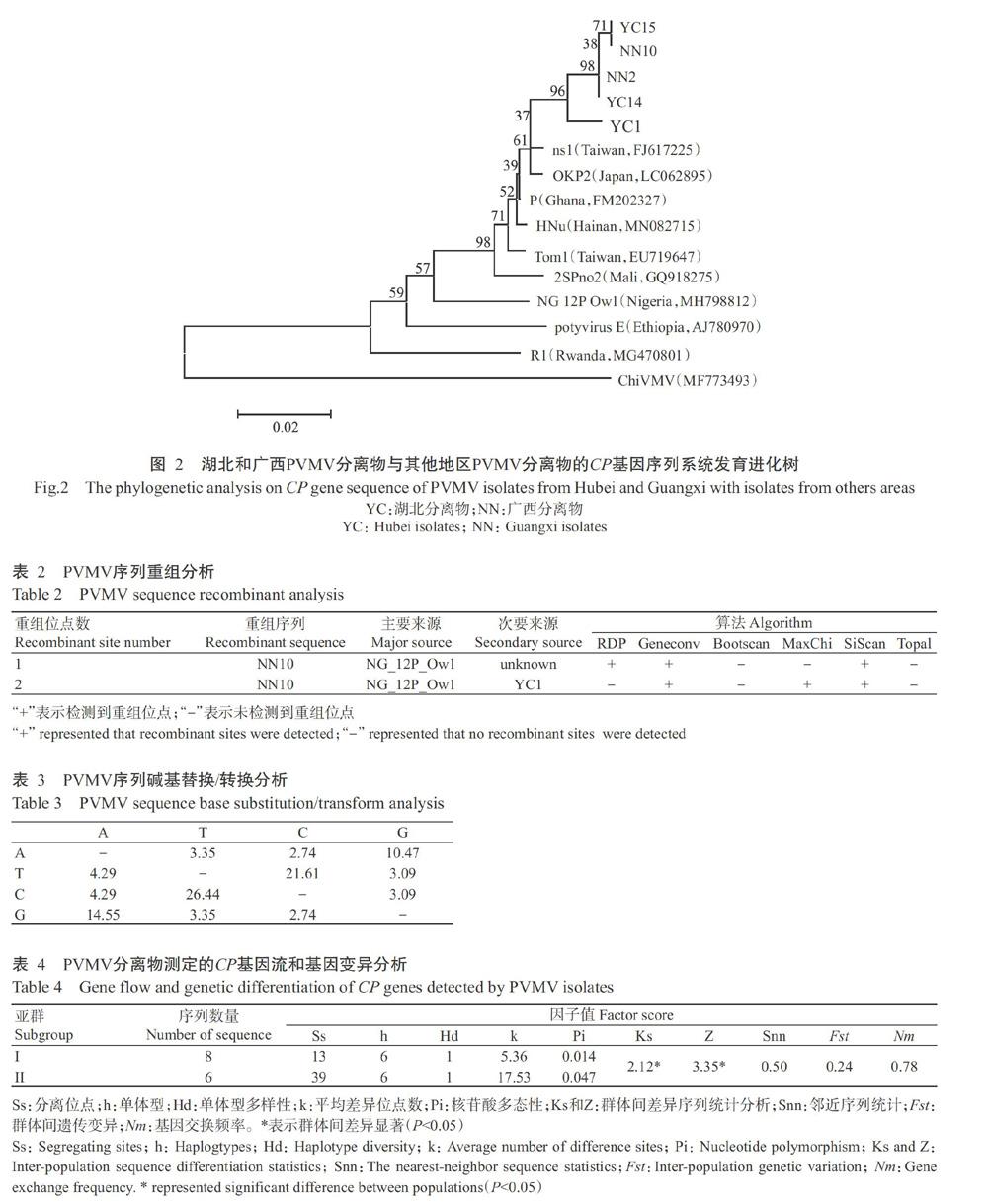
序列系統(tǒng)發(fā)育分析結(jié)果(圖2)表明,湖北分離物(YC)與廣西分離物(NN)親緣關(guān)系最近,聚為一個(gè)亞簇;兩個(gè)省份的PVMV分離物與我國臺(tái)灣PVMV分離物ns1(FJ617225)的親緣關(guān)系最近。
2. 3 PVMV序列重組分析結(jié)果
PVMV序列重組分析結(jié)果(表2)顯示,分別有3種算法得到廣西PVMV分離物NN10的CP基因序列有2個(gè)重組事件:重組事件1(算法RDP、Geneconv和SiScan)的主要序列來源和次要序列來源分別是非洲尼日利亞(Nigeria)分離物NG_12P_Ow1和一個(gè)未知分離物;重組事件2(算法Geneconv、MaxChi和SiScan)的主要序列來源和次要序列來源分別是非洲尼日利亞(Nigeria)分離物NG_12P_Ow1和湖北的分離物YC1。
2. 4 PVMV序列突變分析結(jié)果
PVMV CP基因的突變分析結(jié)果表明,PVMV分離物CP基因的堿基頻率分別為:A(0.319)、T(0.249)、C(0.203)和G(0.229);嘌呤(A/G)的替換/轉(zhuǎn)換率(k1)為3.390,嘧啶(C/T)的替換/轉(zhuǎn)換率(k2)為7.896。PVMV CP基因總體的堿基替換/轉(zhuǎn)換率(R)為2.226,以嘧啶(C/T)的替換/轉(zhuǎn)換(26.44)為主(表3)。
2. 5 PVMV序列基因流及基因變異分析結(jié)果
將PVMV分離物CP基因序列分為我國分離物群(I亞群)和國外分離物群(II亞群)兩個(gè)群體,采用DnaSP v5分析兩個(gè)群體間CP基因的變異及基因流。兩個(gè)群體CP基因的基因變異分析結(jié)果(表4)表明,我國PVMV分離物群體CP基因的分離位點(diǎn)數(shù)量(Ss)、平均差異位點(diǎn)數(shù)(k)和核苷酸多態(tài)性(Pi)分別為13、5.36和0.014;而國外PVMV分離物群體的CP基因的Ss、k和Pi分別為39、17.53和0.047;兩個(gè)群體CP基因的基因流分析結(jié)果表明,群體間的遺傳變異(Fst)為0.24,兩個(gè)群體間的基因交換頻率(Nm)低(0.78)。
3 討論
PVMV屬馬鈴薯Y病毒屬馬鈴薯病毒科成員,能通過多種方式傳播,目前在我國呈快速擴(kuò)展的趨勢(shì)(燕照玲等,2017)。本研究結(jié)果表明PVMV已擴(kuò)散至華中地區(qū)的湖北和西南地區(qū)的廣西,進(jìn)一步證實(shí)該病毒在我國快速擴(kuò)散,結(jié)合其他地區(qū)的報(bào)道(Cheng et al.,2011;Zhang et al.,2016;劉健等,2016;王莉爽等,2017),表明該病毒可能在我國絕大多數(shù)辣椒主產(chǎn)區(qū)發(fā)生危害。由于該病毒侵染辣椒,會(huì)導(dǎo)致辣椒嚴(yán)重減產(chǎn),因此,急需加強(qiáng)抗性育種以及應(yīng)急防控技術(shù)措施等方面的研究與應(yīng)用。
PVMV序列系統(tǒng)發(fā)育分析結(jié)果表明,湖北和廣西PVMV分離物與我國臺(tái)灣分離物的親緣關(guān)系最近,該結(jié)果與Zhang等(2015)的研究結(jié)果存在一定差異,Zhang等(2015)研究發(fā)現(xiàn)PVMV湖南分離物與我國臺(tái)灣和非洲加納分離物親緣關(guān)系最近。而最新研究表明,PVMV日本分離物與東南亞分離物的親緣關(guān)系最近,與非洲分離物的親緣關(guān)系較遠(yuǎn)(Laina et al.,2019)。根據(jù)上述研究結(jié)果,可推測(cè)不同地區(qū)的PVMV分離物可能存在不同的選擇壓力,因此,其基因組可能通過不同方式進(jìn)行適應(yīng)性進(jìn)化。
研究表明,植物病毒序列重組和突變等遺傳變異是植物病毒適應(yīng)性進(jìn)化最重要的兩種方式;正鏈RNA植物病毒通過基因重組和(或)突變,可促進(jìn)基因組序列的變異,從而改變病毒群體,以適應(yīng)寄主品種或環(huán)境等的選擇壓力(Bentley and Evans,2018)。對(duì)貴州PVMV分離物的研究表明,貴州分離物存在明顯的株系分化,但是未深入分析其分化的分子機(jī)理(王莉爽等,2017)。湖南PVMV分離物全基因組分析表明,PVMV湖南分離物是一個(gè)新穎的重組子,表明重組可能在PVMV遺傳進(jìn)化中發(fā)揮重要作用(Zhang et al.,2015)。本研究分析推測(cè),廣西南寧PVMV分離物與非洲尼日利亞分離物和我國湖北分離物存在重組,因此,廣西南寧的PVMV分離物可能與湖南分離物相似,通過重組的方式改變其基因,從而適應(yīng)性進(jìn)化。
然而,PVMV湖北分離物的CP基因序列沒有重組事件,可能通過其他方式進(jìn)行適應(yīng)性進(jìn)化。研究表明,在寄主與病原物的互作中,寄主與病原物存在共同進(jìn)化的現(xiàn)象(Samantha et al.,2004);而在寄主—病原物共同進(jìn)化過程中,基因突變(Yin et al.,2013)和基因轉(zhuǎn)移(Wei et al.,2009)是植物病原物遺傳變異的重要方式。對(duì)病毒及寄主(宿主)的研究表明,基因的水平轉(zhuǎn)移在細(xì)菌及病毒致病性、寄主和環(huán)境的適應(yīng)性中發(fā)揮重要作用(Dr?ge et al.,1999;Bahl et al.,2009)。本研究結(jié)果表明,PVMV湖北和廣西分離物的CP基因存在明顯的核苷酸堿基替換/轉(zhuǎn)換率(R=2.226),以嘧啶(C/T)的替換/轉(zhuǎn)換為主,由此推測(cè)PVMV湖北和廣西分離物的基因突變可能也是該病毒遺傳變異的主要方式。PVMV湖北和廣西分離物CP基因序列的基因流分析表明,國外PVMV群體的多態(tài)性明顯高于我國PVMV分離物群體;而且國外PVMV分離物群體與我國PVMV分離物群體間CP基因的遺傳變異(Fst)為0.24,兩個(gè)群體間的基因交換頻率(Nm)低(0.78)。有研究表明,地區(qū)隔離是影響病毒分離物之間基因交流的重要因素(Lam et al.,2012),由此推測(cè),我國PVMV群體與國外群體可能由于地域隔離,導(dǎo)致相互之間的基因交換頻率低,表明基因轉(zhuǎn)移不是我國PVMV分離物遺傳變異的主要因素。
為明確PVMV在我國辣椒等茄科主要經(jīng)濟(jì)作物主產(chǎn)區(qū)的快速擴(kuò)散分子機(jī)制,急需測(cè)定更多地區(qū)PVMV分離物的序列,分析其遺傳變異的方式,研究結(jié)果可為揭示該病毒的快速擴(kuò)散提供科學(xué)依據(jù),也為抗性育種等研究提供理論參考。
4 結(jié)論
湖北和廣西辣椒的PVMV檢測(cè)結(jié)果表明,該病毒已擴(kuò)散至湖北和廣西;基因突變可能是PVMV湖北分離物遺傳變異的主要方式之一;而基因重組和基因突變可能是PVMV廣西分離物遺傳變異的重要因子。
參考文獻(xiàn):
劉健,張德詠,張松柏,劉勇. 2016. 湖南和福建辣椒上脈斑駁病毒的檢測(cè)及系統(tǒng)發(fā)育分析[J]. 江蘇農(nóng)業(yè)科學(xué),44(5):184-185. [Liu J,Zhang D Y,Zhang S B,Liu Y. 2016. Detection and phylogenetic analysis of Pepper veinal mottle virus in Hunan and Fujian[J]. Jiangsu Agricultural Science,44(5):184-185.]
王莉爽,陳小均,何海永,譚清群,陳文,黃露,楊學(xué)輝. 2017. 貴州辣椒脈斑駁病毒的檢測(cè)及株系分化研究[J]. 南方農(nóng)業(yè)學(xué)報(bào),48(7):1220-1224. [Wang L S,Chen X J,He H Y,Tan Q Q,Chen W,Huang L,Yang X H. 2017. Detection of Chilli veinal mottle virus from Guizhou and its strain differentiation[J]. Journal of Southern Agriculture,48(7):1220-1224.]
燕照玲,段俊枝,馮麗麗,陳海燕,齊紅志,楊翠蘋,施艷,張會(huì)芳. 2017. 馬鈴薯Y病毒屬病毒編碼蛋白與寄主植物葉綠體蛋白互作研究進(jìn)展[J]. 河南農(nóng)業(yè)科學(xué),46(11):1-5. [Yan Z L,Duan J Z,F(xiàn)eng L L,Chen H Y,Qi H Z,Yang C P,Shi Y,Zhang H F. 2017. Progress on interaction between potyviruses-coded proteins and chloroplast proteins of host plants[J]. Journal of Henan Agricultural Sciences,46(11):1-5.]
Akinyemi I A,Wang F,Zhou B G,Qi S S,Wu Q F. 2016. Ecogenomic survey of plant viruses infecting tobacco by next genration sequencing[J]. Virology Journal,13(1):181.
Alegbejo M D. 1999. Physalis micrantha L.,a weed host of Pepper veinal mottle virus[J]. Journal of Vegetable Crop Production,5(1):59-66.
Arogundade O,Balogun O S,Kareem K T. 2012. Occurrence and distribution of Pepper veinal mottle virus and Cucumber mosaic virus in pepper in Ibadan,Nigeria[J].Virology Journal,9:79-82.
Atiri G I. 1986. A disease of fluted pumpkin(Telfaira occidentalis Hook.F.) caused by a yellow vein-clearing strain of Pepper veinal mottle virus in Nigeria[J]. Journal of Plant Protection Tropics,3:105-110.
Bahl J,Vijaykrishna D,Holmes E C,Smith G J D,Guan Y. 2009. Gene flow and competitive exclusion of avian influenza A virus in natural reservoir hosts[J]. Virology,390(2):289-297.
Bentley K, Evans D J. 2018. Mechanisms and consequences of positive-strand RNA virus recombination[J]. Journal of Genenal Virology,99(10):1345-1356.
Bolou Bi B A,Moury B,Sorho K A F,Cherif M,Girardot G,Kouassi N P,Kone D. 2018. Survery of viruses infecting open-field pepper crops in C?te d'Ivoire and diversity of Pepper veinal mottle virus and Cucumber mosaic virus[J]. Plant Pathology,67(6):1416-1425.
Brunt A A,Kenten R H,Phillips S. 1978. Symptomatologically distinct strains of Pepper veinal mottle virus from four West Africa Solanaceous crops[J]. Annals of Applied Bio-logy,88:115-119.
Cheng Y H,Deng T C,Chen C C,Liao J Y,Chang C A,Chiang C H. 2011. First report of Pepper mottle virus in bell pepper in Taiwan[J]. Plant Disease,95(5):617.
Cheng Y H,Wang R Y,Chen C C,Chang C A,Jan F J. 2009. First report of Pepper veinal mottle virus in tomato and pepper in Taiwan[J]. Plant Disease,93(1):107.
Dr?ge M,Pühler A,Selbitschka W. 1999. Horizontal gene transfer among bacteria in terrestrial and aquantic habitats as assessed by microcosm and field studies[J]. Bio-logy and Fertility of Soils,29(3):221-245.
Gibbs M J,Armstrong J S,Gibbs A J. 2000. Sister-scanning:A Monte Carlo procedure for assessing signals in recombinant sequences[J]. Bioinformatics,16:573-582.
Laina J A,Matsumoto K,Setoyama T,Kawano S,Ohshima K. 2019. Pepper veinal mottle virus in Japan is closely related to isolates from other Asian countries,but more distantly to most of those from Africa[J].Virus Genes,55(3):347-355.
Lam T T,Hon S,Ghedin E,Wentworth D E,Halpin R A,Stockwell T B,Spiro D J,Dusek R J,Hoskins J,Bales B D,Yparraguirre D,Holmes E C. 2012. Migratory flyway and geographical distance are barriers to the gene flow of influenza virus among north american birds[J]. Ecology Letters,15(1):24-33.
Librado P,Rozas J. 2009. DnaSP v5:A software for comprehensive analysis of DNA polymorphism data[J]. Bioinformatics,25(11):1451-1452.
Martin D P,Murrell B,Golden M,Khoosal A,Muhire B. 2015. RDP4:Detection and analysis of recombination patterns invirus genomes[J]. Virus Evolution,1(1):vev003.
Moury B,Lebaron C,Szadkowski M,Ben Khalifa M,Girardot G,Bolou Bi B A,Koné D,Nitiema L W,F(xiàn)akhfakh H,Gallois J L. 2020. Knock-out mutation of eukaryotic initiation factor 4E2 (eIF4E2) confers resistance to Pepper veinal mottle virus in tomato[J]. Virology,539:11-17.
Moury B,Palloix A,Caranta C,Gognalons P,Souche S,Selassie K G,Marchoux. G. 2005. Serological,molecular,and pathotype diversity of Pepper veinal mottle virus and Chili veinal mottle virus[J]. Journal of Phytopathology,95(3):227-232.
Padidam M,Sawyer S,F(xiàn)auquet C M. 1999. Possible emergence of new geminiviruses by frequent recombination[J]. Virololy,265(2):218-225.
Posada D,Crandall K A. 2001. Evaluation of methods for detecting recombination from DNA sequences:Computer simulations[J]. Procceding of Natural Academy Science of the United States of America,98(24):13757-13762.
Rajam?ki M L,M?ki-Valkama T,M?kinen K,Valkonen J P T. 2004. Infection with potyviruses[M]//Talbot N J. Plant-Pathogen Interactions. Sheffield:Blackwell Publishing.
Samantha E F,Thompson J N,Bohannan B J M. 2004. Adaptation varies through space and time in a coevolving host-parasitoid interaction[J]. Nature,431:841-844.
Smith J M. 1992. Analyzing the mosaic structure of genes[J]. Journal of Molecular Evolution,34:126-129.
Tamura K,Peterson D,Peterson N,Stecher G,Nei M,Kumar S. 2011. MEGA5:Molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance,and maximum parsimony methods[J]. Molecular Biology and Evolution,28(10):2731-2739.
Tsai W S,Abdourhamane I K,Kenyon L. 2010. First report of Pepper veinal mottle virus associated with mosaic and mottle diseases of tomato and pepper in Mali[J]. Plant Disease,94(3):378.
Wei T Y,Yang J G,Liao F R,Liao F L,Gao F L,Lu L M,Zhang X T,Li F,Wu Z J,Lin Q Y,Xie L H,Lin H X. 2009. Genetic diversity and population structure of Rice stripe virus in China[J]. Journal of General Virology,90:1025-1034.
Yin X,Zheng F Q,Tang W,Zhu Q Q,Li X D,Zhang G M,Liu H T,Liu B S. 2013. Genetic structure of Rice black-streaked dwarf virus populations in China[J]. Archivers of Virology,158(12):2505-2515.
Zhang S B,Zhao Z B,Zheng L M,Liu J,Peng J,Yan F,Xie Y,Cheng Z B,Zhou X G,Zhang D Y,Liu Y. 2015. Complete genome analysis of a novel recombinant isolate of Pepper veinal mottle virus from mainland China[J]. Virology Journal,12:191-194.
Zhang S B,Zhao Z B,Zheng L M,Zhang D Y,Liu Y,Liu J,Du J,Peng J,Yan F,Li F,Xie Y,Cheng Z B. 2016. First report of Pepper veinal mottle virus infecting pepper in mainland China[J]. Plant Disease,100(5):1025.
(責(zé)任編輯 麻小燕)

