先天性晚發白內障FVB 小鼠突變基因定位及篩選
龐鉑實,錢 強,徐 園,肖君華,周宇荀,李 凱
(東華大學化學化工與生物工程學院,上海 201600)
白內障是常見的嚴重眼科疾病,導致失明,其致病因素包括遺傳因素和環境因素,約三分之一的白內障患者是由遺傳因素造成[1]。 白內障致病機理復雜,研究者常利用動物模型針對單基因進行遺傳學鑒定。 先天性白內障小鼠模型是廣泛用于白內障功能基因鑒定的模式動物之一,根據突變產生原因主要分為自發突變、誘發突變。 自發突變小鼠通常來源于長時間大規模飼養,誘發突變則主要利用X 射線、ENU 誘變劑等物理或化學手段[2]。Jackson 實驗室的MGI 數據庫(Mouse Genome Informatics)中,共報道478 種具有白內障表型的模式小鼠,其中由于自發突變引起的共計77 種。
2015 年作者單位在飼養FVB 小鼠的過程中,偶然發現由自發突變引起出生后50 d 左右患有白內障的小鼠,且無其他生理生殖異常,經鑒定為先天性晚發型白內障。 晚發型先天性白內障是較為特殊的一種類型,表現為在出生后一年以內發生晶狀體混濁[3]。 進一步建立家系發現,該晚發型白內障以常染色體顯性方式穩定遺傳。
本研究首先鑒定了先天性晚發型白內障FVB小鼠的遺傳方式,其次,利用多重PCR 靶向測序技術設計全基因組SNP 掃描方案,對突變基因進行染色體定位,最后對患病小鼠進行全外顯子測序,篩選候選功能基因。
1 材料和方法
1.1 實驗動物
本研究所用SPF 級FVB/NJ 品系的自發突變白內障小鼠、C3H/He 品系的正常小鼠,由上海斯萊克實驗動物有限公司[SCXK(滬)2017-0005]提供,并飼養于東華大學SPF 級實驗動物設施內[SYXK(滬)2014-0022],飼養室相對濕度為(55±10)%,溫度為(22±2)℃,每天光照12 h。 用于提取DNA并測序的小鼠共100 只,10 周齡,體重25 ~27 g,用于組織切片觀察的小鼠共12 只,5 ~10 周齡,體重16 ~27 g。 本研究經由東華大學倫理委員會批準(批準號:東華倫審[2016]13 號),所有操作均符合動物倫理學要求,并按實驗動物的3R 原則給予人道關懷。
1.2 主要試劑與儀器
儀器:PCR 儀(A-100 型,中國杭州朗基科學儀器有限公司)、PCR 儀(GeneAmpPCR system 9600型,美國ABI 公司)、全自動紫外與可見光分析裝置(FR-200A 型,中國上海復日科技有限公司)、電泳儀(JY600+型,中國北京君意東方電泳設備有限公司)、光學顯微鏡(Nikon Eclipse ci 型,日本Nikon 公司) 等。 試 劑: 動 物 基 因 組DNA 小 量 試 劑 盒(Axygen AxyPrep,美國Axygen 公司)、小鼠全外顯子提取試劑盒(Agilent SureSelectXT Mouse All Exon kit, 美國Agilent 公司)、Taq 酶(中國北京全式金生物技術有限公司)等。
1.3 實驗方法
1.3.1 軟件與數據庫
本研究中用到的軟件及網絡數據庫資源見表1所示。
1.3.2 遺傳方式鑒定與家系構建
白內障FVB 雄鼠與野生型C3H 雌鼠交配,產生F1 代小鼠,F1 代小鼠自交,產生F2 代,記錄發病情況,驗證該白內障表型能否穩定遺傳及其遺傳方式。

表1 主要實驗軟件與網絡資源Table 1 Main experimental software and network resources
1.3.3 顯微鏡鑒定眼球組織切片
自5 周齡起,至10 周齡止,挑選每個周齡段的FVB 白內障小鼠,雌雄個體各一只,解剖取右側眼球。 眼球經過固定、脫水、包埋、制片及HE 染色后,在光學顯微鏡下觀察并描述不同類型的病變部位。同時,選取同年齡段FVB 野生型小鼠為對照。
1.3.4 小鼠基因組DNA 提取
剪取1 ~2 cm 小鼠尾尖組織,放于預冷好的研缽中,用力快速地研磨至勻漿狀;使用20 μL 蛋白酶K 消化鼠尾組織,按照動物基因組DNA 抽提試劑盒說明書提取小鼠基因組DNA。
1.3.5 高通量SNP 分型
通過NCBI 數據庫中查找小鼠基因組上的高多態性SNP 位點共48 個,分布于全部的19 條常染色體上。 挑選100 只患有白內障的F2 代小鼠,針對48 個SNP 位點進行多重PCR 建庫,建庫策略采用錢強等人[4]的研究中所用方法,建庫產物送金唯智生物(蘇州金唯智生物科技有限公司,中國蘇州)進行下一代測序,測序平臺為Illumina X-10,雙末端(Paired-End)測序,上機前產物經過安捷倫2100質控。
1.3.6 全外顯子測序
分別提取2 只白內障FBV 小鼠(樣本編號N7、N8)、1 只野生型FVB 小鼠的基因組DNA(樣本編號N102),及4 只患有白內障的F2 代小鼠的混合基因組DNA(樣本編號N4),采用Agilent SureSelectXT Mouse All Exon kit 進行外顯子捕獲建庫。 4 例建庫產物送由北京諾禾致源公司進行測序,測序平臺為Illumina HiSeq,雙末端測序。
1.3.7 測序數據分析
對于多重PCR 靶向測序數據,使用本實驗室先前建立的SNP 識別流程進行SNP 的篩查[4]。 對于全外顯子測序數據,使用GATK[5]軟件識別BAM 文件中的變異位點(variant)。 篩選測序深度大于10×的SNP 和Indel,隨后利用ANNOVAR 軟件對變異位點進行注釋。
全外顯子數據中突變位點的篩選流程如下:(1)去除小鼠dbSNP142 數據庫中那些常見的突變位點;(2)挑選出編碼區的變異位點;去除那些同義突變的位點;(3)篩選N7 和N8 共有的變異位點且在N102 中不存在這些位點;利用N4 再次驗證(4)的結果;(5)篩選出那些與白內障疾病有關的基因,從而確定候選突變位點。
2 結果
2.1 遺傳方式鑒定結果
患白內障的FVB 雄鼠與野生型C3H 雌鼠交配后,子代全部發生白內障,子代小鼠自交后,其后代中白內障患病率達80%,與顯性遺傳理論值(75%)相接近,且雌雄患病比例接近1 ∶1。 表明該白內障自發突變基因的遺傳方式為常染色體顯性遺傳。
2.2 眼球組織切片鑒定結果
圖1A 中,肉眼可見正常野生型小鼠的眼球眼球呈黑色,無混濁;而患有白內障的小鼠晶狀體呈白色混濁狀。 圖1B 中,對照組的組織切片中,野生型FVB 小鼠的晶狀體上皮下皮質纖維排列緊密,分布整齊,以板層結構呈橢圓形向心排列,上皮細胞形態正常,排列整齊,晶體囊厚度均勻,結構正常,組織未見明顯異常;實驗組中,晶體囊厚度不均勻,上皮細胞明顯腫脹,胞質疏松或呈空泡狀,部分上皮細胞核嗜酸性增強,赤道部附近纖維明顯水腫,纖維間隙增寬,晶狀體皮質結構紊亂,板層結構消失,纖維腫脹,裂解成不規則團塊狀,或呈無形態均質樣,皮質還可見少量淡黃色顆粒物。
2.3 全基因組SNP 掃描結果
100 只F2 代白內障小鼠基因組掃描結果顯示(圖2),11 號染色體上的rs4228772 位點FVB 純合基因型占比最高,達到了82.11%,而其余位點的純合占比均低于35%,(理論值25%),故白內障基因位于11 號染色體上,與rs4228772 連鎖。
2.4 全外顯子測序數據分析結果
全外顯子測序結果顯示,超過99.7%的reads比對到外顯子,約99%的小鼠外顯子區域深度超過10 倍,滿足后續分析的要求(見表2)。
測序樣本N7,N8,N02,N4 的全外顯子測序數據原始變異數據集中,分別包含169457、165703、144476和186438 個編碼區SNP 變異,以及47867、45236、35100 和38998 個Indel 變異,經過篩選后,最后得出28 個SNP 位點以及3 個Indel 突變(見表3):分別有20 個錯義突變(missense)、7 個無義突變(stop-gain)和1 個終止密碼子丟失(stop-loss)的SNP 的突變;1個frameshift deletion、1 個frameshift insertion 和1 個non-frameshift deletion 的Indel 的突變。
圖3 中展示了這些變異位點在染色體上的分布,并結合2.2 中全基因組SNP 掃描的結果,標記了11 號染色體上的3 個候選突變基因(Sfi1,Obscn,Ptrh2)。 根據基因注釋結果,Ptrh2 基因在86689778位置上發生C→T 的無義突變(stop-gain),使得基因在該位置提前產生終止密碼子;Sfi1 基因在3134337位置上發生G→A 的錯義突變(missense);Obscn基因在59054628 位置上發生C →CA 的移碼突變(frameshift insertion)。
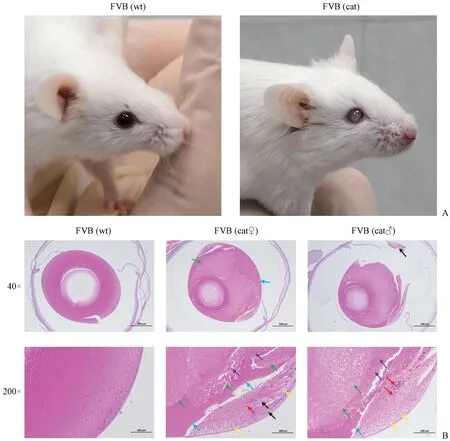
圖1 眼球組織切片鑒定結果Figure 1 Identification results of eyeball tissue sections
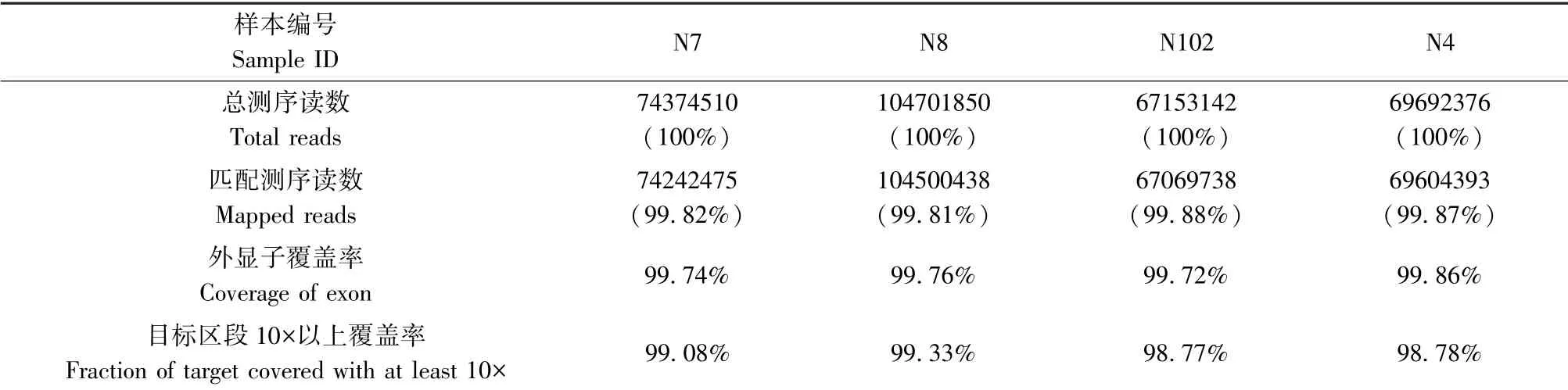
表2 四例樣本數據比對率及其覆蓋率Table 2 Comparison of sample data and coverage rate of four samples
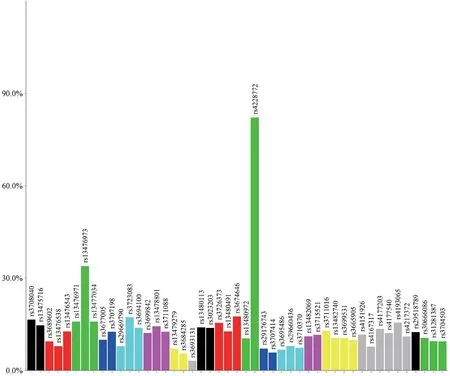
圖2 各染色體上SNP 位點FVB 純合子所占比例Figure 2 Proportion of homozygous FVB at SNP sites on each chromosome

圖3 候選SNP 及Indel 染色體分布圖Figure 3 Distribution of candidate SNPs and indels on each chromosome
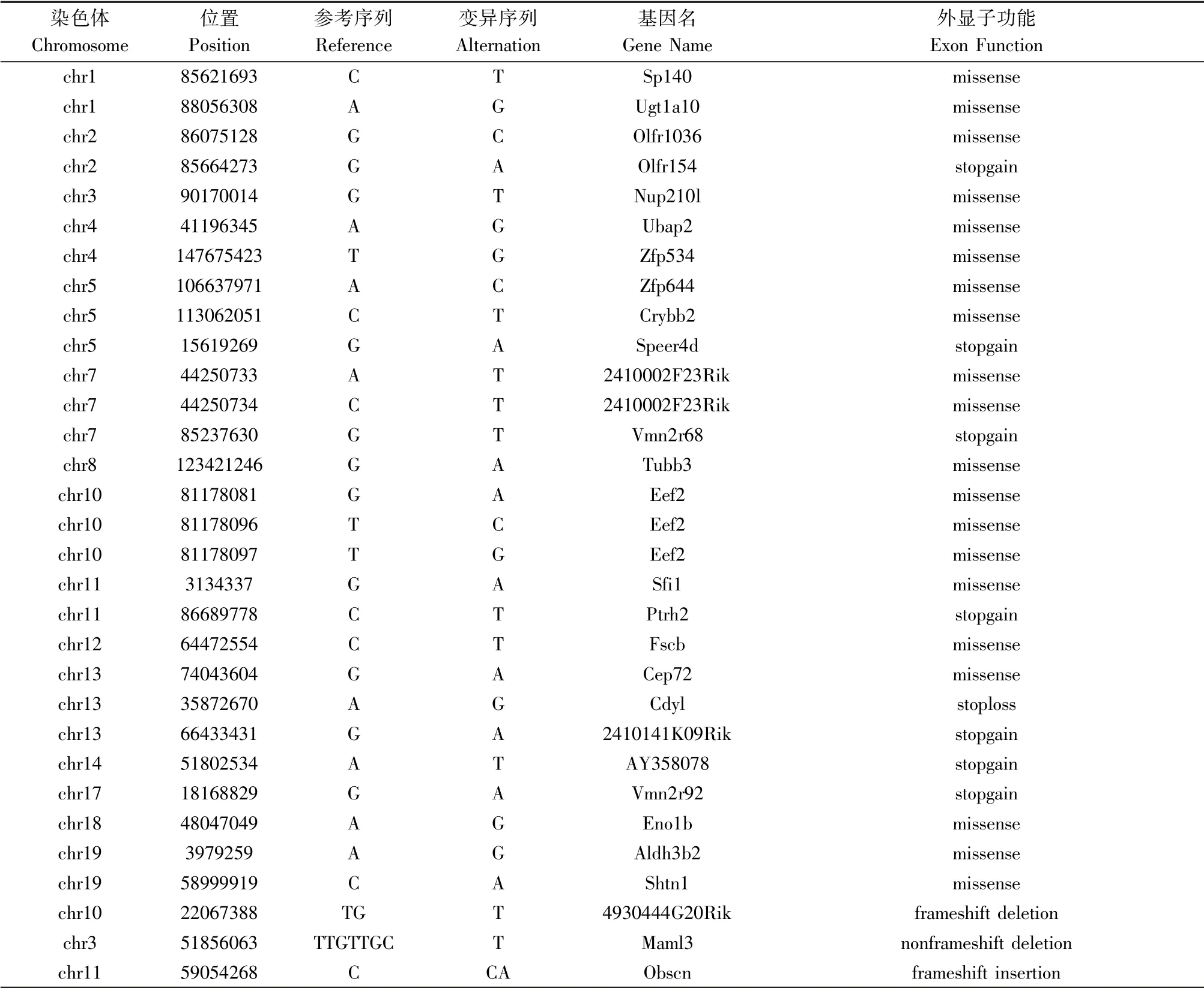
表3 候選的突變SNP 和Indel 位點信息Table 3 Candidate mutation SNPs and indel site information
3 討論
人類白內障發病機制尚不完全清晰,且相關遺傳學研究難以開展,使用突變小鼠模型研究相關基因功能是目前的有效手段之一[6-7]。 本研究針對FVB 小鼠的先天性晚發型白內障表型,利用全基因組SNP 掃描和全外顯子測序,確定了自發突變位于11 號染色體,遺傳方式為常染色體顯性,并篩選出三個強有力的候選突變基因Sfi1,Obscn和Ptrh2。
據報道,目前有數百個基因可直接或間接參與遺傳性白內障的發生,其中約有35 個基因僅導致遺傳性白內障而不造成其它生理疾病[8]。 例如,Bfsp1和Bfsp2 基因在晶狀體特異性表達,當發生結構性突變時,便會直接導致白內障[9-10]。 之前,本課題組通過全基因組掃描和精細定位定位白內障相關基因,最后在Crygc 外顯子3 中發現缺失1-bp 導致的終止密碼子提前,是小鼠遺傳性白內障的發病原因[3]。
根據病因學研究統計,先天性白內障基因中晶體蛋白基因(crystalline genes)約占一半,還有連接蛋白基因(connexin genes)、熱休克蛋白轉錄因子等。 然而,基因突變也僅是造成先天性白內障的因素之一,也有研究發現某些基因啟動子甲基化修飾也會導致晶狀體發育異常[11]。 即使先天性白內障在同一位點發生突變,晶狀體形態、顏色或密度上仍有差異[12]。
人與小鼠的Sfi1,Obscn和Ptrh2 都是蛋白質編碼基因,氨基酸序列一致性分別為64.13%,33.87%和79.01%。Sfi1 編碼中心體蛋白Sfi1,重要功能之一是在紡錘體極體與Cdc31 蛋白相互作用調控細胞周期[13];Obscn編碼的OBSCURIN 蛋白,在心肌和骨骼肌組織中高表達,功能十分繁多,Obscn突變導致的蛋白質表達量下調常常引發肌肉疾病或癌癥[14];Ptrh2 編碼的Ptrh2(Peptidyl-tRNA hydrolase 2),參與調控細胞凋亡信號通路,且在肌肉發育過程中起關鍵作用,Ptrh2 突變小鼠會表現出先天性肌肉萎縮[15]。 三個候選基因中有兩個與肌肉發育相關,提示突變基因很可能引起了眼部肌肉組織的發育異常,從而導致了晶狀體混濁。
全基因組掃描與全外顯子測序對于篩選突變基因各有優勢。 全基因組連鎖分析可將基因定位到性狀連鎖染色體或染色體目標區間,全外顯子可直接提供影響蛋白功能的突變,但前者區間過大、后者測序后往往突變基因較多。 本研究將全基因組SNP 連鎖分析與全外顯子測序技術相結合,在基因組層面篩選出了先天性晚發型白內障新的候選基因,豐富了白內障模型小鼠的遺傳背景研究,可為白內障基因研究提供新思路。

