rsa基因通過mbk-2調控秀麗隱桿線蟲胚胎發育
翟佳佳,張俊娣,左志洪,王 川,張 雷
(1.河北醫科大學第二醫院生殖醫學科,河北 石家莊 050000;2.河北省廊坊市人民醫院婦產科,河北 廊坊 065000;3.河北醫科大學基礎醫學院藥理學教研室,河北 石家莊 050017;4.河北醫科大學基礎醫學院組織胚胎學教研室,河北 石家莊 050017)
基因增強子和抑制子的鑒定和特性(基因相互作用)是發現基因功能與基因和(或)通路間串擾的一種非常有效的方法。基因增強子是一個基因在另一個突基因的背景下,突變基因的功能降低,加入增強子后該背景下的突變基因功能進一步降低,即增強子基因加重了突變基因的功能,增加了突變基因表型的嚴重性。在相同培養條件、溫度下,當對線蟲的基因的增強程度進行評分時,聯合作用產生的致死率必須高于任何一個基因單獨作用產生的致死率。另一方面,基因減弱子是對一個基因功能降低的減少,可以減輕突變基因的殺傷力或表型。在半數致死量的溫度下,加入抑制基因的突變,使致死率降低,該基因即為背景基因的減弱子。秀麗隱桿線蟲結構簡單、生長周期短、基因與人類基因具有高度同源性、易培養,是研究遺傳、基因組和分子網絡的重要模式。小頭激酶2(minibrain kinase 2,mbk-2)是秀麗隱桿線蟲雙特異性絲氨酸/蘇氨酸蛋白激酶(serine/threonine protein kinase,Yak-1)相關激酶家族中的兩種絲氨酸/蘇氨酸激酶之一。mbk-2在早期胚胎發育,特別是在單細胞胚胎的多個微管依賴過程中起重要作用,包括原核遷移、紡錘體定位、微管穩定性和染色體分離[1]。研究mbk-2在早期胚胎發育過程中的特殊功能,可通過增強或抑制mbk-2的突變表型表達,觀察基因間的遺傳相互作用來確定。尋找基因相互作用的有效方法是在攜帶溫度敏感(temperature-sensitive,ts)致死突變的線蟲株背景下進行RNAi篩選[2]。前期在紐約大學Patricia G.Cipriani和Fabio Piano實驗室做了大規模RNAi的高通量檢測篩查線蟲的基因,通過使用這種溫度敏感性突變株,即ts線蟲株,同時減少兩個基因的功能,篩查了超過200 000 000對可能的相關基因。其中篩選出了可調控mbk-2表達的增強子rsa基因(regulator of spindle assembly,紡錘體集合調控)[3]。本研究采用秀麗隱桿線蟲mbk-2突變體觀察rsa基因對mbk-2的調控作用,溫度敏感性mbk-2突變株可以在控制溫度的情況下調節基因的功能從而控制胚胎致死率。在培養溫度敏感性突變線蟲時,寬容溫度即胚胎致死率很少時的溫度,限制溫度即100%致死率時的溫度。實驗將培養溫度調整在15 ℃、20 ℃、22.5 ℃和25 ℃。發現對于mbk-2突變株,在25 ℃時致死率為100%,此即該株的限制溫度,在15 ℃時未孵化的胚胎數很少,即為該株的寬容溫度。在溫度敏感性的mbk-2突變株顯示出mbk-2蛋白作用在第1次有絲分裂,該ts株顯示出mbk-2功能喪失的表現型,當在一個細胞階段將培養溫度上升到限制溫度時表現出100%的胚胎致死率。當將胚胎發育為兩細胞以后再上升溫度至限制溫度,則有50%的胚胎存活。當胚胎發育到靶細胞以后的階段再升高溫度至限制溫度,顯示出100%存活率。
1 材料與方法
1.1線蟲株系與菌株 野生型線蟲N2、mbk-2基因敲除型線蟲株系、大腸埃希菌OP50購自美國秀麗線蟲遺傳中心(Caenorhabditis Genetics Center)。
1.2主要儀器及試劑 氨芐青霉素(上海BBI,A610028);羧芐青霉素(美國Sigma,A6140);L4440質粒(美國Addgene)。體式解剖顯微鏡(廈門Motic);低溫高速離心機(德國eppendorf);激光共聚焦成像系統(德國Leica)。
1.3實驗方法
1.3.1線蟲生長培養 采用線蟲培養基(nematode growth medium,NGM)培養線蟲,稱取NaCl 3 g,瓊脂20 g,蛋白胨2.5 g,溶于975 mL雙蒸水,高壓滅菌。冷卻后,加入1 mol/L CaCl21 mL,5 g/L膽固醇1 mL,1 mol/L MgSO41 mL和1 mol/L KPO4緩沖液25 mL,混勻后導入細菌培養皿中。室溫放置2 d后,鋪上OP 50菌,室溫放置2 d后即可培養線蟲。
1.3.2線蟲同步化 將線蟲分為mbk-2突變組和N2正常組,每組50只,常規培養在NGM培養基上,15 ℃生化培養箱中生長繁殖。用Bleach裂解液沖洗NGM培養基,震蕩,低速離心,吸取上清液,再加入S-basal溶液,震蕩,離心,吸取上清。重復2次后加入S-buffer溶液于15 ℃生化恒溫箱中培養過夜。第2天離心,吸取上清,將剩余部分混勻后,涂抹在NGM培養基上。培養7 d待NGM培養基中的線蟲進入產卵期,將正處于產卵期的線蟲挑到NGM培養基上進行產卵。2~3 h后將線蟲挑走殺死后,將NGM培養基放進15 ℃的生化培養箱中進行培養。第2天觀察存活情況,發育至幼蟲的最后階段L4期后可用來進行相關實驗。
1.3.3RNAi干擾試驗 RNAi細菌在含有50 g/L氨芐青霉素的LB溶液中于37 ℃振蕩過夜。將細菌溶液點在NGM瓊脂平板上(含有100 g/L氨芐青霉素、12.5 g/L四環素和1 mmol/L IPTG),并在室溫下誘導細菌過夜。在20 ℃條件下,將同步化好的N2及mbk-2基因缺陷線蟲分為2組,各150只線蟲,每組3個亞組,每亞組50只線蟲,每組在NGM培養基中培養至L4期,喂食RNAi細菌,分別含有沉默rsa-1和rsa-2基因的質粒(沉默組)和L4440空載質粒(對照組)。
1.3.4孵化率測定 將大約50只線蟲放在裝有300 μL細菌的RNAi平板上進行培養,直到L4期。然后將線蟲轉移到裝有30 μL RNAi細菌的新鮮瓊脂培養平板(每塊平板上有三只蠕蟲),并將其孵育24 h。然后這些線蟲(新的成蟲)被轉移到另一個RNAi平板上,24 h后移除。將平板上的子代培養24 h后,對幼蟲和未孵化的蟲卵數量進行計數。
1.3.5幼蟲發育分析 線蟲從L1階段喂食RNAi細菌,直到線蟲成年產卵前2 d。預先準備約0.4 mm厚的瓊脂墊,并在使用前與M9溶液和蓋玻片一起放入溫控培養箱中孵育2 h。在蓋玻片上滴加的2 μL M9緩沖液,并在其中解剖8~10只成蟲,用熔化的凡士林封片,顯微鏡下觀察并拍照記錄。
1.4統計學方法 應用SPSS 19.0軟件處理數據。計量資料采用單因素方差分析和SNK-q檢驗,計數資料比較采用Fisher確切概率法。P<0.05為差異有統計學意義。
2 結 果
2.1rsa基因沉默對N2線蟲以及mbk-2突變線蟲孵化的影響 采用含rsa-1和rsa-2的RNAi細菌喂養線蟲,觀察抑制rsa對線蟲孵化率的影響,對照組采用含L4440質粒的細菌喂養。結果顯示,抑制rsa-1和rsa-2表達后,蟲卵未孵化率高于對照組(P<0.05)。同時,RNAi篩選結果顯示,rsa-1和rsa-2可能是mbk-2的增強子,調控其表達。為驗證其調控作用,采用rsa-1和rsa-2的RNAi細菌喂養mbk-2突變型線蟲。結果顯示,與N2組相比,mbk-2突變會增加蟲卵的未孵化率。而采用RNAi抑制rsa-1和rsa-2后,mbk-2突變線蟲的蟲卵未孵化率顯著增加,顯著高于mbk-2突變組,見表1。從培養皿的拍攝圖片也可以直觀的看出,使用L4440的對照組,幼蟲的數量多,孵化率很高。rsa-1和rsa-2喂養的mbk-2突變線蟲,卵子數量明顯增多,幼蟲數量減少(圖1~2)。
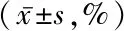
表1 線蟲蟲卵孵化率統計表Table 1 Statistics of hatchability

圖1 N2線蟲蟲卵孵化檢測
2.2rsa-2基因沉默對mbk-2突變線蟲胚胎發育的影響 為研究rsa-2對mbk-2的調控作用,采用rsa-2 RNAi細菌喂養mbk-2突變線蟲。對胚胎發育表型的研究顯示,在單細胞階段,原核遷移出現缺陷,表現為父原核向中心遷移,并從胚胎后部進一步與母原核相遇,并在相遇位置形成紡錘體。并且紡錘體與A-P軸方向不同,可見于電鏡拍攝圖(圖3)。這些缺陷在rsa-2 RNAi干預的mbk-2突變型線蟲表現的最明顯,但在野生型N2線蟲,使用rsa-2 RNAi單因素處理線蟲及L4440喂養的mbk-2突變型線蟲中表現不明顯。這種表型類似微管不穩定性,見表2。
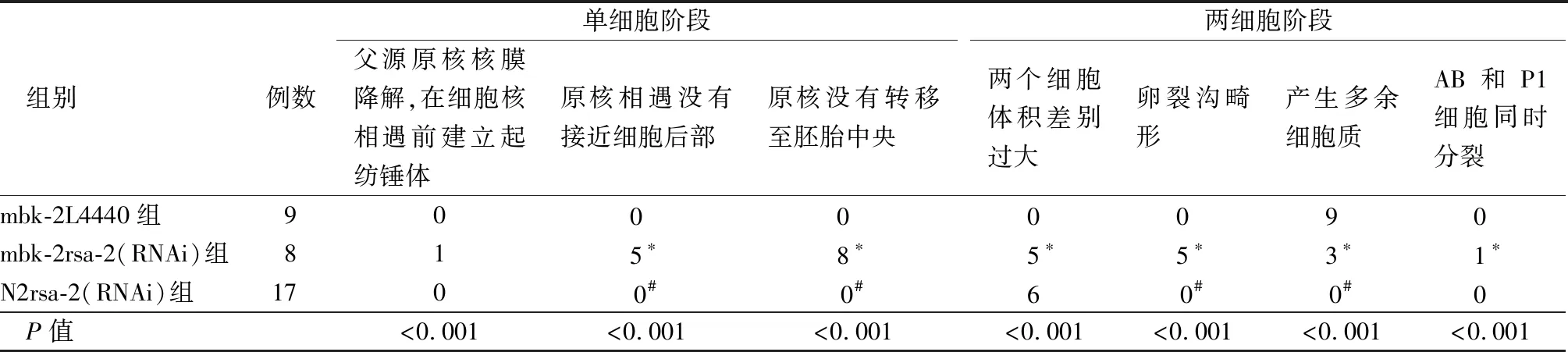
表2 線蟲胚胎發育表型檢測Table 2 Detection of embryonic development phenotype of nematode (例數)
在兩細胞階段,觀察到rsa-2 RNAi喂養的mbk-2突變型線蟲胚胎表現為AB和P1細胞顯著的不對稱,也表現為細胞卵裂溝異常,可見于電鏡拍攝圖(圖4)。這種缺陷與rsa-2 RNAi處理的對照N2線蟲相似,這表明胚胎表型的異常可能僅由rsa-2的缺失引起。
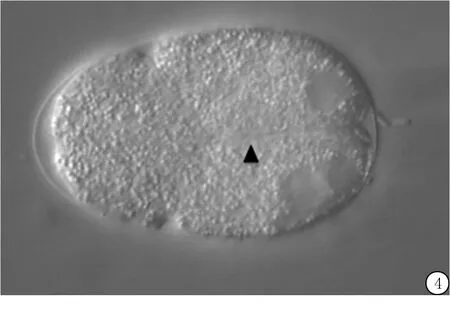
圖4 兩細胞階段發育異常情況
3 討 論
mbk-2在秀麗隱桿線蟲早期胚胎發育中的兩個主要作用是微管依賴過程的調節和后決定因子的不對稱分布。mbk-2影響紡錘體方向和位置、原核遷移、微管穩定性和染色體分離[4]。這些表型是微管分離蛋白Katanin的同源蛋白減數分裂紡錘體形成蛋白(meiotic spindle formation protein,MEI-1)控制產生。mbk-2和分裂后期促進復合物(anaphase promotingcomplex,APC)通過直接磷酸化下調減數分裂后的MEI-1,使MEI-1失活,以便穩定地組裝更大的有絲分裂紡錘體[5]。
mbk-2也是P顆粒不對稱分布所必需的,也是磷酸化和靶向降解鋅金屬鈦酶(OMA1 zinc metallopeptidase, OMA1)、咽腸過剩蛋白1(pharynx and intestine in excess protein 1,PIE-1)和后置分離蛋白1(posterior segregation-1,POS-1)等蛋白母體蛋白所必需的[6]。鋅指蛋白OMA-1調節卵母細胞向胚胎轉變。在第一次細胞分裂期間,需要降解OMA-1以啟動細胞命運決定因子的蛋白水解。mbk-2通過磷酸化調節OMA-1的降解。mbk-2還通過MEX-5/6調節PIE-1和POS-1的不對稱分布[7]。
mbk-2的定位是高度變動的。mbk-2定位于卵母細胞和新受精的受精卵的細胞皮質,并在減數分裂后期迅速轉移到皮質點。EGG-3是一種卵子激活所需的卵母細胞蛋白[8],與mbk-2形成復合物,并在減數分裂前保持其在皮質處于非活性狀態。在減數分裂期間,EGG-3被內化和降解,從皮層釋放出mbk-2[9]。在有絲分裂期間,mbk-2主要發現于中心體和染色體上。使用溫度敏感的mbk-2突變體進行胚胎升溫實驗已經證明,mbk-2活性在第1次有絲分裂期間是必需的[10]。當溫度在單細胞階段上升到非許可溫度時,胚胎表現出mbk-2功能喪失表型和100%胚胎致死率。然而溫度升高時,如果在雙細胞階段,有50%胚胎存活,如果在八細胞階段之后,則有100%胚胎存活率。本研究結果顯示,當溫度升高時,mbk-2突變體線蟲胚胎發育出現顯著異常。在單細胞階段,95%受精卵無原核遷移,在雙細胞階段,95%細胞出現卵裂溝缺陷。
蛋白磷酸化酶2A(protein phosphatase 2A,PP2A)是一個廣泛參與細胞有絲分裂的酶[11],其功能包括調控進入有絲分裂周期,復制中心粒,染色體向中板集合,著絲粒和微管的相互作用,紡錘體集中的管卡,控制有絲分裂的出口[12-13],PP2A酶有一個異源三聚體的結構,rsa-1和rsa-2蛋白形成一種復合物(RSA復合物),這種復合物是微管從中心體和紡錘體組件中生長出來所必需的。中心體蛋白SPD-5與rsa-2結合,并將RSA復合物募集到中心體中[14]。RSA復合物在有絲分裂紡錘體形成中特異性地起作用,并且通過紡錘體裝配調節劑微管解聚驅動蛋白KLP-7的下調來調節從中心體發出的微管的數量。RSA復合物還通過將微管不穩定蛋白TPXL-1募集到中心體來調節有絲分裂紡錘體裝配[15]。
秀麗隱桿線蟲使用Wnt/β連環蛋白信號通路完成不均質的細胞分裂(asymmetric cell division,ACD),因此子代細胞分化自Wnt極化的母代細胞,并且展示出Wnt信號[10],這條信號通路在線蟲發育過程中控制了連續的前后向的ACD細胞,指導了反復的二進制細胞凋亡過程。這條通路的核心組成部分是SYS-1,它是β連環蛋白的同源物,也是TCF鏈接的位置,且作用于激活Wnt目標基因[16]。在ACD細胞后,SYS-1不均等的集中到帶有Wnt信號的子代細胞核,從而激活Wnt目標基因的轉錄。Wnt目標基因的表達激活了細胞分化程序,區別于非Wnt信號的子代細胞[17]。近期有關于SYS-1(SYmmetrical Sister cell hermaphrodite gonad defect)不均等的姐妹細胞雌雄同體性腺缺陷和rsa-2的相關研究表面,線蟲的中心體細胞相關的SYS-1/β連環蛋白的降解限制了其在不均等細胞分化后在子代細胞中的表達。SYS-1和中心體蛋白rsa-2相互作用,并且在胚胎細胞有絲分裂過程中,rsa-2使SYS-1移動到細胞的中心體。在ACD過程后,rsa-2使SYS-1從中心體分解,并且促進依靠Wnt的細胞凋亡。rsa-2促進SYS-1在中心體上聚集,但是限制SYS-1在分化后保留在子代細胞[18]。
本研究結果顯示,利用RNAi細菌抑制mbk-2突變體線蟲中的rsa-1 和rsa-2后,蟲卵致死率顯著高于L4440喂養的mbk-2突變體線蟲。并且rsa-2 RNAi處理組也顯著高于rsa-1 RNAi處理組,提示mbk-2更多受rsa-2的調節作用影響。
rsa-1可以使PP2A全化酶置于細胞中心體,并且在有絲分裂的紡錘體的聚集起到關鍵作用。當去掉rsa-1功能的時候會出現兩個主要的表現,中心微管減少和紡錘體倒塌,因此細胞中心體在紡錘體匯合的時候移向染色質[19]。
對于mbk-2和rsa-2的相互作用,微分干涉差顯微鏡結果顯示,在單細胞階段顯示明顯缺陷,如原核遷移缺陷,這類似于mbk-2因微管不穩定而喪失功能。這些表型表明,在微管形成過程中,mbk-2可能需要rsa-2的調節。mbk-2在減數分裂后保持著MEI-1的活性。MEI-1的激活擾亂了有絲分裂紡錘體的穩定性。rsa-1和rsa-2復合物通過減少紡錘體組件調節器KLP-7在有絲分裂紡錘體形成和微管數量控制中起作用。rsa復合物還可以通過募集微管去穩定蛋白TPXL-1來調節紡錘體組裝[15]。在兩細胞階段,相互作用的胚胎產生了夸大的AB和P1細胞不對稱,這也出現在N2和rsa-2RNAi對照中。那么這種表型可能僅僅來自rsa-2 RNAi的抑制作用。兩細胞期也出現了胞質體,這與15 ℃時的mbk-2突變體相同。這意味著胞質體是僅由降低mbk-2功能產生的。

