初中化學“溶解度”教學的改進
殷志忠 田長明

摘要:從科學歸納影響固體溶解度因素和溶解度曲線類型、合理選擇溶解度曲線相關習題和實驗、運用溶解度的相關知識解決實際問題等三方面入手,結合例題闡釋在初中化學就“溶解度”相關知識教學時,歸納總結時要注意科學性與規范化,習題與實驗的選擇要體現真實性與情境化,實際運用時要關注準確性與多元化。
關鍵詞:溶解度; 硫酸亞鐵; 氫氧化鈣; 教學改進
文章編號:1005-6629(2020)09-0094-04
中圖分類號:G633.8
文獻標識碼:B
“溶解度”是九年級化學中一個重要的知識點,也是各地中考化學考查的熱點內容之一。因此在平時的課堂教學中,初中化學教師花了很多心思和精力來提高課堂教學的效果,但在追求教學成績的同時,我們不能忘記學科本身的科學性以及化學知識的實用性。如何進一步提升初中化學課堂的教學品質,試從以下三方面進行闡釋。
1?學會科學歸納
知識的歸納小結是課堂教學中一種重要的教學方法,它是從許多個別的具體事物中概括出一般性概念、原則或結論的思維方法,歸納的目的一方面能挖掘該知識點的本質,另一方面也便于學生理解、記憶和運用。但發現有些教師歸納知識點時有時顯得不嚴謹、不科學。
案例1?影響固體溶解度的因素
滬教版九年級化學教材中對溶解度的定義有如下描述:“固體物質的溶解度是指在一定溫度下,該物質在100g溶劑(通常溶劑為水)中達到飽和狀態時所溶解的質量”[1]。根據這個定義,很多教師對影響固體溶解度大小的因素一般都會做如下歸納:
溶質和溶劑本身的性質是內因;溫度為外因。
影響固體物質溶解度的外部因素難道只有溫度嗎?溶液中如果含有兩種或兩種以上的溶質,溶質之間對彼此的溶解度是否有影響?我們知道在兩種含有相同離子的鹽溶于水時,它們的溶解度一般都會降低,這種現象叫做同離子效應。如在相同的溫度下,氯化鈉在氯化鉀溶液中的溶解度比在水中的溶解度要小,同樣氯化鉀在氯化鈉溶液中的溶解度要比在水中的溶解度小。因此筆者建議在“溫度”后面應加“等”。
案例2?溶解度曲線的類型
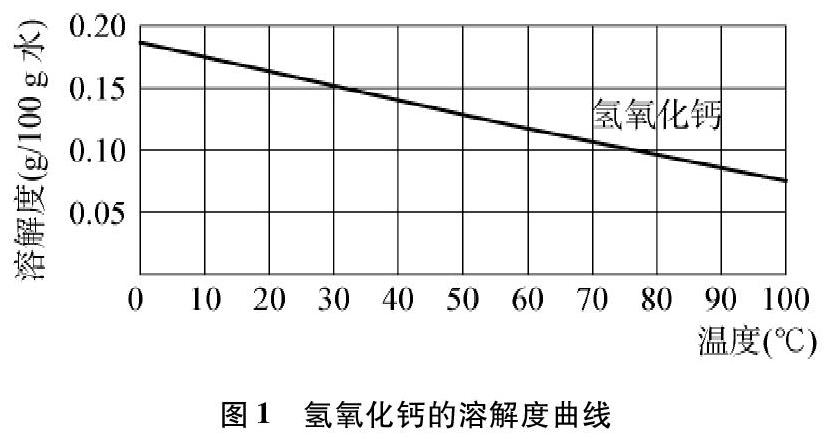
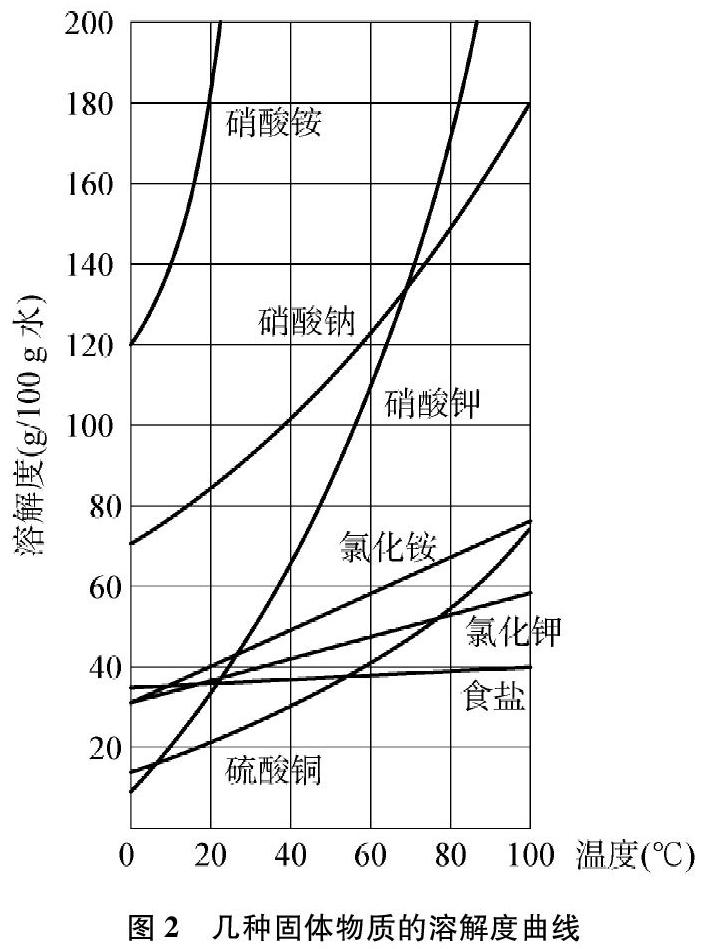
滬教版九年級化學下冊第20頁有兩張溶解度曲線圖(見圖1和圖2)[2],
于是有教師在教學中對溶解度曲線進行如下歸納:
溶解度曲線有下列有三種類型:
(1) 大多數固體物質的溶解度曲線左低右高,溶解度隨溫度升高而增大。如硝酸鉀等。
(2) 少數固體物質的溶解度曲線較平緩,溶解度受溫度的影響很小。如氯化鈉等。
(3) 極少數固體物質的溶解度曲線是左高右低,
溶解度隨溫度的升高而降低,如氫氧化鈣(圖1)等。
溶解度曲線只有上面這三種類型嗎?答案肯定是否定的,因為不是所有物質的溶解度都是單調上升或單調下降的。有些固體的物質的溶解度先是隨著溫度的升高而增大,當達到一定溫度后,溶解度又隨著溫度的升高而減小,如硫酸亞鐵、硫酸鈉等。筆者以硫酸亞鐵為例:
硫酸亞鐵在不同溫度下的溶解度不同,析出晶體的組成也有所不同。表1是硫酸亞鐵的溶解度數據(根據《蘭氏化學手冊》換算)。
造成這一現象的原因是FeSO4·7H2O晶體熱穩定性差,受熱后配體水分子容易失去。FeSO4·7H2O熱分解失去結晶水過程大致可分為3個階段,在23~78℃時FeSO4·7H2O逐漸失去3個配體水,生成FeSO4·4H2O,然后在78~159℃時再陸續失去3個配體水,生成FeSO4·H2O,在373℃時可完全脫水[3]。上述過程可簡單表示為:
因此建議將“溶解度曲線有下列有三種類型”改為“溶解度曲線一般有下列三種類型”更貼切。
2?學會合理選擇
經常會聽到這樣一句話,“不讓學生跳入題海,教師必須跳入題海”。這句話隱含的意義就是教師跳入題海對試題進行甄別和選擇,選擇科學的、合適的試題用于課堂教學。其實在教學過程中不僅試題需要選擇,很多東西都需要選擇,如教學的手段、實驗的方法等。
2.1?合理選擇習題
習題是用來鞏固學生所學的知識,訓練學生思維與方法的重要載體,因此,利用真實的化學情境,設置情境化的化學問題,幫助學生提高解決化學實際問題的能力,引導學生做真題、真做題,既避免片面追求“偏”“怪”“難”的假題,來機械訓練學生刷題,也防止題目中混入一些不科學的信息誤導學生,這也是化學學科價值與育人價值的體現。
溶解度曲線是各地化學中考必考的一個重要知識點,因此在平時的教學中針對這方面的訓練也是必不可少的,但在編制試題的過程中,命題者往往會用“A”“B”“C”或“甲”“乙”“丙”來表示某種物質,如下列這道題:
案例3?甲乙兩種物質的溶解度曲線如圖3所示,
下列說法中正確的是
A.?30℃時,50g水可以溶解25g甲物質
B.?升溫能使甲物質的不飽和溶液變為飽和溶液
C.?20℃時,甲、乙兩種物質的溶解度相同
D.?30℃時,乙物質的溶解度比甲物質的溶解度大
有專家提出這樣的疑問,在溶解度曲線中用“A”“B”“C”或“甲”“乙”“丙”來表示固體物質,這樣的固體物質是否存在?
例如:溶解度隨著溫度的升高而降低的物質,中國各種版本的初中教材中常見的物質就是氫氧化鈣,筆者翻閱了美國高中主流理科教材《科學發現者(中冊)》關于固體物質的溶解度曲線[4],教材提供了圖4,其中溶解度隨著溫度的升高而降低的物質是Ce2(SO4)3。無論是Ca(OH)2,還是Ce2(SO4)3,其溶解度曲線都不符合試題中的“乙”物質。筆者查閱了《蘭氏化學手冊》關于固體物質溶解度的相關數據,其中二水合乙酸鈣和硫酸鋰的溶解度也是隨著溫度的升高而降低的[5]。
通過比對數據發現二水合乙酸鈣和硫酸鋰也不符合試題中的“乙”物質。
可喜的是,這樣的問題已經引起各地中考命題專家的重視,在命制試題時溶解度曲線中的每一條曲線都代表著一種具體的物質,只是我們大多數一線教師在教學過程中并沒有意識到這個問題,在平時的教學中用“A”“B”“C”或“甲”“乙”“丙”來表示某物質的溶解度曲線的習題還是屢見不鮮。選擇溶解度曲線的相關習題,可以具體以某些物質的溶解度曲線為例,圍繞溶解度、飽和溶液與溶液的溶質質量分數設置相關問題,如:在不同溫度下,物質溶解性的變化情況;相同溫度下,不同物質的溶解性的定量比較;依據溶解度曲線,判定某溫度下一定量溶劑中溶解一定量的溶質時所得溶液是否飽和,以及所得溶液的溶質質量分數等等。這樣既加深學生對所學概念的理解,又對溶解度曲線的應用有初步認識。
2.2?合理選擇實驗
實驗是化學的最高法庭,它是證明化學結論的最好手段。通過化學實驗引導學生進行科學探究,既是化學學習的方法,也是化學學習的重要內容,同時基于實驗的實證研究是培養學生化學核心素養的重要體現。要通過實驗引發學生思考,培養他們的發散思維與逆向思維。為了驗證氫氧化鈣的溶解度隨著溫度的升高而降低,在教學過程中有些教師會做下列實驗:
在試管中加入約占試管容積三分之一的飽和石灰水,用酒精燈對著溶液部分加熱,實驗裝置如圖5,觀察實驗現象。
加熱一段時間后發現試管中溶液會出現渾濁,故上課教師認為產生渾濁的原因是有氫氧化鈣析出。筆者認為這樣的實驗設計是不嚴謹的,因為氫氧化鈣也會和空氣中的二氧化碳反應生成碳酸鈣沉淀,為了增強說服力,應該在澄清石灰水上方加一層植物油液封,隔絕空氣。本研究選擇的實驗如圖6,加熱液封后的澄清石灰水,如果出現渾濁,應該是氫氧化鈣由于溫度升高溶解度降低而析出。
同樣,為證明石蠟的成分中含有碳元素,多數教師會利用燃燒的方法,并用一只內壁上浸有澄清石灰水的燒杯罩在火焰的上方,來證明石蠟燃燒的產物中是否有二氧化碳氣體,從而推測石蠟中的成分是否含有碳元素。這里就有一個問題,燒杯內壁上的澄清石灰水變渾濁就一定能證明產生二氧化碳嗎?其實有兩種可能:一種是由于石灰水與二氧化碳反應產生碳酸鈣;另一種是澄清石灰水受熱氫氧化鈣溶解度降低,導致析出;當然,還有可能是由于溶液中水分受熱蒸發,也會使其中溶質析出。筆者在做同樣的實驗時,是將一只集氣瓶或廣口瓶罩在火焰的上方收集生成的氣體,后將澄清石灰水倒入瓶內振蕩,觀察是否變渾濁。所以在選擇化學實驗時,應充分考慮實驗的真實性和合理性,做到簡潔明了、科學合理。
3?學會實際應用
溶解度是定量表示物質溶解性強弱的化學概念,其內涵非常豐富,必須要通過一些實際應用,來加深學生對這一概念的理解。對于溶解度的應用,可以從以下幾方面思考:一是利用溶解度進行相關的定量計算,如農業上常用飽和食鹽水來選種,可設置常溫下配制一定質量的飽和食鹽水需要的水和食鹽的質量等;二是利用不同物質其溶解度隨溫度變化幅度不同對其混合物進行分離提純,如氯化鈉中混有少量的硝酸鉀如何提純、硝酸鉀中混有少量的氯化鈉如何提純、“夏天曬鹽、冬天撈堿”的原理是什么;三是從理解溶解度本身的概念內涵去應用,如海水曬鹽得到的海鹽中會含有一定量的氯化鎂和氯化鈣,實驗室中為了達到提純的目的,可以用飽和氯化鈉溶液反復沖洗海鹽固體,該飽和氯化鈉溶液是否可以無限使用?為什么?試說明其中的原理等等。當然,還可以更多地從定量的角度去利用溶解度解釋下列問題。
問題1?氫氧化鈉暴露于空氣中,表面會形成溶液,這是為什么?
氫氧化鈉易潮解,初中化學教師都知道,但為什么易潮解,氫氧化鉀能不能潮解呢?很多教師知之甚少,其實氫氧化鈉易潮解也與溶解度有關,表3是20℃時含鈉或鉀的部分化合物在水中的溶解度。
從表中不難發現,氫氧化鈉、氫氧化鉀和碳酸鉀的溶解度很大。筆者查閱了相關資料,發現氫氧化鉀和碳酸鉀都易吸濕潮解。為什么常溫時溶解度大就易潮解呢?一般情況下,固體物質溶解度大,易溶于空氣中的水分而潮解。
問題2?20℃時,在飽和食鹽水中通入足量氨氣和二氧化碳,為什么會有碳酸氫鈉晶體析出?
這是侯氏制堿的方法,要解決這一問題,必須利用溶解度的相關知識。已知20℃時,NaCl的溶解度為36g/100g水,NaHCO3的溶解度為9.7g/100g水。不妨假設20℃時氯化鈉飽和溶液為136g,則:
通過計算不難發現,136g氯化鈉飽和溶液中通入足量氨氣和二氧化碳,溶劑的質量會減少11.1g,此時最多能溶解碳酸氫鈉8.6g,而生成碳酸氫鈉的質量為51.7g,遠大于8.6g,因此碳酸氫鈉晶體會析出。當然,在混合鹽溶液中,影響析出晶體的因素比較復雜,在此不再贅述。
九年級化學“溶解度”的教學既是重點,也是難點,化學教師應切實改進教學方法,學會歸納相應的知識點,注重科學性與規范化;學會選擇相關的習題與化學實驗,體現真實性與情境化;學會實際運用所學化學知識,關注準確性與多元化。教師要以培養學生的學科核心素養為己任,不斷提高學生解決實際化學問題的能力。
參考文獻:
[1][2]中學化學國家課程標準研制組. 義務教育教科書·化學(九年級下冊)[M]. 上海:上海教育出版社, 2015:18, 20.
[3]陸海燕. 淺析七水硫酸亞鐵溶解度引出的困惑[J]. 化學教學, 2011, (5):76.
[4][美]菲利普(Phillips J. S.)等著, 王祖浩等譯. 美國高中主流理科教材·化學概念與應用[M]. 杭州:浙江教育出版社, 2008:479.
[5]James G. Speight, ph. D. Lange's Handbook of Chemistry [M]. New York:McgrawHill Sixteenth Edition, 1956.

