龍須菜多糖對D-半乳糖及氯化鋁致大鼠學(xué)習(xí)記憶障礙的影響
陳 茜,李嘉慈,呂應(yīng)年,吳科鋒,葉 華,李 立,*
(1.廣東醫(yī)科大學(xué)第一臨床醫(yī)學(xué)院,廣東湛江 524523;2.韶關(guān)醫(yī)學(xué)院,廣東韶關(guān) 512026;3.廣東醫(yī)科大學(xué)廣東天然藥物研究與開發(fā)重點實驗室,廣東湛江 524523;4.廣東醫(yī)科大學(xué)海洋醫(yī)藥研究院,廣東湛江 524523)
多糖是一類結(jié)構(gòu)復(fù)雜的生物大分子,在微生物、植物、動物等生物體內(nèi)廣泛分布,并參與眾多重要生命活動過程[1]。海藻是生長在海洋中的低等隱花植物[2],其多糖是從海藻中提取出的多組分混合物,由多個相同或不同的單糖基通過糖苷鍵相連而成的高分子碳水化合物。海藻多糖因其凝膠性、穩(wěn)定性、成膜性等多種特性,以及抗氧化、免疫調(diào)節(jié)、抗腫瘤、抗病毒、抗凝血等多種生物活性,目前已成為化妝品、食品及保健醫(yī)藥等領(lǐng)域的研究熱點[3]。龍須菜(Gracilarialemaneiformis),又名海發(fā)菜,系紅藻門、杉藻目、江蘺科、江蘺屬的一種紅藻,為傳統(tǒng)藥食兩用海藻類植物,是繼紫菜、海帶、裙帶菜之后的中國第四大栽培海藻,其多糖含量高達(dá)30%左右[4]。研究顯示,龍須菜多糖(Gracilarialemaneiformispolysaccharides,GPs)具有抗氧化、抗病毒、修復(fù)受損腎上皮細(xì)胞、降低糖尿病小鼠血糖以及提高線蟲壽命等多種生物活性[5-9]。
阿爾茨海默病(Alzheimer’s disease,AD)是導(dǎo)致記憶損害及認(rèn)知缺陷的毀滅性神經(jīng)退行性疾病。在全世界,AD患者已達(dá)3560萬人,預(yù)期到2050年將達(dá)到1億1500萬人[10]。AD為最常見的老年人死亡原因,雖然已有眾多治療分子被設(shè)計用來克服該疾病所引起的社會、經(jīng)濟及醫(yī)療負(fù)擔(dān),但遺憾的是,人們發(fā)現(xiàn)幾乎所有的化學(xué)物質(zhì)在臨床實踐中均僅限于姑息治療[11]。AD的病理特征為β-淀粉樣蛋白(Aamyloidβ,Aβ)斑塊及神經(jīng)纖維纏結(jié),而氧化應(yīng)激(Oxidative stress)則參與AD的發(fā)生、發(fā)展全過程。研究表明,Aβ誘導(dǎo)氧化應(yīng)激,促進(jìn)活性氧(Reactive oxygen species,ROS)生成,進(jìn)而導(dǎo)致脂質(zhì)過氧化、蛋白氧化、tau蛋白過磷酸化,最終對突觸和神經(jīng)元產(chǎn)生毒性作用;反過來,氧化應(yīng)激也會提高Aβ生成。鑒于此,采用抗氧化劑治療AD可能不失為一個可行策略[12]。已知最著名的抗氧化劑為維生素C及維生素E。一些研究顯示補充抗氧化劑,包括維生素C及E,或富含這些營養(yǎng)素的飲食可防止氧化應(yīng)激,從而降低AD風(fēng)險。研究還表明,攝入維生素C具有神經(jīng)保護(hù)作用,可改善AD患者的認(rèn)知[13]。
研究發(fā)現(xiàn)包括海藻多糖在內(nèi)的一些多糖具有神經(jīng)保護(hù)作用,如羊棲菜多糖可顯著改善AD模型動物的認(rèn)知功能[14],褐藻多糖則通過減少AD線蟲的Aβ積聚并降低Aβ誘導(dǎo)的ROS生成,從而緩解AD表型的進(jìn)程[15]。鑒于此,作者檢測了GPs對AD模型大鼠的影響,并探討了可能機制。
1 材料與方法
1.1 材料與儀器
龍須菜多糖 由本實驗室提供,純度≥95%,通過醇提法制備[16];半乳糖(D-galactose,D-gal)、氯化鋁(aluminumchloride,AlCl3) 分析純,上海國藥集團化學(xué)試劑有限公司;超氧化物歧化酶(SOD)測試盒、谷胱甘肽過氧化物酶(GSH-PX)測試盒、微量丙二醛(MDA)測試盒 南京建成生物工程研究所;SPF級雌性SD大鼠28只,7周齡,體重(200±20) g,動物及飼料 均購自廣東醫(yī)科大學(xué)實驗動物中心,實驗動物生產(chǎn)許可證號:SCXK(粵)2013-0008,廣東醫(yī)科大學(xué)實驗動物中心實驗動物使用許可證號:SYXK(粵)2015-0147。
OLYMPUS DP73顯微鏡 日本OLYMPUS公司;ELx800酶標(biāo)儀 美國BIO-TEK公司;Morris水迷宮系統(tǒng) 淮北正華生物儀器設(shè)備有限公司。
1.2 實驗方法
1.2.1 模型建立及給藥 大鼠室溫飼養(yǎng),自由進(jìn)食及飲水,自然晝夜節(jié)律光照。適應(yīng)性飼養(yǎng)7 d后,根據(jù)先前文獻(xiàn)報道方法,注射D-gal及AlCl3建立AD大鼠模型[17]。大鼠隨機分為對照組(n=7)及AD組(n=21)。對照組每日腹腔注射生理鹽水(0.2 mL/只),AD組每日腹腔注射D-gal(60 mg/kg)及AlCl3(10 mg/kg)。AD組進(jìn)一步分為3組(n=7),即AD模型組、GPs低劑量組、GPs高劑量組。對照組及模型組每日以生理鹽水灌胃,GPs低劑量組及高劑量組則每日以GPs灌胃(300及600 mg/kg)。給藥與造模同步,均持續(xù)42 d,具體流程及后續(xù)實驗如圖1所示。

圖1 處理及行為測試時線
1.2.2 Morris水迷宮實驗 Morris水迷宮(Morris water maze,MWM)實驗方法參考先前文獻(xiàn)[18]報道。MWM實驗裝置為一圓形水箱(直徑120 cm、高80 cm)。水箱內(nèi)裝有溫水(23±1 ℃),深40 cm,并以白色無毒染料使其不透明。水箱被分為四個象限(NE、SE、SW和NW),一個不可見的平臺(直徑12 cm)固定在SW-III象限(目標(biāo)象限),并淹沒在水面下2 cm處。以懸于游池上方的攝像機記錄動物行為,并采用視頻計算跟蹤系統(tǒng)(中國醫(yī)學(xué)科學(xué)院醫(yī)學(xué)研究所)進(jìn)行分析。在給藥第44 d,訓(xùn)練大鼠在各種環(huán)境的提示下尋找并爬上水下平臺。在獲得性訓(xùn)練(acquisition trial)階段(給藥第45~48 d),大鼠每日接受4次測試,四個起始位置(NE-Ⅰ、NW-Ⅱ、SW-Ⅲ、SE-Ⅳ)各使用一次,而平臺始終位于同一象限(SW-Ⅲ)。大鼠頭朝池壁放入水中,并給予60 s尋找隱藏平臺,到達(dá)平臺的時間被記錄為逃避潛伏期(escape latency)。如果超過60 s仍找不到平臺,則引導(dǎo)大鼠到平臺之上,并停留10 s。在給藥第49 d進(jìn)行空間探索實驗(spatial exploration test),移除平臺,將大鼠置于非平臺所在象限,并記錄其60 s內(nèi)穿越原平臺位置的次數(shù)。
1.2.3 標(biāo)本采集 MWM實驗結(jié)束24 h后,采用戊巴比妥(30 mg/kg)麻醉大鼠。取出除小腦外的全腦,生理鹽水沖洗。取大鼠左半球腦組織以10%福爾馬林浸泡固定、石蠟包埋,用于病理學(xué)檢查;取大鼠大腦右半球的海馬組織,-80 ℃保存,用于氧化應(yīng)激標(biāo)志物檢測。
1.2.4 蘇木精伊紅染色 石蠟包埋標(biāo)本4 μm厚連續(xù)切片,脫蠟,再以蘇木精伊紅(H&E)染色。
1.2.5 大腦海馬組織氧化應(yīng)激分析 采用市售商品化試劑盒,并按照試劑盒所附說明書測定大鼠海馬組織SOD、GSH-Px活性及MDA水平。
1.3 數(shù)據(jù)處理
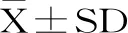
2 結(jié)果與分析
2.1 GPs干預(yù)對大鼠MWM實驗結(jié)果的影響
在正常濃度下,D-gal被代謝為半乳糖-1-磷酸;在高濃度下,D-gal則被轉(zhuǎn)化為半乳糖醇,半乳糖醇在細(xì)胞中積累,然后破壞滲透應(yīng)激平衡并產(chǎn)生ROS[19]。在動物模型中長期注射D-gal可致氧化應(yīng)激、神經(jīng)元損傷以及認(rèn)知能力衰退[20]。另一方面,在正常生理條件下,鋁(Al)可在大腦不同區(qū)域的神經(jīng)元中積聚,引起神經(jīng)元凋亡性丟失,長期暴露于Al可引起氧化應(yīng)激以及海馬損傷[21]。過量暴露于Al還會導(dǎo)致β-淀粉樣前體蛋白(APP)過表達(dá)以及β-淀粉樣斑塊在腦細(xì)胞上沉積,這就使Al成為了一種可行的阿爾茨海默誘導(dǎo)物[22]。因此,在嚙齒類動物中聯(lián)用D-gal及AlCl3是獲得AD模型的有效、廉價方法,用于研究AD機制及藥物篩選[23-24]。MWM是測試海馬功能的有力工具,目前仍被用于評估學(xué)習(xí)及記憶能力[25],該實驗包括兩個程序,即獲得性訓(xùn)練及空間探索實驗,分別用于測量動物的學(xué)習(xí)能力及記憶鞏固能力[17]。
在獲得性訓(xùn)練階段,與對照組相比,AD模型組在4 d的訓(xùn)練中逃避潛伏期顯著延長(P<0.05),表明AD模型大鼠學(xué)習(xí)能力嚴(yán)重受損,提示AD造模成功。與AD模型組相比,從獲得性訓(xùn)練第2 d起,無論是GPs低劑量組還是高劑量組,GPs干預(yù)均顯著地縮短了AD大鼠的逃避潛伏期(低劑量組:相應(yīng)地,P<0.05、0.05、0.01;高劑量組:相應(yīng)地,P<0.01、0.01、0.01),提示口服GPs可緩解由于D-gal及AlCl3處理所導(dǎo)致的大鼠學(xué)習(xí)障礙(圖2)。

圖2 訓(xùn)練日的平均逃避潛伏期(n=7)
空間探索實驗結(jié)果與上述獲得性訓(xùn)練結(jié)果類似,AD模型組大鼠穿越原平臺所在位置的次數(shù)極顯著地(P<0.001)低于對照組,而GPs干預(yù)則極顯著地提高了AD大鼠穿越原平臺所在位置的次數(shù)(低劑量組:P<0.01;高劑量組:P<0.01)(圖3、圖4),提示口服GPs提高了AD大鼠對平臺空間位置記憶的保持能力。
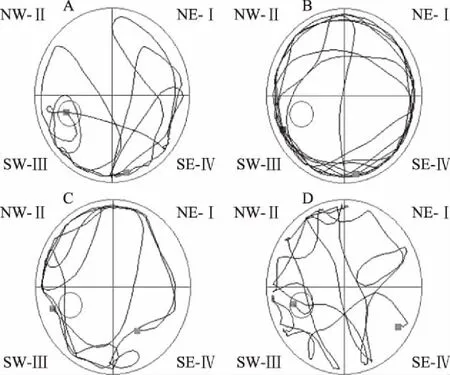
圖3 空間探索試驗中具有代表性的個體大鼠游泳軌跡
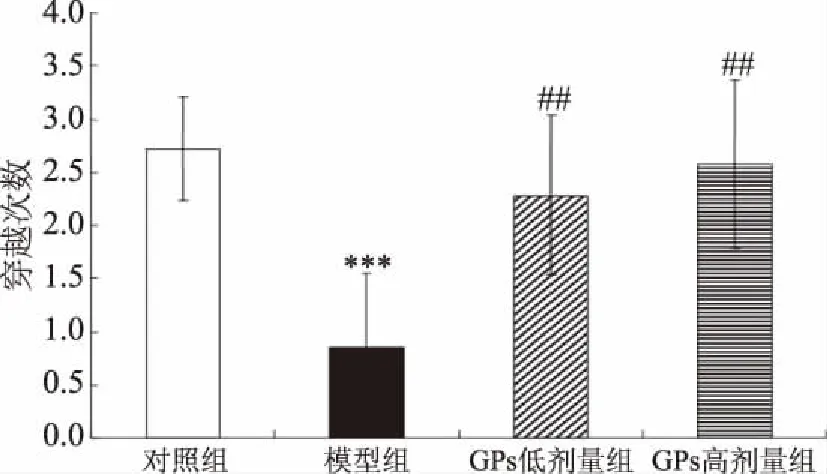
圖4 穿越平臺位置次數(shù)(n=7)
2.2 GPs對D-gal及AlCl3誘導(dǎo)的大鼠海馬形態(tài)改變的影響
與對照組相比,AD模型組大鼠海馬CA1區(qū)錐形細(xì)胞排列松散、紊亂。GPs的干預(yù)則改善了上述AD大鼠CA1區(qū)錐形細(xì)胞的無規(guī)則排列狀態(tài)(圖5)。研究顯示,與正常人相比,AD患者大腦海馬CA1區(qū)常出現(xiàn)萎縮,提示CA1區(qū)形態(tài)學(xué)改變與AD發(fā)病關(guān)系密切[26-28]。在本研究中,雖然不能確定AD模型大鼠海馬CA1區(qū)是否發(fā)生萎縮,但可以確定D-gal及AlCl3聯(lián)用可使大鼠海馬CA1區(qū)錐形細(xì)胞排列方式發(fā)生改變,而GPs灌胃則可有效地逆轉(zhuǎn)上述該種改變。在本研究中,HE染色檢測只是定性,不能定量,即不能確定不同劑量的GPs維持海馬正常形態(tài)的能力是否不同。與本研究類似,單獨HE檢測雖然可以發(fā)現(xiàn)不同劑量的草藥KXS均可提高AD大鼠海馬神經(jīng)細(xì)胞的存活并維持這些細(xì)胞的有序排列,但同樣沒有給出明確的劑效關(guān)系[29]。

圖5 大鼠海馬CA1區(qū)組織病理學(xué)分析(H&E,×200)
2.3 GPs對D-gal及AlCl3誘導(dǎo)的大鼠海馬氧化應(yīng)激的影響
與對照相比,AD模型組大鼠海馬SOD及GSH-PX活性均極顯著地下降(相應(yīng)地,P<0.001、0.001)(圖6、圖7)。與AD模型組相比,GPs干預(yù)組SOD及GSH-PX活性則極顯著地提高(低劑量組:相應(yīng)地,P<0.01、0.001;高劑量組:相應(yīng)地,P<0.01、0.001)。另一方面,與對照相比,AD模型組大鼠海馬MDA水平極顯著地提高(P<0.001),而GPs灌胃則極顯著地阻止了D-gal及AlCl3誘導(dǎo)的MDA水平升高(P<0.001)(圖8)。
圖6 GPs對大鼠海馬SOD活性的影響
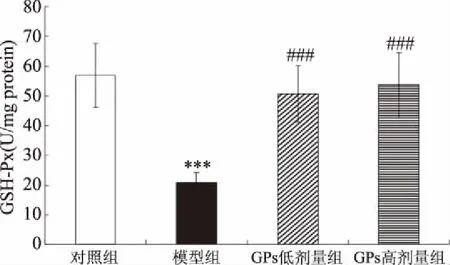
圖7 GPs對大鼠海馬GSH-Px活性的影響
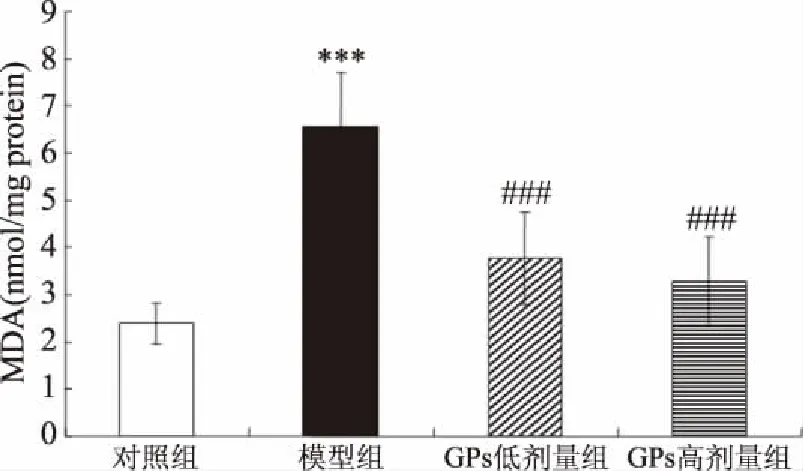
圖8 GPs對大鼠海馬MDA水平的影響
前期研究顯示,GPs降解的單糖主要為半乳糖(38%)、葡萄糖(15%)、氨基葡萄糖(15%)、甘露糖(9.2%)以及少量巖藻糖等還原性糖,而GPs的抗氧化應(yīng)激活性應(yīng)與其含有這些大量還原性糖有關(guān)。還原性糖主要結(jié)構(gòu)為具有還原性的多羥基以及醛基,在生化反應(yīng)中羥基及醛基能被氧化成羧基。
目前AD病因尚未完全明了,但最近的假說認(rèn)為,氧化損傷是AD早期事件,正是氧化損傷啟動了AD的其他病理過程[30]。通過阻止氧化損傷,抗氧化劑(SOD及GSH-Px)在抗氧化防御系統(tǒng)中發(fā)揮了重要作用,而丙二醛(MDA)作為脂質(zhì)過氧化的終極產(chǎn)物之一,則成為自由基介導(dǎo)損傷的一個標(biāo)志物,間接地反映了氧化損傷程度[31]。研究顯示,香菇多糖對AD大鼠學(xué)習(xí)記憶能力具有一定改善作用,其機制可能與增強大鼠大腦抗氧化能力有關(guān)[32];而土黨參多糖改善腦損傷小鼠學(xué)習(xí)記憶,也同樣伴隨著腦中GSH、SOD活性的提高,以及腦中MDA水平的下降[33]。因此,本研究檢測了大鼠海馬SOD、GSH-Px活性及MDA水平。研究結(jié)果顯示,AD模型大鼠SOD、GSH-Px活性較正常大鼠明顯降低,而MDA水平則顯著提高,該結(jié)果與另一種常用的AD動物模型建立方法即大腦注射Aβ1-40的方法相類似[34-35]。本研究結(jié)果還表明,GPs灌胃可顯著地緩解AD大鼠海馬的氧化應(yīng)激狀態(tài)。鑒于氧化應(yīng)激與AD的關(guān)系,上述氧化應(yīng)激狀態(tài)的緩解可能與AD大鼠其他癥狀的改善存在著一定程度的因果關(guān)系。
3 結(jié)論
本研究采用腹腔注射D-gal及AlCl3誘導(dǎo)SD大鼠建立AD模型,檢測GPs對大鼠認(rèn)知功能的保護(hù)作用并探討其可能機制。結(jié)果顯示,GPs可明顯改善D-gal及AlCl3誘導(dǎo)的大鼠認(rèn)知功能障礙及海馬CA1區(qū)病理改變,而該作用可能與GPs提高抗氧化酶活性、緩解氧化應(yīng)激狀態(tài)有關(guān),其具體機制仍有待從相關(guān)信號通路的角度深入研究。

