iTRAQ分析蜂膠乙醇提取物處理煙曲霉中差異蛋白的表達
徐曉蘭,沈 菲,楊 博,李玉潔,吳珍紅,繆曉青,楊文超,,*
(1.福建農林大學動物科學學院(蜂學學院),福建福州 350002;2.蜂產品加工與應用教育部工程中心,福建福州 350002;3.福建農林大學食品科學學院,福建福州 350002)
蜂膠是意大利工蜂采集膠源植物的芽孢或樹脂,與上顎腺分泌物、蜂蠟等物質混合加工得到的具有特殊芳香性的膠狀產物,具有解毒消腫、收斂生肌等功效[1]。蜂膠是一種比較復雜的化合物,可能含有的單體化合物有200多種,其中最主要的兩大類成分為黃酮和酚酸[2]。現有研究表明蜂膠中的黃酮和酚酸類物質具有良好的抑菌活性。從阿根廷蜂膠中分離出來的木酚素、白楊素、松屬素和高良姜素鑒定為當地蜂膠的主要抗真菌化合物[3];南非蜂膠中分離得到的咖啡酸苯乙酯(CAPE),與其他抗菌化合物如木犀草素、奎寧混合時,有更強的抗菌能力[4];泰國意蜂蜂膠中分離出的腰果酚,能抑制大腸桿菌的生長,并使其細胞受損和死亡[5]。此外,萜類物質也有很強的抑菌作用。例如,三萜烯是無刺蜂所采集的蜂膠的主要抗菌活性成分[6]。
煙曲霉廣泛存在于自然界,能夠感染免疫力低下人群而引起侵襲性曲霉病,致病性強,死亡率高[7]。目前治療曲霉病的藥物有卡泊芬凈(caspofungin)、伊曲康唑(Itraconazole)和兩性霉素B(Amphotericin B)等。前期研究發現蜂膠處理后的煙曲霉菌絲生長、呼吸作用和ATP的生成都受到抑制,但并未深入探討其抑菌機制[8]。近年來,同位素標記相對和絕對定量技術(isobaric tags for relative and absolute quantitation,iTRAQ)采用同位素編碼標簽,通過特異性標記多肽氨基酸基團及MS/MS分析,比較不同樣品中蛋白質水平,越來越多的被應用到藥物抑制真菌機制的研究中[9-10]。Cagas等[9]用iTRAQ 技術比較了卡泊芬凈對煙曲霉作用前后蛋白質表達的差異性,結果共鑒定到471個蛋白呈特異性表達,總計有122個蛋白的差異表達水平至少超過2倍,其中線粒體缺氧反應蛋白的差異表達水平達16倍以上。
本研究采用 iTRAQ技術篩選了煙曲霉在蜂膠處理前后的差異蛋白,并對差異蛋白(differentially expressed proteins,DEGs)功能進行基因注釋及分析,以期從蛋白組學的水平上發現與蜂膠抑菌作用相關的靶標蛋白,為蜂膠抑制煙曲霉的分子機制研究提供數據并奠定理論基礎。
1 材料與方法
1.1 材料與儀器
煙曲霉AS 3.3572 上海北諾生物科技有限公司;蜂膠 膠源植物楊樹屬,-20 ℃保存,福建省神蜂科技開發有限公司;蛋白濃度測定試劑盒、上樣緩沖液、蛋白 Marker 碧云天生物科技有限公司;伊曲康唑 江西紅星藥業有限公司。
TripleTOF 5600質譜儀 美國AB-SCIEX公司;LC-20AB納升液相色譜儀 日本島津公司。
1.2 實驗方法
1.2.1 蜂膠乙醇提取物(EEP)的制備及菌絲的培養 參照沈菲等[8]方法,用70%乙醇(V/V)提取蜂膠,冷凍干燥得到浸膏,最后用70%乙醇(V/V)溶解。菌絲采用PDB培養基液體培養,EEP終濃度為250 μg/mL,孢子懸浮液終濃度為106CFU/mL。35 ℃、180 r/min培養3 d后收集菌絲用于實驗。伊曲康唑(0.08 μg/mL)為陽性對照。
1.2.2 掃描電鏡觀察 收集菌絲,稱取0.5 g菌絲先使用5%的戊二醛固定4 h,然后每隔10~15 min用PBS緩沖液清洗樣品,重復三次后,再用1%鋨酸固定4 h,每隔10~15 min用蒸餾水清洗,重復三次每隔10~15 min分別使用50%、70%、80%、90%、100%的乙醇逐級稀釋,其中100%乙醇置換三次;最后再用叔丁醇置換兩次,冷凍干燥后上臺、噴金、上機觀察、拍照。
1.2.3 iTRAQ標記 采用丙酮沉淀法提取煙曲霉菌絲蛋白,用考馬斯亮蘭法測定蛋白濃度。經SDS-PAGE檢測合格后,每個樣品精確取出蛋白100 μg,用Trypsin進行酶解。酶解后的蛋白,進行iTRAQ標簽標記。
1.2.4 基于TripleTOF5600的LC-ESI-MSMS分析
1.2.4.1 SCX分離 采用LC-20AB液相系統、分離柱為4.6×250 mm型號的Ultremex SCX柱對樣品進行液相分離:將標記后抽干的混合肽段用4 mL buffer A(25 mmol/L NaH2PO4含 25% CAN,pH2.7)復溶,進柱后以1 mL/min 的速率進行梯度洗脫:在5% buffer B(25 mmol/L NaH2PO4,1 mol/L KCl 含 25% CAN,pH2.7)中洗脫7 min,一個20 min的直線梯度使buffer B由5%上升至60%,最后在2 min內使buffer B的比例上升至100%并保持1 min,然后恢復到5%平衡10 min。整個洗脫過程在214 nm吸光度下進行監測,經過篩選得到的12個組分分別用Strata X除鹽柱除鹽,冷凍抽干。
1.2.4.2 用Triple TOF 5600進行LC-ESI-MSMS分析 將冷凍抽干的樣品分別用buffer A(5% CAN,0.1% FA)復溶至約0.5 μg/μL的濃度,20000×g離心10 min,除去不溶物質。每個組分上樣5 μL,通過液相色譜儀進行分離。所用的柱子柱包括Trap柱和分析柱兩部分。分離程序如下:以8 μL/min的流速在4 min內將樣品加載到Trap柱上,總流速為300 nL/min的分析梯度將樣品帶入分析柱,分離并傳輸至質譜系統。先在5% buffer B(95% CAN,0.1% FA)下洗脫5 min,35 min內線性梯度使buffer B的比例由5%上升至35%,在接下來的5 min內提高到60%,然后在2 min內buffer B增加到80%并保持2 min,最后在1 min內恢復至5%并在此條件下平衡10 min。質譜采用結合納升噴霧Ⅲ離子源,掃描模式為反射模式,一級TOF-MS單張圖譜掃描時間為250 ms,3.3 s為一個循環,離子碎裂的能量設置為(35±5) eV。
1.2.5 qRT-PCR 隨機選取6個差異蛋白,進行qRT-PCR驗證。根據數據庫中的序列,利用Primer Premier 6.0軟件設計引物,引物序列見表1。采用Trizol法提取煙曲霉菌絲蛋白,用PrimeScriptTMRT reagent Kit with gDNA Eraser試劑盒(TAKARA)去除基因組DNA,并進行反轉錄得到cDNA,使用TB GreenTMPremix Ex TaqTMⅡ(Tll RNaseH Plus)試劑盒進行qPCR反應,反應體系20 μL。擴增條件:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,40個循環。各反應進行三次平行,三次重復。

表1 qRT-PCR引物
1.3 數據處理
對差異蛋白進行生物信息學分析,采用的是Mascot 2.3.02軟件從LC-ESI-MSMS得到的蛋白組數據,選用的數據庫為NCBI_Aspergillusfumigatus(28160 sequences)。定量的蛋白質比例經過加權,并通過Mascot中的中值比例進行歸一化,P<0.05且差異倍數達到1.5倍以上,視該蛋白為不同樣品間的差異蛋白[11]。對鑒定出的所有蛋白進行GO功能注釋分析,并和COG數據庫進行比對,預測這些蛋白質可能的功能并對其做功能分類統計。最后進行差異蛋白的GO功能和KEGG顯著性富集分析,GO功能顯著性富集分析采用Gene Ontology數據庫,pathway代謝通路采Kyoto Encyclopedia of Genes and Genomes(KEGG)數據庫進行分析。
2 結果與分析
2.1 EEP對菌絲體超微結構的影響
采用電子掃描電鏡觀察蜂膠處理過的煙曲霉菌絲形態,結果見圖1。對照組菌絲體結構完成、表面比較光滑,菌絲粗細均勻、排列整齊且相互之間界限清晰(圖1A);蜂膠處理后的菌絲體發生變形扭曲,表面出現褶皺、皺縮、凹陷、粗糙且粗細不均勻,出現膨大或卷曲,菌絲體之間相互纏繞,界限模糊(圖1B);陽性藥物組與蜂膠組類似,菌絲體發生變形扭曲,菌絲形態被破壞,不再完整(圖1C)。結果表明,1/2 MIC濃度的蜂膠提取物能夠有效的破壞菌絲結構和形態,從而抑制煙曲霉的生長。

圖1 蜂膠乙醇提取物對煙曲霉菌絲超微結構的影響
2.2 差異蛋白鑒定結果
在本次質譜實驗中共得到譜圖285207張,通過Mascot軟件進行分析后,匹配到的譜圖數量是26350張,其中Unique 譜圖數量為25617張,共鑒定到2730個蛋白,9766個肽段,其中含9573個Unique 肽段。如圖2,根據蛋白豐度差異倍數達到1.5倍以上且P-value小于0.05原則,蜂膠組與對照組蛋白相比,共有284個差異蛋白,其中123(43.5%)個上調,161(56.5%)個下調;藥物組與對照組相比,共有239個差異蛋白,其中90個上調,149個下調。
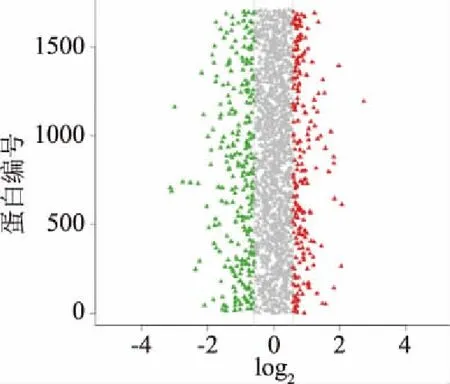
圖2 蜂膠處理前后煙曲霉差異蛋白分布圖
2.3 差異蛋白GO功能分析
對本次實驗鑒定到的蛋白進行GO分析,得到了差異蛋白的基因參與的生物過程(Biological process)、所處的細胞位置(Cellular component)及其分子功能(Molecular function),GO功能分析如表2所示。蜂膠處理后的煙曲霉中鑒定的蛋白參與的生物過程有19類,其中代謝過程(Metabolism process,30.51%)、細胞過程(Cellular process,26.4%)和生物調節(Biological regulation,4.58%)所占比率最大。差異蛋白所處的位置分為11類,主要的分布有細胞(Cell,24.23%)、細胞部分(Cell part,24.23%),細胞器(Organelle,16.07%)、膜(Membrane,8.57%)和細胞器部分(Organelle part,7.89%);對分子功能部分,鑒定的差異蛋白涉及12種分子功能,如轉運蛋白活性(transporter activity)、抗氧化活性(antioxidant activity)、核酸結合轉錄因子活性(nucleic acid binding transcription factor activity)等,其中主要包括的催化活性(Catalytic activity,48.15%)和結合類(Binding,39.14%)兩大類,其他都相對較少。

表2 差異蛋白GO功能分析
2.4 差異蛋白Pathway分析
對差異蛋白進一步進行KEGG和COG分析。差異蛋白富集較多的途徑如表3所示。藥物組和蜂膠組主要富集的10個途徑中,有5個共同的途徑包括代謝路徑、核糖體路徑、酪氨酸代謝、丙酮酸鹽代謝和糖酵解/糖異生。結果表明,差異蛋白富集較多的主要集中在代謝途徑和氨基酸代謝過程中。

表3 差異蛋白Pathway分析
2.5 差異蛋白COG分析
根據COG功能分類,差異表達蛋白質分為21個功能類別,由圖3可知,除分類未知的差異蛋白外,其他主要集中在氨基酸運輸和代謝(amino acid transport and metabolism)、能量生產和轉換(energy production and conversion)、蛋白質翻譯后修飾(Posttranslational modification)、翻譯和核糖體結構(Translation,ribosomal structure and biogenesis)和碳水化合物的運輸和代謝(carbohydrate transport and metabolism)等。蜂膠處理過的煙曲霉菌絲中的參與呼吸電子傳遞鏈、ATP生成及細胞壁/細胞膜等過程的部分差異蛋白結果見表4。

圖3 差異蛋白COG注釋分析

表4 蜂膠處理組的部分差異蛋白
2.6 差異表達蛋白的qRT-PCR驗證
為了驗證蜂膠組的差異表達蛋白在 mRNA水平的變化,隨機選擇6個差異蛋白對應的基因進行mRNA 表達水平的分析。圖4表明在蜂膠作用下,除了核糖體蛋白60S(ribosomal protein 60S)的蛋白表達趨勢與mRNA水平上的表達趨勢不一致外,其他5個蛋白和mRNA水平的表達趨勢都一致。
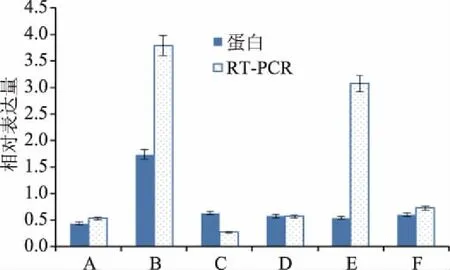
圖4 差異蛋白RT-PCR驗證
3 討論與結論
關于蜂膠抑菌機制的研究報道表明,蜂膠能夠改變菌體超微結構、影響真菌ATP的生成并影響菌體核酸形成。Peng等[12]研究了從蜂膠中分離出松鼠素對特異青霉具有很強的抗菌活性,通過深入研究發現松鼠素能夠抑制特異青霉孢子萌發時期和菌絲生長時期的線粒體的呼吸,同時松鼠素處理后的菌絲,細胞膜不是很明顯,細胞器消失。說明松鼠素可以干擾體內能量平衡,破壞病菌細胞的質膜,從而抑制特異青霉菌絲的生長。此外,槲皮素能夠抑制DNA促旋酶,槐屬蜂膠能夠抑制胞質膜功能,而且蜂膠中的干草查爾酮 A和C能夠抑制能量代謝[13]。Plaper等[14]研究表明槲皮素能夠和大腸桿菌DNA促旋酶Gyr B亞基結合,抑制ATP酶活性。Haraguchi等[15]研究了甘草查爾酮A和C抗菌作用方式,這些黃酮類化合物能抑制菌體呼吸,降低菌體主動運輸各種代謝產物和合成的大分子的速度,干擾菌體的能量代謝過程。
前期研究表明,蜂膠能夠抑制煙曲霉菌絲的生長和呼吸速率,且蜂膠處理后的菌絲孢子的超微結構嚴重受損。本研究利用iTRAQ技術對伊曲康唑和蜂膠乙醇提取物處理的煙曲霉進行了蛋白質組學研究,分別鑒定到了239和284個差異蛋白。
蜂膠乙醇提取物處理后,參與呼吸電子傳遞鏈的部分蛋白,如FAD結合域蛋白亞基、NAD-依賴性甲酸脫氫酶、NADH 泛醌氧化還原酶、細胞色素c亞基Vb、細胞色素c氧化酶家族蛋白、電子轉移黃素蛋白均下調,而黃素血紅蛋白、細胞色素氧化酶亞基2、NADH脫氫酶亞基上調。同時,蜂膠處理組耗氧量明顯低于對照組,說明蜂膠乙醇提取物能明顯抑制煙曲霉菌絲生長過程中的生長和呼吸。由于線粒體呼吸鏈與能量代謝有關,因此呼吸作用的抑制會干擾許多生理過程。目前,病原菌的呼吸鏈被認為是潛在的抗菌靶點。呼吸鏈抑制劑通過抑制蛋白合成,能夠有效地阻斷病原菌的萌發[16]。兩性霉素B能夠有效抑制煙曲霉,用兩性霉素B處理煙曲霉菌后,參與呼吸電子傳遞鏈的蛋白表達也發生了變化[10]。
在蜂膠乙醇提取物存在的情況下,許多參與ATP產生的蛋白,包括ATP合酶亞基H和線粒體F1F0 ATP合酶亞基都被下調。此外,腺苷酸激酶(adenylate kinase,AK)并在蜂膠的作用下表達上調。該酶通過將一個磷酸基從ATP轉移到AMP來催化ADP的合成,在維持細胞能量穩態中發揮重要作用。當機體處于低能量水平時,AK可以催化AMP產生ADP和ATP,因此AK可能會影響ADP和ATP的水平,介導細胞凋亡[17-18]。此外,與碳水化合物轉運和代謝相關的14種差異表達蛋白中有12種表達下調。這些下調的蛋白主要參與糖酵解(triose異構酶)[19]、戊糖磷酸途徑(ribose 5-磷酸異構酶A、6-磷酸葡萄糖苷actonase、transaldolase)等過程[20-21]。因為呼吸作用與ATP的產生有關,而ATP為煙曲霉的萌發和生長提供能量。蜂膠乙醇提取物處理煙曲霉后,菌絲ATP水平降低。結果表明,蜂膠乙醇提取物可干擾煙曲霉的呼吸電子傳遞鏈,并降低ATP的產生。
微管蛋白是細胞骨架的主要組成部分,在維持細胞形態、細胞分裂、信號轉導等過程中起著重要作用。微管蛋白聚集或微管解聚的抑制將導致細胞有絲分裂中止[22]。很多天然產物通過結合在微管蛋白的 CLC部位或 V LB部位而抑制其聚集,因此微管靶向劑結合微管蛋白的特殊部位,已在癌癥患者的治療中發揮重要作用。由此,許多研究提出微管可能是唯一的最佳癌癥靶點[23-25]。本文中,蜂膠乙醇提取物處理煙曲霉后,微管蛋白的差異性最顯著,上調6倍。此外,參與染色質結構和動力學的核小體結合蛋白和組蛋白H4均下調。因此,蜂膠乙醇提取物可能會影響煙曲霉細胞中紡錘絲的形成,從而抑制細胞的分裂。
核糖體蛋白是組成核糖體的主要成分,與核糖體RNA共同組成了核糖體,其不僅在核糖體組裝和蛋白質合成中起重要作用,還具有廣泛的核糖體外功能。如DNA 損傷修復、基因表達調控、mRNA翻譯、細胞的增殖、分化和凋亡等。有證據表明核糖體蛋白缺失會引起細胞周期阻滯和細胞凋亡等[26]。本實驗鑒定出8個核糖體蛋白,其中有7個顯著(P<0.05)下調,因此蜂膠乙醇提取物能夠影響煙曲霉菌絲核糖體的合成,從而抑制菌絲生長。
蜂膠組和陽性藥物組,有101個相同的差異蛋白,其中9個表達差異趨勢相反,其他蛋白表達趨勢都一致。表達趨勢一致的92個蛋白中,有69個表達下調,說明蜂膠乙醇提取物和伊曲康唑對煙曲霉有部分類似的抑制作用。此外,一些差異表達蛋白也在卡泊芬凈,兩性霉素B處理煙曲霉的研究中被報道[9-10]。例如幾丁質酶,這是一種完整的膜蛋白,參與真菌細胞壁的降解,經過兩性霉素B和蜂膠處理后表達上調。目前,由于幾丁質酶抑制微生物病原菌生長的能力,已被用在抗真菌藥物的研制中[27]。此外,翻譯延伸因子和β-葡萄糖苷酶經兩性霉素B和蜂膠乙醇提取物處理后也上調。蜂膠乙醇提取物處理中所有核糖體蛋白的反應均下調,而卡泊芬凈處理組中所有核糖體蛋白的反應均上調[9]。蛋白組數據說明蜂膠和抗生素抑菌機制并不完全相同。
此外,越來越多的研究報道基因轉錄水平和相應蛋白質表達水平之間并不完全一致[28-32]。煙曲霉在培養溫度從30 ℃換到48 ℃時,超過一半的蛋白表達水平和轉錄表達水平并不正相關。Albrecht等[28]闡述了“時間延遲模式”,表明由于翻譯過程在轉錄過程之后,因此兩者并不在一個時間點上,所以表達水平并不會完全一致。而且,mRNA 到蛋白質的過程中有許多環節,比如:復雜的剪切過程、翻譯過程及其環境影響如核糖體、tRNA以及氨基酸原料的狀態、翻譯后蛋白成熟剪接和修飾、成熟蛋白的穩定期等[33],這些因素也會影響兩者表達水平的變化。
綜上所述,蜂膠乙醇提取物對煙曲霉具有較強的抑制作用。蛋白組學研究表明,蜂膠乙醇提取物處理可以抑制煙曲霉菌絲生長、呼吸作用、ATP水平相關蛋白的表達,從而抑制煙曲霉的生長。

