蘿卜絲入壇發酵對安岳壇子肉發酵過程中微生物演替變化的影響
肖 嵐,何 蓮,安潘宇,李 娟,鮮丹丹,楊 瑤,杜雙巧
(1.四川旅游學院食品學院,四川成都 610100;2.成都農業科技職業學院,四川成都 610000)
壇子肉是四川安岳地區的一種特色發酵肉制品,是將豬五花肉經油炸之后拌入香辛料,一層蘿卜絲一層肉入壇發酵而成,因入陶壇發酵而成,故名壇子肉。由于壇子肉是在自然條件下發酵,發酵所需的微生物主要來自入壇的蘿卜絲所攜帶的野生菌株,因此氣候條件、發酵時間、蘿卜絲的初始微生物群落結構、壇子肉以及蘿卜絲本身的化學組成等都可能影響壇子肉的微生物種群分布、菌落演替、結構組成;而不同種類的微生物對壇子肉的色、香、味甚至安全性等都有較大影響,故研究壇子肉中微生物群落結構可調控和提升其產品質量。
在發酵肉制品領域,國內外學者主要是對發酵火腿[1-4]、發酵香腸[5-6]、發酵臘肉[7]、發酵魚[8-9]等的微生態系統進行了系統解析,甚至研發出專用發酵劑,關于安岳壇子肉發酵過程中微生物的演替規律和多樣性分析的報道較少。安岳壇子肉仍采用手工作坊式生產,依靠自然發酵,故存在產品質量不穩定的問題,因此,本文基于Illumina MiSeq高通量測序平臺對壇子肉、蘿卜絲中細菌的16S rDNA V3-V4區進行測序,以期獲得壇子肉中細菌的物種構成以及不同發酵時間樣品之間的差異關系,為壇子肉的標準化生產調控提供理論參考。
1 材料與方法
1.1 材料與儀器
豬五花肉 四川三元雜交內江豬,屠宰后未排酸成熟,備用;白蘿卜絲 水分含量20%,市購;糞便DNA提取試劑盒(E.Z.N.A.?Stool DNA Kit) 上海哈研生物科技有限公司;MiSeq Reagent Kit V3 美國Illumina公司;DNA提取試劑盒 E.Z.N.A.?Stool DNA Kit。
Illumina Miseq測序儀 美國Illumina公司。
1.2 實驗方法
1.2.1 壇子肉的制備 根據四川安岳縣普州壇子肉食品有限公司提供的工藝參數,壇子肉及蘿卜絲制備的流程如下:
壇子肉加工工藝流程如下:豬五花肉(采用五花肉作為原料,切配成500 g左右的長條狀)→晾干表面水分(自然晾干,冬季風干2~4 h,肉塊表面干爽為止)→油炸(采用豬油進行油炸,油溫160~180 ℃,油炸5~8 min,表面微黃即可)→腌制碼味(將濾過油的肉均勻涂抹上食鹽、白酒以及香辛料,放置2~3 h即可入壇腌制發酵)→入壇發酵75 d(一層蘿卜絲一層肉的方式入燒制的土壇中厭氧發酵,水封隔絕空氣)。
蘿卜絲的處理:以外購水分含量約20%左右的白蘿卜絲為原料,加入5%的食鹽入壇密封腌制3 d,出壇后即為腌制蘿卜絲;將腌制蘿卜絲與入壇發酵75 d蘿卜絲混合均勻(1∶1質量比),即得到混合蘿卜絲。一層蘿卜絲一層肉的方式(混合蘿卜絲與肉一起入壇)入壇厭氧發酵75 d,即入壇發酵75 d蘿卜絲。
取樣:分別在入壇發酵20、40、60、75 d進行取樣,壇子肉和蘿卜絲各200 g左右,經真空包裝后保存于-80 ℃,備用。
1.2.2 DNA提取和測序 采用 DNA 提取試劑盒提取不同發酵時間(20、40、60、75 d)的壇子肉和蘿卜絲樣品中的微生物總DNA,并通過瓊脂糖凝膠電泳檢測DNA純度,同時采用紫外分光光度計檢測DNA濃度。
擴增的目標區域是16S rDNA基因的V3-V4區域,通用引物序列為[10]:338F ACTCCTACGGGAGGCA GCAG,806R GGACTACHVGGGTWTCTAAT。擴增結束后,利用 2% 瓊脂糖凝膠電泳檢查擴增效果,并采用AMPure XT beads試劑盒對目標片段進行回收。
采用Qubit對純化后的PCR產物進行定量并建立文庫,合格文庫的濃度應在2 nmol/L以上。將合格的各上機測序文庫(Index序列不可重復)進行梯度稀釋,并經NaOH變性為單鏈進行2×300 bp的雙端測序。
1.3 數據處理
由于序列數量龐大,首先需要根據barcode信息對樣品進行數據拆分;利用overlap對雙端數據進行拼接,并進行質控、嵌合體過濾,獲得高質量的有效數據。本實驗對最終獲得有效數據進行97%的相似度聚類,為了降低假陽性率,會過濾singleton序列,獲得最終的OTU豐度及代表序列,進一步進行多樣性分析、物種分類注釋和差異分析等。不同發酵時間的壇子肉和蘿卜絲均采集3個平行樣品。
2 結果與分析
2.1 壇子肉和蘿卜絲樣品的微生物Alpha多樣性分析
Alpha多樣性[11](Alpha diversity)是指一個特定環境或生態系統內的多樣性,主要用于反映物種豐富度、均勻度以及測序深度。對測序進行拼接、過濾,8組樣品獲得有效序列數平均為27563條,按照97%的序列相似度將這些序列聚類成為OTUs(Operational Taxonomic Units)[12],得到每個cluster的序列及其代表序列即為OTU,用于統計每個OTU序列和豐度進行下游分析。發酵20 d壇子肉平均OTU數量687、40 d壇子肉654、60 d壇子肉814、75 d壇子肉507;發酵20 d蘿卜絲平均OTU數量380、40 d蘿卜絲431、60 d蘿卜絲872、75 d蘿卜絲452。
圖1為不同發酵時間的壇子肉和蘿卜絲的等級豐度圖(rank abundance curve),用來展示不同樣品(即用不同曲線表示)的菌群相對豐度和均勻度。由圖1可知,所有曲線在橫軸的范圍均較大,即所有樣品的菌群數量(被排序的OTU數量)均較多,菌群的豐富度均較高;在垂直方向,所有曲線的梯度均較陡峭,說明所有樣品的菌群種類分布不均勻。
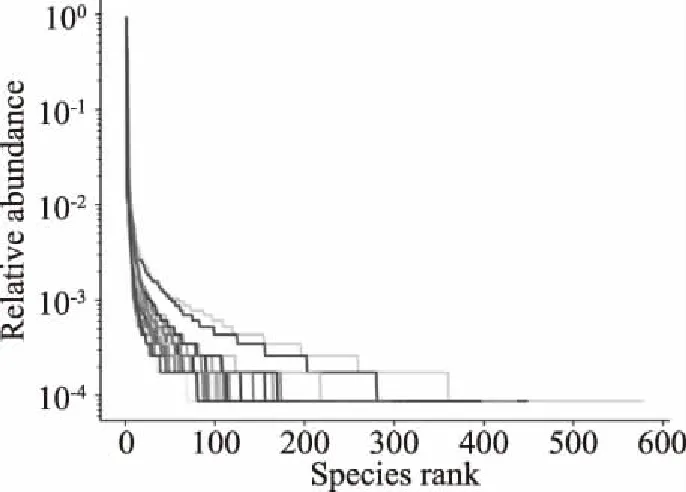
圖1 不同發酵時間壇子肉和蘿卜絲的等級豐度圖
不同發酵時間的壇子肉以及蘿卜絲樣品的Alpha多樣性指數見表1,各樣品的菌群覆蓋度指數(Goods coverage)均能達到98%以上,表明本次測序相對于整體樣品的覆蓋程度是非常高的。Chao1指數用于估計樣品中所含OTU數目。按照發酵時間先后,壇子肉的平均Chao1指數分別為491.84、466.93、596.35和390.03,蘿卜絲的平均Chao1指數分別為254.57、338.36、585.05和311.92。結果提示,60 d壇子肉及蘿卜絲的中所含OTU數目最高。
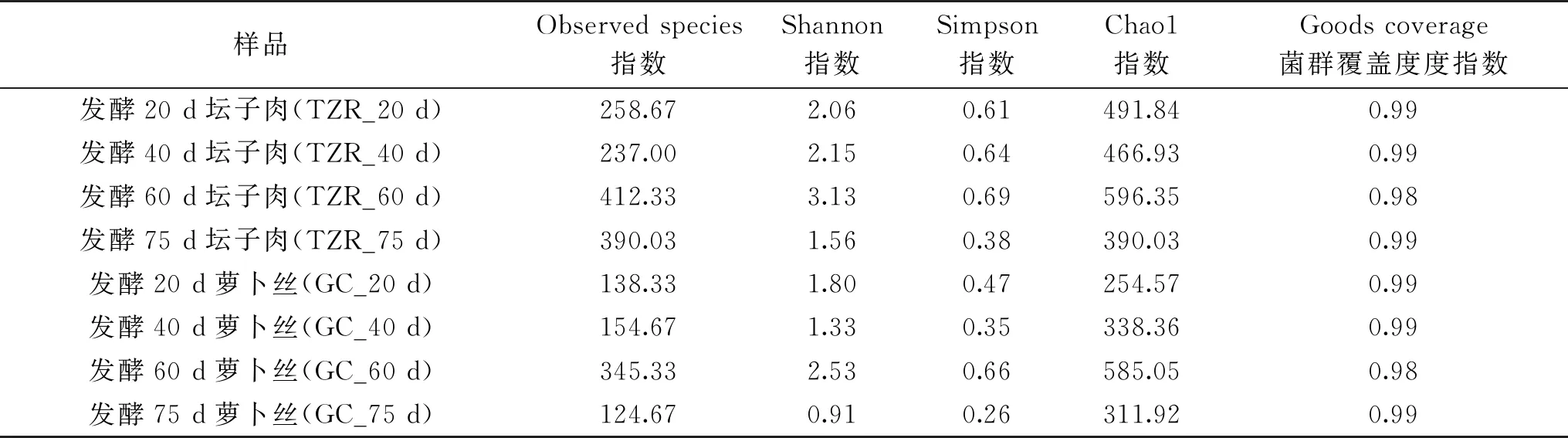
表1 不同發酵時間壇子肉和蘿卜絲的生物群落豐富度和多樣性指數(n=3)
observed species指數表示該樣品中含有的物種數目。按照發酵時間先后,壇子肉的平均observed species指數分別為258.67、237.00、412.33和390.03,蘿卜絲的平均 observed species指數分別為138.33、154.67、345.33和124.67。結果提示,60 d壇子肉和蘿卜絲中含有的物種數目最高。Simpson指數越高,意味著樣品物種多樣性越高。Shannon指數越高反映 OTU 出現的紊亂和不確定性越高。60 d發酵的壇子肉及蘿卜絲的Simpson指數、Shannon指數均最高。綜上,隨著發酵時間延長,蘿卜絲與壇子肉中的細菌菌群豐富度和多樣性增加,特別是壇子肉中細菌菌群豐富度和多樣性增加較快,這可能與蘿卜絲隨壇子肉入壇加速發酵進程[13-14]有關。然而,發酵75 d壇子肉中的細菌菌群豐富度和多樣性迅速下降,可能是優勢菌群的大量繁殖抑制雜菌的生長,并導致壇子肉及蘿卜絲pH下降從而進一步抑制雜菌的生長。
2.2 壇子肉和蘿卜絲樣品中物種群落結構差異的比較
Beta多樣性主要用于研究不同樣品之間的物種群落結構差異,而Alpha多樣性只是用來描述單個樣品的物種多樣性。為比較不同發酵時間樣品的細菌群落相似性,采用Beta多樣性分析中常用的主成分分析法(PCA,Principal Component Analysis)和算術平均數無權重對組法(Unweighted Pair Group Method with Arithmetic Mean,UPGMA)進行比較分析,如果樣品間的細菌群落組成越相似,則它們在PCA圖、UPGMA 層次聚類分析圖中的距離越接近[15]。UPGMA層次聚類分析包括unweighted unifrac和weighted unifrac兩種算法,其中unweighted unifrac計算樣品之間距離時更側重描述由群落構成差別而導致的樣品間的差異,weighted unifrac計算樣品之間距離時更側重于描述由群落物種豐度梯度改變而導致的樣品間的差異。
如圖2所示,不同分支代表不同發酵時間的壇子肉和蘿卜絲,其細菌群落結構有較大差異。20 d壇子肉與20 d 蘿卜絲、40 d壇子肉與40 d蘿卜絲分別位于兩個不同的分支,說明發酵初期(發酵過程的前半段,即發酵前 40 d)的壇子肉和蘿卜絲的細菌群落結構的差異較大。60 d壇子肉與60 d蘿卜絲、75 d壇子肉與75 d蘿卜絲分別位于同一分支,說明發酵后期(發酵過程的后半段,即發酵40~75 d)的壇子肉和蘿卜絲的細菌群落結構較為接近。這是因為蘿卜絲入壇時攜帶大量微生物菌群,而壇子肉在入壇前經過高溫油炸,表面微生物幾乎殺死,蘿卜絲隨壇子肉一起入壇發酵,壇子肉為蘿卜絲中的微生物提供碳源、氮源從而促進其大量繁殖,隨著發酵時間延長,壇內微生物趨于平衡,因此壇子肉和蘿卜絲在發酵前期的細菌群落結構的差異較大,發酵后期的差異較小。
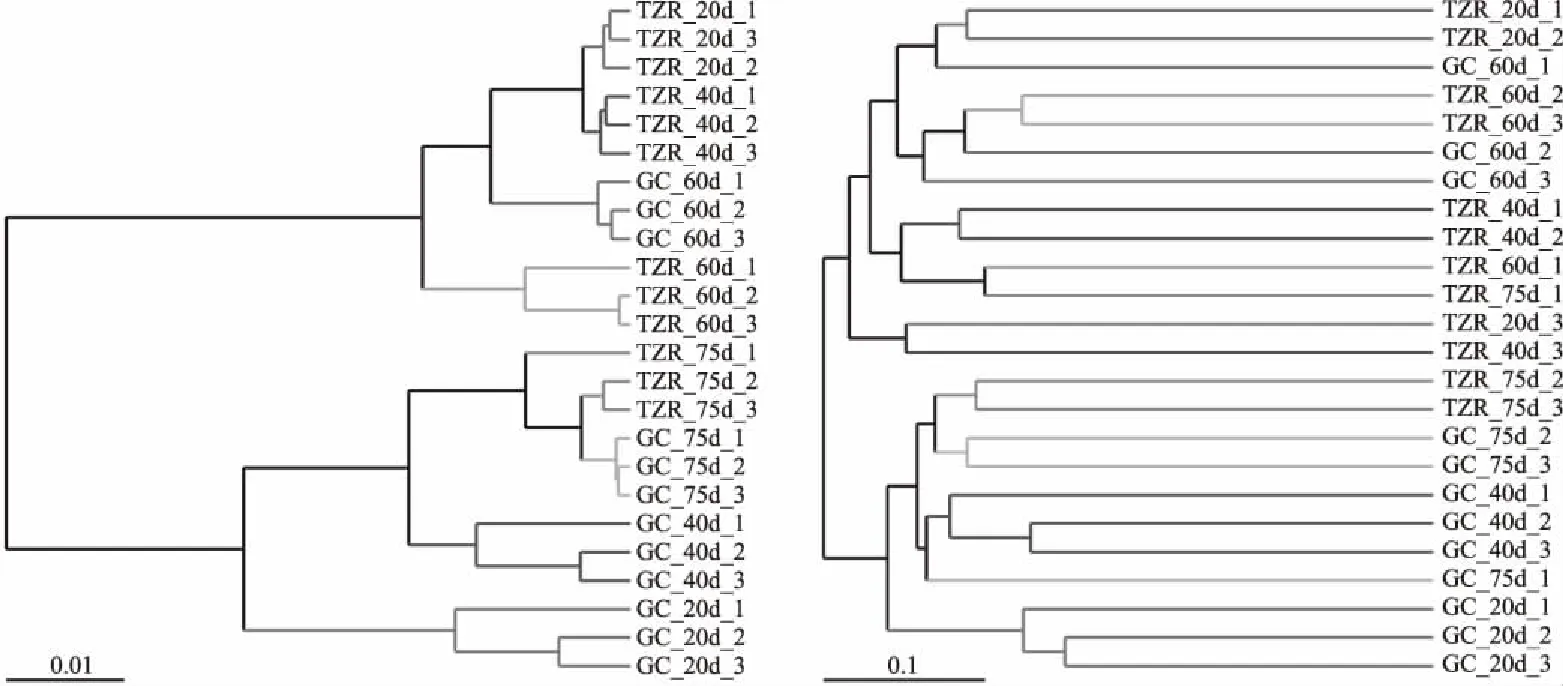
圖2 UPGMA層次聚類分析
另外,75 d壇子肉的3個平行樣品中有1個樣品離散在群體之外,提示這個樣品與其他2個樣品的相似性不高,可能與發酵過程中的開壇取樣有關。在實際生產中,為確保壇內微生態環境的穩定,減少雜菌的污染,采用的是密封發酵。
PCoA分析是最適用于展現樣品組間與組內的微生物多樣性的方式,是基于UPGMA(Weight-UniFrac)層次聚類分析獲得的PCoA分析2D示意圖。如圖3所示,通過對同一發酵時間點的壇子肉與蘿卜絲在PCoA分析的2D示意圖中的距離比較發現,75 d壇子肉與75 d蘿卜絲的距離最近,說明75 d壇子肉與75 d蘿卜絲的微生物結構組成最為相似,這應該與發酵后期的壇內微生物組成趨于平衡有關系。
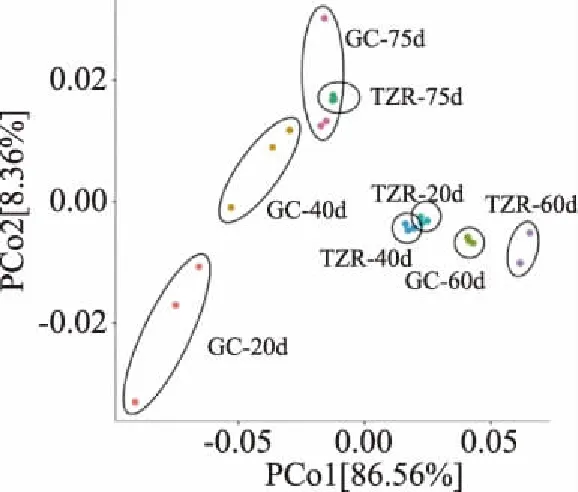
圖3 PCoA分析2D示意圖
2.3 不同發酵時間的壇子肉、蘿卜絲的物種注釋
采用RDP[16]和NT-16S數據庫對不同發酵時間壇子肉、蘿卜絲中的微生物做物種注釋,采用Blast軟件進行分類比對,具體的參數設置如下:RDP置信度0.8,blast比對最小identity為90%,最小query覆蓋度為80%,最大evalue為1e-5,evalue區間倍數為10倍。
聚類柱狀圖即對豐度前20的物種進行Bray-Curtis距離聚類,以展現物種分類及樣品距離之間的關系,如圖4所示,隨著發酵時間的延長,壇子肉和蘿卜絲中的細菌群落的物種分類越少,厚壁菌門(Firmicutes)逐漸成為了優勢物種。不同發酵時間壇子肉中厚壁菌門的豐度均高達98%以上,且隨發酵時間延長,其豐度變化不大;而發酵蘿卜絲中厚壁菌門的豐度隨發酵時間延長呈上升趨勢,由88.30%(20 d蘿卜絲)上升到 99.97%(60 d蘿卜絲),二者差異極顯著(P<0.01)。結果提示,壇子肉與蘿卜絲混合發酵環境下,壇子肉可促進蘿卜絲中厚壁菌門豐度增加。隨發酵時間延長,發酵蘿卜絲中藍藻門(Cyanophyta)的豐度呈下降趨勢,由7.47%(20 d蘿卜絲)下降到0%(60 d蘿卜絲);而發酵壇子肉中藍藻門的豐度卻呈上升趨勢,由0.15%(20 d壇子肉)上升到0.45%。結果提示,混合發酵可能促進了藍藻門由蘿卜絲向壇子肉轉移,壇子肉中藍藻門豐度的增加。變形菌門(Proteobacteria)在發酵20 d蘿卜絲中的豐度最高,為3.52%,其豐度隨著發酵時間延長急劇下降,60 d 蘿卜絲中的豐度僅為0.02%;而壇子肉中的變形菌門得豐度呈上升趨勢,由0.03%(20 d壇子肉)上升到 0.59%(75 d壇子肉)。結果提示,發酵可能促進了變形菌門由蘿卜絲向壇子肉轉移,壇子肉中變形菌門豐度的增加。以上結果提示,蘿卜絲與壇子肉一起發酵,促進了壇子肉中變形菌門、藍藻門豐度增加,以及蘿卜絲中厚壁菌門豐度增加。最終,壇內細菌群落將趨于平衡,這與UPGMA層次聚類分析及PCoA分析的結果一致。
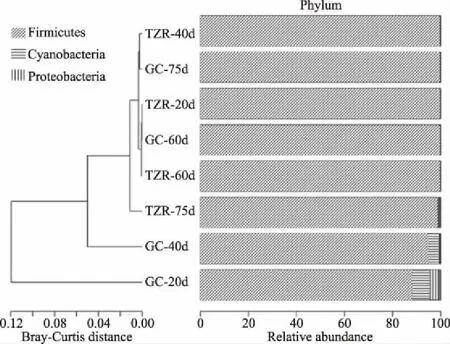
圖4 門水平上各樣品細菌群落變化聚類柱狀圖
由Bray-Curtis距離聚類樹可知,20 d壇子肉與60 d蘿卜絲、40 d壇子肉與75 d蘿卜絲的聚類較近且分支較短,說明其菌群組成較相似。結果提示,發酵早期壇子肉(即20 d壇子肉、40 d壇子肉)的細菌群落與發酵中后期蘿卜絲(60 d蘿卜絲、75 d蘿卜絲)相似,這應該與入壇蘿卜絲中豐富的細菌群落及其分泌的高活性酶、壇子肉中豐富的營養成分(蛋白質、糖類、脂肪),陶壇中的殘留的活菌(每次發酵結束后,陶壇是不清洗的,繼續下一輪的發酵)有關,從而促進了壇子肉在20 d內迅速發酵,細菌群落豐度迅速增加。事實上,壇子肉在發酵的75 d中,發酵前期可能是其微生物迅速增殖、感官品質(色、香、味、形、質)形成的階段,而發酵后期應該是其后熟的階段,即壇內細菌群落穩定、壇子肉感官品質進一步完善,特別是風味的進一步提高。關于壇子肉發酵時間、后熟時間的確定,本項目組將進一步做深入研究。
不同發酵時間的壇子肉、蘿卜絲中菌群在屬水平上的變化如圖5所示,細菌群落的相對豐度在屬水平上最高的是乳酸桿菌屬(Lactobacillus),在不同發酵時間的壇子肉中的豐度均大于99%(P>0.05),然而在20 d蘿卜絲中的豐度最低,為92.68%,隨著發酵時間延長,蘿卜絲中乳酸桿菌屬豐度呈上升趨勢,75 d 蘿卜絲中乳酸桿菌屬豐度為99.61%。藍細菌屬(Streptophyta)在不同發酵時間的壇子肉中的豐度均低于1%(P>0.05),且隨著發酵時間延長呈上升趨勢,而蘿卜絲中的豐度呈下降趨勢;20 d蘿卜絲中豐度最高,為7.61%,75 d蘿卜絲中豐度最低,為0。伯克氏菌屬(Burkholderia)在20 d蘿卜絲中的豐度較高,占樣品菌群的2.95%,隨著發酵時間延長其豐度降低;伯克氏菌屬在壇子肉中的豐度均低于1%,無明顯變化規律(P>0.05)。以上結果與細菌群落在門水平上的豐度分析結果一致,即隨著發酵時間延長,壇內細菌群落將趨于平衡。此外,不同發酵時間的壇子肉中均未檢出杜搟氏菌屬(Duganella)、類芽孢桿菌屬(Paenibacillus)、根瘤菌屬(Rhizobium)、紫色桿菌屬(Janthinobacterium)、黃色桿菌屬(Flavobacterium)、四聯球菌屬(Tetragenococcus),其中杜搟氏菌屬、類芽孢桿菌屬、根瘤菌屬、紫色桿菌屬、黃色桿菌屬僅在20 d發酵蘿卜絲中檢出,其他發酵蘿卜絲中均未檢出。這可能與壇子肉中的高豐度乳酸桿菌有關,乳酸桿菌能夠抑制雜菌生長[17-18],此外,隨著蘿卜絲中乳酸桿菌豐度的提高,蘿卜絲中的雜菌也受到了抑制。
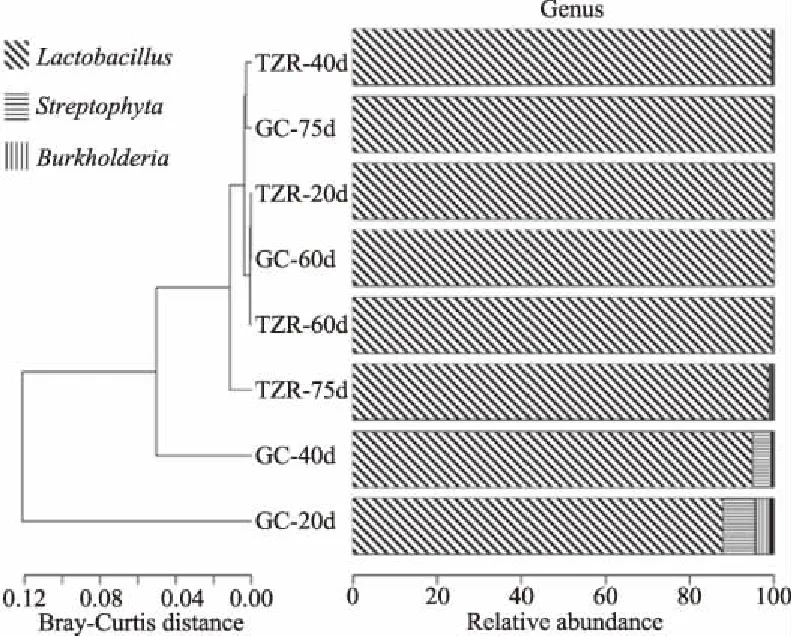
圖5 屬水平上各樣品細菌群落變化聚類柱狀圖
由Bray-Curtis距離聚類樹可知,20 d壇子肉與60 d蘿卜絲、40 d壇子肉與75 d蘿卜絲的聚類較近且分支較短,說明其菌群組成較相似,此結果與門水平上的 Bray-Curtis距離聚類樹結果一致。
細菌物種分類熱圖是基于不同分類水平的物種豐度表繪制的,并經過Z值轉化,將同一個菌的表達豐度進行歸一化。從圖6可以看出,75 d壇子肉中色彩值大于1的優勢菌屬的種類最多,有7種,包括棒狀桿菌屬(Corynebacterium)、丙酸桿菌屬、葡萄球菌屬、螺桿菌屬、鞘脂單胞菌屬、假單胞菌屬、β-變形菌屬(Betaproteobacteria_unclassified)。60 d壇子肉中色彩值大于1的優勢菌屬的種類有3種,包括雙歧桿菌屬、乳酸桿菌屬、螺桿菌屬。40 d壇子肉中色彩值大于1的優勢菌屬的種類有2種,包括雙歧桿菌屬、乳酸桿菌屬。20 d壇子肉中色彩值大于1的優勢菌屬的種類有4種,包括雙歧桿菌屬、乳酸桿菌屬、鏈球菌屬、四聯球菌屬。前人報道,乳酸菌屬[16]、鏈球菌屬、葡萄球菌屬[19]、片球菌屬(Micrococcus)和青霉菌屬(Penicillium)等是發酵肉制品中的優勢菌屬[20]。本試驗中,雙歧桿菌屬、乳酸桿菌屬在壇子肉發酵的前60 d一直保持著較高的豐度,鏈球菌屬是20 d壇子肉中的優勢菌屬,葡萄球菌屬是75 d壇子肉中的優勢菌屬[21]。關于雙歧桿菌屬、乳酸桿菌屬在20、40、60 d壇子肉中均為優勢菌屬,而在75 d壇子肉中不是優勢菌屬,這與周慧敏等[22]、Essid等[23]、潘曉倩等[24]結果結果一致,即發酵肉中的乳酸菌數量在發酵過程中呈先上升后下降的趨勢。

圖6 各樣品在屬水平的熱圖
棒狀桿菌屬、丙酸桿菌屬、螺桿菌屬、鞘脂單胞菌屬、假單胞菌屬、β-變形菌屬是75 d壇子肉的優勢菌屬,四聯球菌屬是20 d壇子肉的優勢菌屬,這與前人報道不同[25],可能與蘿卜絲入壇發酵有關。
20 d蘿卜絲中的優勢菌屬的種類最多,60 d蘿卜絲中的優勢菌屬的種類最少,即蘿卜絲中的優勢菌屬的種類隨著發酵時間延長先降低后升高。20 d蘿卜絲中色彩值大于1的主要優勢菌有紫色桿菌屬、杜搟氏菌屬、黃色桿菌屬、類芽孢桿菌屬、根瘤菌屬、丙酸桿菌屬(Propionibacterium)、伯克氏菌屬、鞘脂單胞菌屬(Sphingomonas)、藍細菌屬;40 d蘿卜絲中色彩值大于1的優勢菌屬有四聯球菌屬、葡萄球菌屬、螺桿菌屬(Helicobacter)、鏈球菌屬(Streptococcus)、根瘤菌屬、類芽胞桿菌屬(Paenibacillus);60 d蘿卜絲中色彩值大于1的優勢菌屬有乳酸桿菌屬、鏈球菌屬、雙歧桿菌屬(Bifidobacterium);75 d蘿卜絲中色彩值大于1的主要優勢菌屬有乳酸桿菌屬、鏈球菌屬、四聯球菌屬、葡萄球菌屬(Staphylococcus)、根瘤菌屬、鞘脂單胞菌屬(Sphingomonas)、假單胞菌屬(Pseudomonas)。以上結果提示,發酵初期蘿卜絲中的微生物群落的種類很豐富,隨著發酵時間的延長,蘿卜絲中的優勢菌群種類減少,并與同一發酵時間節點的壇子肉中優勢菌群的種類接近,特別是發酵 60 d 時的優勢菌群種類最為接近。另外,丙酸桿菌屬、螺桿菌屬、假單胞菌屬、鞘脂單胞菌屬、四聯球菌屬是發酵蘿卜絲中的優勢菌屬,證實了之前的猜想,即壇子肉中的丙酸桿菌屬、螺桿菌屬、鞘脂單胞菌屬、假單胞菌屬、四聯球菌屬可能與蘿卜絲入壇發酵有關。
3 結論
蘿卜絲隨壇子肉入壇發酵,隨發酵時間延長,壇子肉中微生物的豐富度越來越高,多樣性增加,均勻度增加,說明蘿卜絲入壇發酵促進了壇子肉中微生物的生長繁殖,特別是發酵第60 d的壇子肉及蘿卜絲中細菌菌群的豐富度和多樣性明顯高于其他發酵階段的樣品。另外,壇子肉中的優勢菌群主要包括乳酸桿菌屬、雙歧桿菌、葡萄球菌屬、鏈球菌屬、螺桿菌屬等,不同發酵時間節點的壇子肉及蘿卜絲中的優勢菌群種類差異較大,且壇子肉在不同發酵時間的優勢菌群與對應發酵時間的蘿卜絲的優勢菌群差異較大。當發酵時間為60 d時,壇子肉、蘿卜絲中的優勢菌群均包括乳酸桿菌屬、雙歧桿菌屬,推測60 d發酵時間是壇子肉與蘿卜絲中乳酸桿菌屬、雙歧桿菌屬平衡的時間節點。

