卡馬西平對正常大鼠精子質量及StAR蛋白表達影響
劉宇軒,劉紅娟,吳德玲,童小慧,李 莉,王桐生,3
(安徽中醫藥大學 1.中西醫結合學院藥理學教研室,2.科技處,3.中西醫結合研究所,安徽 合肥 230012)
卡馬西平(carbamazepine,CBZ)是經典的抗癲癇藥,為治療單純或復雜部分性發作癲癇的首選藥[1]。臨床使用卡馬西平多長期用藥,對其毒副作用研究大部分局限于肝腎功能損傷等,而對男性生殖系統安全性并未進行充分審查[2]。近年研究發現卡馬西平可導致激素水平紊亂、精子質量下降[3],甚至出現性功能障礙[4-5],但雄性生殖系統損傷的具體機制研究較少,并存在一定爭議[6]。本研究通過對大鼠長期給予不同劑量卡馬西平,觀察其對精子質量、睪丸結構、睪酮水平的影響,分析卡馬西平的生殖毒性及部分機制,為臨床安全用藥提供參考。
1 材料與方法
1.1 實驗動物♂ Sprague-Dawley(SD)大鼠,適齡6~8周,體質量(200~220) g,SPF級,購于濟南朋悅實驗動物繁育有限公司,許可證號SCXK(魯)20190003。晝夜12 h交替照明環境下飼養,控制溫度(20~25) ℃,相對濕度(60±5)%。
1.2 藥物與試劑卡馬西平片(江蘇鵬鷂藥業有限公司,批號1901101);大鼠T、LH、FSH、E2、PRL、P酶聯免疫吸附測定ELISA檢測試劑盒(泉州市睿信生物有限公司,批號均為08/2019);4%多聚甲醛固定液;BCA蛋白定量試劑盒(上海碧云天生物技術公司,批號102517180413);BSA(美國Solarbio公司,批號A1810);StAR抗體(英國Abcam公司,批號ab12556),3β-HSD抗體(北京博奧森生物技術有限公司,批號ABP50859),17β-HSD抗體(美國Proteintech公司,批號OC181821),GAPDH內參抗體(英國Abcam公司,批號ab18365)。
1.3 儀器精子計數板(Makler Counting Chamber,以色列);生物組織包埋機(湖北泰維電子有限公司);NOVA超薄切片機(LKB公司);Ⅸ81型光學顯微鏡(日本Olympus公司);DYY-6C型電泳儀(北京六一生物科技有限公司);MK3型酶標儀(美國Thermo公司)。
1.4 方法
1.4.1動物分組與處理 將大鼠隨機分為卡馬西平50、100、200、400 mg·kg-1劑量組(按公斤體重計算,相當于人用量600 mg·d-1的5、10、20、40倍)和空白對照組,各組動物按劑量灌胃給藥,10 mL·kg-1,空白組給予同等量的蒸餾水,連續給藥90 d。末次給藥后禁食不禁水12 h,3%水合氯醛麻醉大鼠,腹主動脈采血,摘取睪丸、附睪等臟器,進行相關指標檢測。
1.4.2臟器系數測定 取大鼠睪丸、附睪稱重,計算臟器系數。臟器系數/%=臟器重量(g)/體重(g)×100%。
1.4.3精子計數、精子活率及活力測定 將附睪洗凈,剝離脂肪組織,放入盛有3 mL,37 ℃預熱生理鹽水的燒杯內,用眼科剪沿附睪尾端橫縱切6~8刀,置于37 ℃水浴培養箱中分散15 min,讓精子從附睪尾中游離出,200目濾網過濾得精子懸液,保持溫度37 ℃。蘸取一滴精子懸液置于Marker精子計數板中央的計數池中,200倍光學顯微鏡觀察10×10方格內精子數(n),每毫升精子數為n×106。每只大鼠觀察200個精子,并進行精子質量評級。分級標準如下:(a) 快速直線向前運動,直線運動;(b)緩慢向前直線運動或呆滯向前移動,緩慢運動;(c)非向前運動或原地顫動,原地運動;(d)不能活動,不運動。計算精子活率,活率/% =(a+b+c)/(a+b+c+d)×100%;統計向前移動的精子數,計算精子活力,活力/%=(a+b)/(a+b+c+d)×100%。
1.4.4ELISA法測定血清及睪丸組織性激素含量 腹主動脈采血,4 ℃離心機3 000 r·min-1離心15 min,分離血清;取睪丸組織200 mg加入2 mL生理鹽水研磨至勻漿,4 000 r·min-1離心10 min,取上清液-20 ℃保存。經酶聯免疫吸附法(ELISA)測定血清及睪丸組織T、LH、FSH、E2、PRL、P水平。
1.4.5HE染色觀察大鼠睪丸組織形態學變化 取新鮮睪丸組織4%多聚甲醛固定24 h以上,進行常規組織脫水、包埋、切片,HE染色,400倍光鏡下觀察并拍照。
1.4.6Western blot檢測睪丸組織中StAR、3β-HSD及17β-HSD蛋白表達 取200 mg睪丸組織加入2 mL的RIPA裂解液(1 mmoL·L-1PMSF)研磨,3 000 r·min-1離心后提取組織總蛋白,BCA蛋白濃度試劑盒檢測蛋白含量。樣本加入2倍蛋白上樣緩沖液,水浴煮沸6 min使蛋白變性,以GAPDH作為內參測定StAR、3β-HSD和17β-HSD蛋白表達。上樣蛋白于SDS-PAGE電泳分離(10%濃縮膠電泳80 V、40 min,4%分離膠電泳120 V、1.5 h),轉移至PVDF膜上,5%BSA室溫封閉1.5 h,洗膜后與一抗(1 ∶1 000) 4 ℃孵育過夜,再次洗膜后與辣根過氧化物酶標記的羊抗兔IgG (1 ∶10 000)搖床孵育1.5 h,避光條件下滴加ECL化學發光試劑于成像系統檢測條帶信號。采用ImageJ軟件分析各條帶的灰度值,計算相對蛋白表達量,相對蛋白表達量/%=目的蛋白灰度值/內參蛋白灰度值×100%。

2 結果
2.1 卡馬西平對正常大鼠臟器系數的影響Fig 1結果顯示,與空白對照組比較,連續灌胃90 d后,卡馬西平各組睪丸重量及睪丸臟器系數減小,差異具有統計學意義(P<0.05);體重、附睪重量以及附睪臟器系數差異無統計學意義(P>0.05)。

Fig 1 Effect of carbamazepine on testicular and epididymal coefficient in n=8)*P<0.05,**P<0.01 vs control group.
2.2 卡馬西平對正常大鼠精子計數、精子活率及活力的影響Tab 1結果可見,與空白對照組比較,卡馬西平各組精子活率、活力均明顯降低,差異均具有統計學意義(P<0.05),其中以400 mg·kg-1組精子活率及活力降低最為明顯,但精子計數差異無統計學意義(P>0.05)。
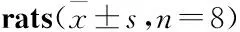
Tab 1 Effect of carbamazepine on sperm count and sperm viability and sperm motility in
2.3 卡馬西平對大鼠血清及睪丸組織性激素水平的影響血清性激素六項水平結果顯示,與空白對照組相比,卡馬西平各組T水平明顯降低,且隨藥物濃度升高呈梯度性下降,LH、FSH水平明顯升高,差異有統計學意義(P<0.05)。見Tab 2。
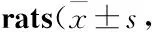
Tab 2 Effect of carbamazepine on serum hormone levels in n=8)
睪丸組織性激素六項水平結果顯示,與空白對照組相比,卡馬西平各組T、P水平明顯降低,且隨藥物濃度升高呈梯度性下降,LH、FSH水平明顯升高,差異具有統計學意義(P<0.05)。見Tab 3。

Tab 3 Effect of carbamazepine on level of sex hormone in rat n=8)
2.4 卡馬西平對大鼠睪丸組織形態的影響對睪丸組織HE染色、光鏡檢查,結果顯示空白對照組睪丸組織結構清楚,生精小管上皮層次完整、排列密集,管內可見清晰的各級生精細胞(精原細胞、精母細胞及精子細胞)和支持細胞,管間的間質細胞形態數目正常。給藥各組出現睪丸結構不完整,生精小管上皮退化、排列松散紊亂,各級生精細胞數量減少,管腔內精母細胞分化為精子細胞階段出現停滯,在200、400 mg·kg-1劑量組中小管間質減少、松散程度加重,間質細胞數目減少。見Fig 2。

Fig 2 Effect of carbamazepine on testicular morphology in rats(HE×400)A:Control group;B:50 mg·kg-1 CBZ group;C:100 mg·kg-1 CBZ group;D:200 mg·kg-1 CBZ group;E: 400 mg·kg-1 CBZ group
2.5 卡馬西平對StAR,3β-HSD,17β-HSD蛋白表達的影響采用Western blot檢測睪酮合成關鍵酶蛋白的表達水平。結果顯示:與空白對照組相比,給藥各組StAR、3β-HSD和17β-HSD蛋白表達均出現不同程度的下降,其中給藥各組StAR表達隨著藥物濃度增加而明顯降低(P<0.05),100、200和400 mg·kg-1劑量組3β-HSD表達明顯降低(P<0.05),200和400 mg·kg-1劑量組17β-HSD表達明顯降低(P<0.05)。見Fig 3。

Fig 3 Effects of carbamazepine on expression of StAR, 3β-HSD and 17β-HSD key enzymes in testicular tissues*P<0.05,**P<0.01 vs control group.
3 討論
卡馬西平作為單純或復雜部分性癲癇發作首選藥,長期用藥會對雄性生殖系統產生明顯的毒性作用,可導致正常大鼠生殖系統出現階梯性損傷,其影響程度與藥物濃度呈正相關[7]。本研究結果顯示,正常大鼠長期灌胃卡馬西平后,睪丸重量減小,臟器系數減小,精子活率和活力均下降,睪丸正常生理結構發生改變,生精小管以及各級生精細胞出現不同程度的病變,損傷程度隨著給藥濃度的增高而加重,與文獻報道基本一致,說明卡馬西平嚴重影響雄性大鼠生殖系統各項指標,損傷睪丸生殖細胞結構與功能,且存在藥物濃度相關性。
睪酮是男性體內最主要的雄性激素,缺乏睪酮會導致精子質量下降、男性性欲低下,甚至勃起功能障礙[8]。睪酮由睪丸間質細胞產生,占總體水平的95%,是體內睪酮的主要來源[9]。間質細胞在合成睪酮時需進行一系列酶促反應[10],膽固醇在轉運蛋白的調控下從線粒體外膜轉運至線粒體內膜,其中StAR起到關鍵性作用,為睪酮合成的主要限速步驟[11-12]。膽固醇進入線粒體內膜后一方面在3β-HSD催化下轉化為孕酮,另一方面被P45017α催化為17-羥孕酮和雄烯二酮,最后雄烯二酮在17β-HSD作用下轉化為睪酮[13],研究表明間質細胞損傷會影響睪丸類固醇生成[14]。Svalheim研究發現,以卡馬西平為代表的抗癲癇類藥物單藥治療引起男性血清睪酮水平下降[15],本研究結果顯示,與正常組相比,卡馬西平給藥各組大鼠的血清以及睪丸組織T均明顯降低,Western blot檢測給藥各組StAR、3β-HSD,17β-HSD表達減少。說明卡馬西平可能通過下調睪酮合成路徑相關酶蛋白的表達,導致大鼠體內的睪酮水平下降。
下丘腦-垂體-睪丸軸(hypothalamus-pituitary-testis axis,HPT軸)是調節男性生殖系統功能的主要神經內分泌調節系統,以自分泌或旁分泌的形式進行調控,下丘腦的正中前視核脈沖性釋放促性腺激素釋放激素,通過垂體門脈系統作用于腺垂體釋放 LH和FSH等促性腺激素,從而促進性腺發育成熟和性激素的合成[16]。當自身發生病變或外源性化學物質干擾了雄激素正常水平,會對HPT軸產生應激作用,通過負反饋機制改變LH以及FSH等促性腺激素的分泌量[17-18]。本實驗結果顯示, 血清及睪丸組織中LH、FSH明顯升高,可能與卡馬西平降低大鼠T水平,從而使HPT軸應激產生負反饋調節有關。

