完全腹腔鏡與開腹遠端胃癌根治術治療進展期胃癌的療效對比分析
劉 珞,危志遠,傅志雄,丁緒鵬,曹 宏
(吉林大學中日聯誼醫院普通外科,吉林 長春,130000)
胃癌是起源于胃黏膜上皮的惡性腫瘤,好發于胃小彎近幽門部,是最為常見的消化道腫瘤之一。據統計,2018年全球胃癌新發病例約103.4萬例,死亡病例約為78.3萬例,而我國新發病例與死亡病例為45.6萬例與39.0萬例,占全球的44.1%與49.9%[1]。由此可知,胃癌是嚴重威脅人類生命健康的惡性腫瘤。早期胃癌的術后5年生存率可達90%以上,但由于早期胃癌無特異性癥狀,多延誤了診治,因此臨床多為進展期胃癌,其術后5年生存率僅約30%[2-3]。不論早期胃癌抑或進展期胃癌,主要治療方法仍是以手術為主的綜合治療,但開腹胃癌根治術的手術創傷較大,患者術后康復較慢,同時對患者的生活質量也有一定影響。近年隨著腹腔鏡技術的不斷發展,因其具有創傷小、視野范圍廣、康復快、應激反應小、住院時間短等優點已在臨床得到廣泛開展[4]。本研究回顧分析2018年9月至2019年9月我院收治的64例遠端進展期胃癌患者的臨床資料,以探討完全腹腔鏡與開腹遠端胃癌根治術的臨床療效。現將結果報道如下。
1 資料與方法
1.1 臨床資料 選擇2018年9月至2019年9月我院施行遠端胃癌根治術的64例遠端進展期胃癌患者的臨床資料,其中男36例,女28例;32~69歲,平均(53.7±7.4)歲。依據治療方法將患者分為腔鏡組(n=40)與開腹組(n=24)。兩組患者性別、年齡、腫瘤大小、各項血生化指標、合并疾病等臨床資料差異無統計學意義(P>0.05),具有可比性,見表1。納入標準:(1)符合《中華人民共和國衛生行業標準:胃癌診斷標準(WS316-2010)》關于進展期胃癌的診斷標準[5];(2)病理學檢查后證實為胃癌;(3)年齡≥18歲;(4)沒有絕對手術禁忌證;(5)征得患者知情同意并簽署相關知情同意書。排除標準:(1)伴有其他惡性腫瘤或發生腹腔、遠處臟器轉移;(2)合并其他嚴重器質性疾病;(3)患者死亡或無法完成本試驗任一環節。
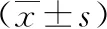
表1 兩組患者臨床資料的比較
1.2 手術方法 腔鏡組:患者取仰臥位,采用全身麻醉氣管插管,常規消毒鋪巾。臍下2 cm處穿刺Trocar,建立CO2氣腹,壓力維持在12~15 mmHg,置入腹腔鏡,探查腹腔內各臟器。采用五孔法操作,在腹腔鏡直視下分別于左側腋前線肋緣處建立主操作孔、左鎖骨中線臍上約2 cm處建立輔助操作孔,右上腹建立牽引孔,右鎖骨中線臍上約2 cm處建立輔助操作孔,置入操作器械。探查腫瘤大小、部位及轉移灶情況,確定淋巴結清掃范圍。超聲刀沿橫結腸邊緣離斷胃結腸韌帶,分離胃網膜組織,向右游離胃結腸韌帶,至胃網膜右血管根部,于胃網膜右動脈、靜脈根部分別結扎切斷,清掃No.6組淋巴結。由胃后間隙進入,沿胃十二指腸動脈解剖游離肝固有動脈及肝總動脈,清掃No.12a組淋巴結。沿幽門上解剖分離胃右動脈,于其根部離斷,清掃No.5組淋巴結。沿胰腺上緣解剖分離腹腔干、胃左動脈、脾動脈及肝總動脈,清掃No.7、8、9、11p組淋巴結。用生物夾于胃左動靜脈根部夾閉后離斷。挑起肝左外葉,暴露肝胃韌帶并沿肝緣用超聲刀離斷,游離胃小彎,向上清掃No.3組淋巴結。解剖游離胃網膜左動靜脈,根部用生物夾夾閉后離斷,然后清掃No.4組淋巴結。于脾門處離斷脾胃韌帶,胃短動脈用生物夾夾閉后離斷,向上解剖游離胃底。離斷膈胃韌帶,切開膈肌腹膜返折處,清掃No.1、2組淋巴結,游離食管下段距賁門口上緣約5 cm,用超聲刀離斷食管兩側迷走神經干。于幽門下約2 cm處用一次性直線切割閉合器切斷閉合十二指腸。鏡下用吻合器將殘胃與空腸上段行側-側吻合。切除的標本置入標本袋,將臍部切口擴至約4 cm縱行切口,標本經此切口取出。檢查腹腔內有無出血,放置引流管,逐層關腹。見圖1~圖5。開腹組:患者取仰臥位,全身麻醉,氣管插管,常規消毒鋪巾,上腹正中做約20 cm縱行切口,逐層切開皮膚、皮下組織至腹腔,探查腹腔。沿橫結腸切除大網膜,規范行淋巴結清掃,超聲刀游離十二指腸,結扎血管,切除胃體并行消化道重建,檢查無活動性出血后放置引流管,逐層關腹。兩組術后均予以抗感染、抑酸、補液等支持治療。
1.3 觀察指標 統計兩組術中出血量、手術時間、術后排氣時間、下床活動時間、住院時間、術后并發癥等指標,其中術中出血量、手術時間均以麻醉記錄為準。出院標準:患者可自主經口進食,腸道功能恢復,自主下地活動;無發熱、腹痛等癥狀;腹腔引流管已拔除;切口無感染、脂肪液化且均已拆線。統計術后腹腔內出血、切口感染、反流性胃炎、吻合口漏、胃排空障礙等并發癥發生情況。術后隨訪至2020年3月。
2 結 果
2.1 兩組術中及術后恢復情況的比較 腔鏡組術中出血量、術后排氣時間、術后下床活動時間、術后住院時間均優于開腹組(P<0.05),開腹組手術時間短于腔鏡組,差異有統計學意義(P<0.05)。見表2。
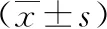
表2 兩組患者術中及術后恢復情況的比較
2.2 兩組手術相關并發癥的比較 腔鏡組總并發癥發生率為17.5%,開腹組為37.5%。兩組術后腹腔內出血、切口感染、反流性胃炎、吻合口漏、胃排空障礙發生率差異無統計學意義(P>0.05)。見表3。

表3 兩組患者術后相關并發癥的比較[n(%)]
3 討 論
胃癌是常見的消化道惡性腫瘤之一,其發病是幽門螺旋桿菌、胃部炎癥反應等多種因素長期共同作用的結果[6]。我國胃癌以胃體遠端多發,而病理組織學類型以中低分化腺癌為主[7]。早期胃癌一般無明顯不適癥狀,因此臨床上確診的多為進展期胃癌。進展期胃癌是指癌組織的浸潤深度超過黏膜下層,已達胃壁肌層或已穿過肌層達漿膜[8],其臨床治療主要是以手術根治性切除為主的綜合治療。
手術治療遠端進展期胃癌包括常規開腹遠端胃癌根治術與腹腔鏡下遠端胃癌根治術,常規開腹手術切口較大,可徹底清除病灶,清掃周圍淋巴結,能有效控制病情進展;但手術創傷較大,術后并發癥多,且對機體免疫功能也有一定影響[9]。隨著腹腔鏡技術的發展,因具有切口小、創傷小、術中出血量少等優勢,腹腔鏡下胃癌根治術在遠端進展期胃癌的治療中得到應用并日漸成熟。
本研究結果顯示,腔鏡組較開腹組所需手術時間更長(P<0.05),相較開腹遠端胃癌根治術,腹腔鏡下操作更為復雜,難度更大,耗時更長,對術者及其團隊的要求也更為嚴格。而從腹腔鏡手術的學習曲線可知[10],隨著術者操作經驗的積累、熟練程度的增加及團隊協作契合度的增加,腹腔鏡手術完全能達到與開腹手術相近的手術時間。但腔鏡組術中出血量、術后排氣時間、術后下床活動時間、術后住院時間均優于開腹組(P<0.05),提示腔鏡手術對正常組織損傷小,能有效減少手術帶來的創傷、術中出血量及對胃腸功能的影響,加速術后康復[11-12]。同時氣腹及腹腔鏡的放大作用可提供更清晰的視野,更清晰地顯示脈管、神經及筋膜等組織結構,從而進行更為細致的處理,利于術者對腹腔結構的探查及淋巴結的清掃。文獻報道[13],腹腔鏡下胃癌D2淋巴結清掃完全可獲得與開腹手術相當的淋巴結清掃效果,同時超聲刀良好的凝結效應可有效避免淋巴結清掃過程中腫瘤細胞的脫落種植[14],減少腫瘤的醫源性傳播擴散。既往研究顯示[15],腹腔鏡與開腹手術具有相似的術后并發癥發生率;但有學者報道[16],腹腔鏡手術后并發癥發生率低于開腹手術,創傷更小。腔鏡組術后并發癥發生率低于開腹組,可能與其手術切口小、創傷小、術后應激反應較輕等因素有關,患者相對而言更容易接受。
筆者總結了本研究中完全腹腔鏡遠端胃癌根治術的經驗,我們體會,在完全腹腔鏡遠端胃癌根治術中處理血管時,可讓主刀與助手的左手持鉗向相反方向牽拉清掃區域,從而形成一定張力,助手右手用胃鉗或吸引器推、擋、牽、拉血管周圍組織,主刀右手可用超聲刀打開系膜層、系膜內疏松組織、血管鞘等,由外到內、由淺入深逐步暴露血管并離斷。我們對血管的處理策略是“小步慢跑”,因為沒有在血管鉗撐開組織并辨認清楚的情況下,用超聲刀小口打開各層組織,可避免大口離斷組織時誤傷其內血管,遵循由外而內、由淺入深的原則,直至暴露并結扎血管。處理血管時由主刀與助手的右手共同完成,兩人的左手用于保持局部區域組織的張力,過程中強調助手的默契配合及對主刀手術意識的充分理解,能做出推、擋、牽、拉等各種配合動作,使主刀在確保安全的情況下快速離斷血管周圍組織,減少出血,保持術野的清晰。同時腔鏡下處理血管時,我們可將血管在屏幕上“立”起來,使其與屏幕水平線垂直,使我們能更好地處理血管。腹腔鏡遠端胃癌根治術D2淋巴結清掃的徹底性是手術療效判斷的關鍵之一,徹底的淋巴結清掃不僅能達到手術根治的效果,而且對術后準確的臨床病理分期、術后綜合治療與預后的精準判斷也大有裨益。要想徹底清掃胃周淋巴結,首先應對胃的重要血管了如指掌。其次,術中如果按照CME原則施術,走在正確的解剖層次內,無需刻意尋找血管或淋巴管,便能將所有的淋巴結暴露在游離面上[17]。清掃淋巴結時,如能從血管根部開始進行完整的區域淋巴脂肪切除、重要血管的全程骨骼化,即代表淋巴結的徹底清掃。因腹腔鏡技術對局部解剖結構的良好顯露,使胃周重要血管的走行及淋巴結的分布更加清晰可見,從而較傳統開腹手術能切除更多的淋巴結,使淋巴結清掃更為徹底。
綜上所述,對于遠端進展期胃癌患者行完全腹腔鏡下遠端胃癌根治術是安全、有效的,可減輕手術創傷,且利于術后康復,安全性較高,易于被患者接受,值得臨床推廣應用。

