基于學科交叉的維生素C 含量測定實驗教學改革
李 欣,趙玉紅,張 鈞,周 浩,李登文,趙立青,石建黨,李小菊,張偉英,張翠竹
(南開大學 生命科學學院 生物國家級實驗教學示范中心,天津 300071)
《國家中長期教育改革和發展規劃綱要(2010—2020 年)》明確提出:優化學科專業、類型、層次結構,促進多學科交叉和融合[1-3]。學科交叉融合不僅可以拓展學生視野,帶來思維的碰撞和啟迪,激發學生的自主學習意識和創新實踐能力,更有助于推動高等院校學科協同發展,完善具有跨學科視野和協同創新意識的復合型人才培養機制[2-4]。
基礎生物化學實驗課程是我校生命科學學院生物實驗教學中心(以下簡稱“中心”)面向本校藥學專業大二年級開設的基礎性實驗必修課。以往的實驗教學內容來源于本院教師多年教學成果,涵蓋了生物化學領域諸多重要基礎理論與實驗技術,知識體系成熟;但與選課學生專業關聯度弱,導致學生學習積極性不高。為此,中心通過開展以跨學科交叉融合為特色的實驗教學體系研究,探索并嘗試了基于學科交叉的實驗教學內容改革,旨在打破生命科學與藥學專業課程之間的壁壘[4-5],讓學生能夠將生物學的理論和方法靈活運用于藥學領域的相關研究中,維生素C 含量測定就是改革內容之一。
1 實驗內容改革
維生素C(Vc)又名抗壞血酸,是維持機體正常活動的重要維生素之一,廣泛參與機體氧化、還原等復雜代謝過程。Vc 是世界衛生組織及聯合國工業發展組織共同確定的人類26 種基本藥物之一,可用于防治壞血病,增加人體免疫力,輔助各種急、慢性傳染性疾病,紫癜以及癌癥等多種疾病的臨床治療[6-7]。但Vc 具有強還原性,在氧化劑、熱、光、堿性物質以及銅、鐵等金屬離子的影響下很容易被氧化分解而失效[8-9]。原實驗教學內容只是在單一條件下對樣品中Vc含量進行測定,并未涉及影響Vc 穩定性諸多因素的考察。而對于藥學專業而言,研究Vc 穩定性影響因素對于相關藥劑配方、貯存條件和藥物配伍都具有重要的實踐指導意義。
要考察Vc 穩定性影響因素,首先要選擇并建立起科學合理的檢測方法。Vc 含量測定方法有很多,如碘量法、2,4-二硝基苯肼法、高效液相色譜法等,但碘量法和 2,4-二硝基苯肼法所用試劑具有一定毒性,而高效液相色譜法成本較高,均不適于受眾面廣的基礎實驗教學[10-11]。原教學內容中采用2,6-二氯靛酚滴定法對Vc 進行定量,但2,6-二氯靛酚試劑不穩定,且滴定終點依靠主觀判斷,對于低年級本科生而言,經常容易因實踐經驗不足而造成較大誤差。因此,改進后的實驗內容采用紫外分光光度法檢測Vc 含量變化,該方法具有準確穩定、快速簡便、試劑安全、成本低廉等諸多優點,且不易受其他還原性物質成分的干擾[12]。
2 主要儀器和試劑
儀器:Nanodrop2000C 超微量分光光度計;水浴鍋;酸度計;電子天平等。
試劑:Vc 標準品(購自北京索萊寶科技有限公司,分析純);碳酸氫鈉、焦亞硫酸鈉、乙二胺四乙酸二鈉、硫酸銅(購自天津市化學試劑供銷公司,分析純);新煮沸后冷卻的蒸餾水等。
3 實驗方法與結果分析
3.1 溶液的配制
3.1.1 2×Vc 標準儲備液(200 mg/L)的配制
準確稱取0.020 g 的Vc 標準品置于小燒杯中,用蒸餾水充分溶解;轉移到100 mL 容量瓶中,定容至刻度,搖勻后等分成2 份,用碳酸氫鈉粉末調節pH,分別配制成pH 6.0 和pH 8.0 的2×Vc 標準儲備液。
3.1.2 Vc 標準系列溶液的配制
用移液器準確移取50、100、200、400、500、600、750 μL 的上述pH 6.0 的2×Vc 標準儲備液,分別置于1.5 mL 棕色離心管中,用蒸餾水補足體積至1 mL,充分混勻,即配制成終質量濃度為10、20、40、80、100、120、150 mg/L 的Vc 標準系列溶液。
3.1.3 影響因子溶液的配制
2×焦亞硫酸鈉溶液:焦亞硫酸鈉質量分數為0.4%的水溶液,碳酸氫鈉粉末調節pH 至6.0。
100×硫酸銅溶液:硫酸銅質量分數為0.1%的水溶液,pH 6.0。
100×乙二胺四乙酸二鈉溶液:乙二胺四乙酸二鈉質量分數為2.5%水溶液,碳酸氫鈉粉末調節pH 至6.0。
3.2 最大吸收波長的選擇
分別將pH 6.0 和pH 8.0 的2×Vc 標準儲備液用蒸餾水等體積稀釋成100 mg/L 的1×工作液,以蒸餾水作為空白參比溶液,使用Nanodrop2000C 超微量分光光度計在190~840 nm 波長范圍內分別對2 種不同pH 的1×Vc 工作液和10%碳酸氫鈉溶液進行光譜掃描,結果見圖1—3。可知2 種不同pH 值下,Vc 的最大吸收波長均為266 nm,碳酸氫鈉在此波長處無吸收。同法檢測影響因子溶液在266 nm 處的紫外吸收,結果見圖4—6,可見影響因子溶液在此波長處同樣無干擾。由此確定紫外分光光度法檢測波長為266 nm。

圖1 pH 6.0 的1×Vc 工作液光譜掃描結果
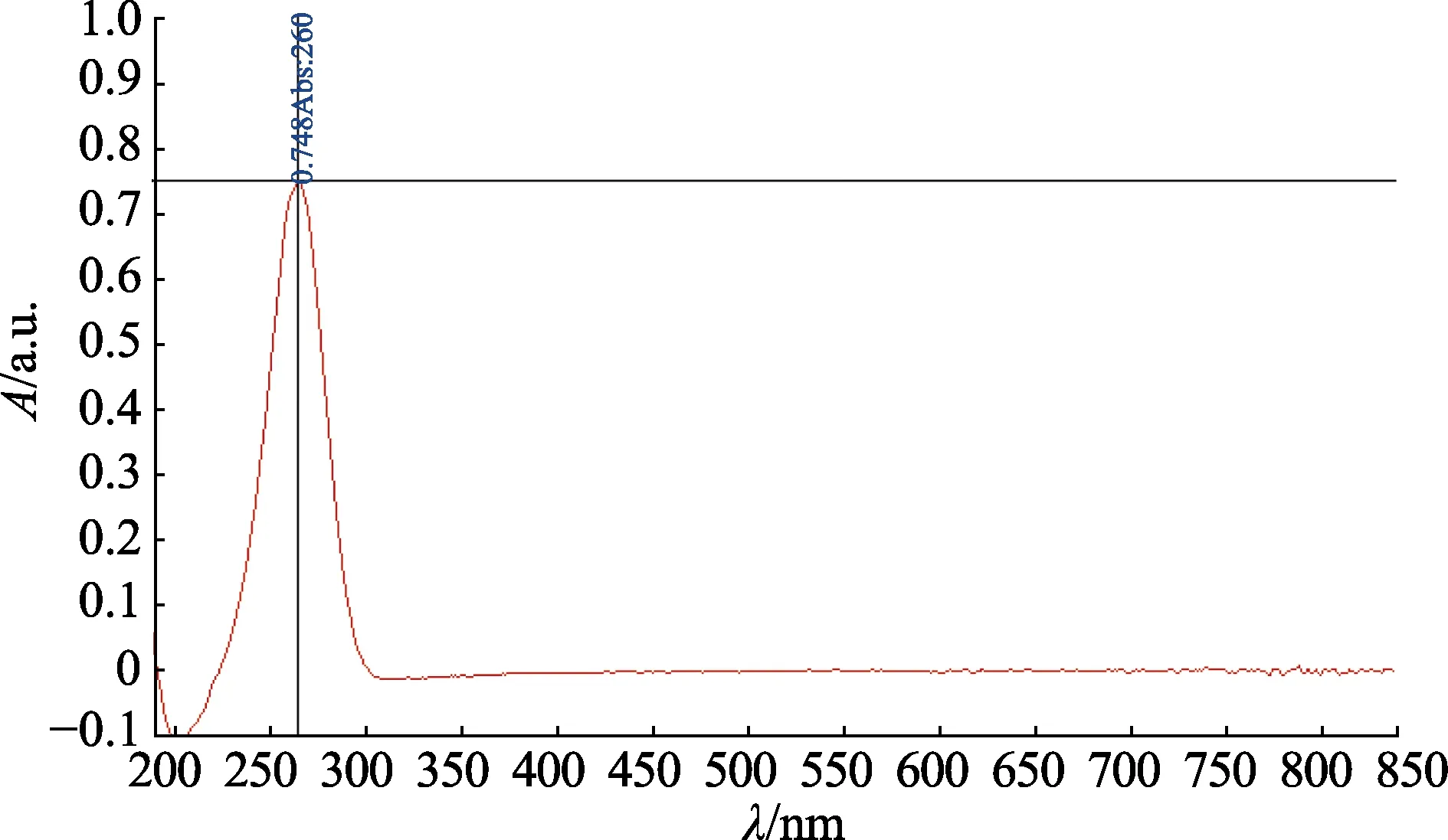
圖2 pH 8.0 的1×Vc 工作液光譜掃描結果
3.3 標準曲線的繪制
用紫外分光光度法在波長266 nm 處,以蒸餾水為空白參比溶液,依次測定Vc 標準系列溶液的吸光度,結果見表1。以Vc 質量濃度為橫坐標,吸光度值為縱坐標繪制標準曲線,見圖 7。回歸方程為:y=0.0072x+0.0097,R2=0.9997,表明 Vc 質量濃度在150 mg/L 以下與吸光度具有良好的線性關系。
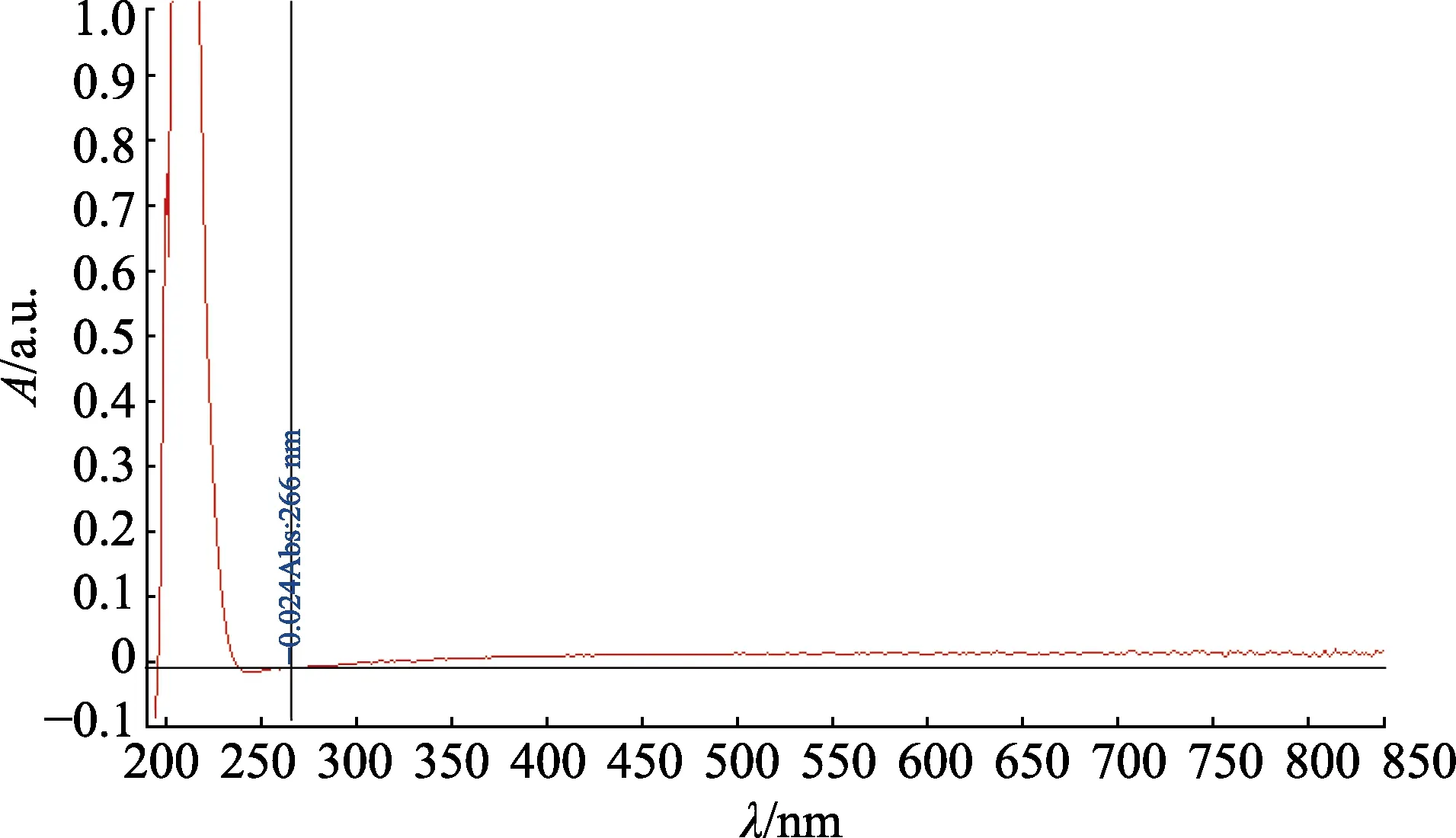
圖3 10%碳酸氫鈉溶液光譜掃描結果

圖4 1×焦亞硫酸鈉溶液光譜掃描結果
圖5 1×硫酸銅溶液光譜掃描結果
圖6 1×乙二胺四乙酸二鈉溶液光譜掃描結果

表1 Vc 標準系列溶液濃度對應的吸光度

圖7 Vc 標準曲線圖
3.4 Vc 穩定性影響因素考察
3.4.1 溫度與作用時間對Vc 穩定性的影響
將pH 6.0 的2×Vc 標準儲備液用蒸餾水等體積稀釋成100 mg/L 的1×工作液,平均分裝于3 個棕色試劑瓶中,分別置于室溫、70 ℃和99 ℃水浴鍋中,在0、15、30、60 min 時間點依次取樣,用紫外分光光度法在266 nm 波長下測定吸光度,代入圖7 中的線性回歸方程,計算Vc 相對含量變化(見表2)。結果表明,隨著溫度的升高,Vc 含量呈現明顯下降趨勢,說明Vc對熱不穩定,高溫會促進Vc 的降解,且降解程度與作用時間呈正相關。
3.4.2 pH 對Vc 穩定性的影響
將pH 6.0 和pH 8.0 的2×Vc 標準儲備液分別用蒸餾水等體積稀釋成100 mg/L 的1×工作液,并裝入棕色試劑瓶,同時置于70 ℃水浴鍋中,在0、15、30、60 min 時間點依次取樣,用紫外分光光度法在266 nm波長下測定吸光度,由線性回歸方程計算Vc 相對含量變化(見表3)。結果表明,在相同溫度和作用時間下,Vc 在偏酸性溶液環境中相對穩定,而在偏堿性條件下更易被破壞。
3.4.3 抗氧化劑對Vc 穩定性的影響
將pH 6.0 和pH 8.0 的2×Vc 標準儲備液各自分別用蒸餾水和 2×焦亞硫酸鈉溶液等體積稀釋成100 mg/L 的1×工作液,并裝入棕色試劑瓶,同時置于99 ℃水浴鍋中,在0、15、30、60 min 時間點依次取樣,用紫外分光光度法在266 nm 波長下測定吸光度,由線性回歸方程計算Vc 相對含量變化(見表4)。結果表明,在相同溫度、作用時間和pH 下,抗氧化劑的加入可以明顯增加Vc 的穩定性。
3.4.4 金屬離子及絡合劑對Vc 穩定性的影響
將pH 6.0 的2×Vc 標準儲備液用蒸餾水等體積稀釋成100 mg/L 的1×工作液,并裝入棕色試劑瓶,按表5 分別加入乙二胺四乙酸二鈉溶液和硫酸銅溶液(硫酸銅溶液最后加),使其終濃度為1×,室溫靜置10 min,用紫外分光光度法在266 nm 波長下測定吸光度,由線性回歸方程計算Vc 相對含量變化(見表5)。結果表明,加入銅離子后Vc 含量顯著下降,而金屬離子絡合劑的加入可以有效保護Vc 免受銅離子破壞。

表2 溫度與作用時間對Vc 穩定性的影響
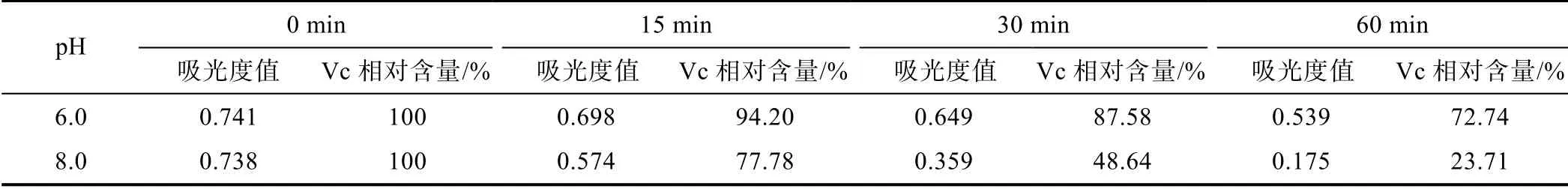
表3 pH 對Vc 穩定性的影響
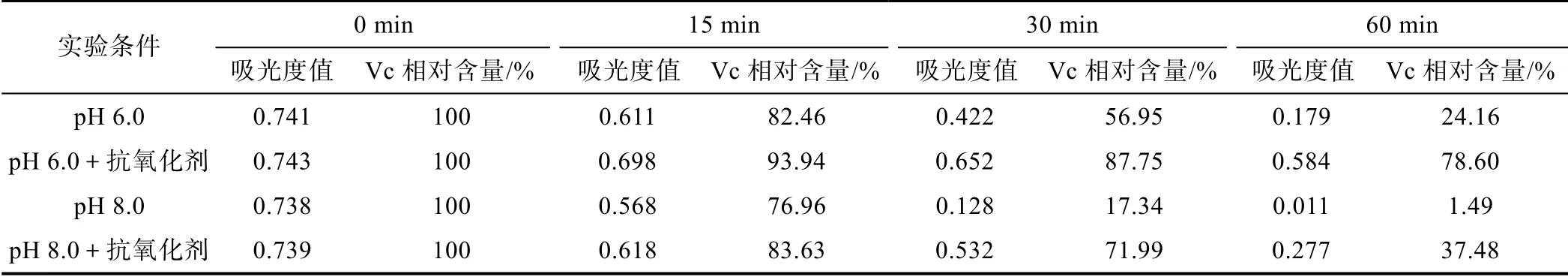
表4 抗氧化劑對Vc 穩定性的影響

表5 金屬離子(銅離子)及絡合劑對Vc 穩定性的影響
4 實驗討論
4.1 實驗體系中pH 的確定
已有文獻報道,不同pH 值下Vc 的最大吸收波長會有所變化:當pH<6.0 時,最大吸收波長紫移;當pH>12.0 時,最大吸收波長紅移;而pH 值在6.0~10.0時,最大吸收波長保持一定,且Vc 在pH 為6.0 時性質較為穩定。本實驗的前期工作發現,100 mg/L 的Vc 水溶液本身pH 在4.5 左右,紫外分光光度法檢測最大吸收波長為247 nm,而用碳酸氫鈉調pH 為6.0和8.0 時,最大吸收波長穩定為266 nm,與文獻報道一致。因此,本實驗選擇pH 6.0 的Vc 溶液作為研究對象,并將相關試劑pH 調至6.0~8.0,以使得后續吸光度測定能夠在恒定波長下進行,操作更加便捷,結果更加準確。
4.2 實驗條件的優化
除了本實驗所考查的影響因素外,Vc 對光和水中溶解氧等因素同樣不穩定,因此,本實驗一方面選用棕色離心管和棕色試劑瓶來裝Vc 溶液,盡量減少光照干擾;另一方面,本實驗涉及溶液均需要現用現配,所用蒸餾水為新煮沸冷卻后的蒸餾水,以盡量減少水中的溶解氧,更嚴格的做法是在水中通入惰性氣體如二氧化碳,這也是Vc 注射液的常用配制方法。除此之外,本實驗測定吸光度用到的是Nanodrop2000C 超微量分光光度計的基座模式,其優點是樣品用量少,操作簡單,只需一個點樣步驟后就能夠在數秒間給出190~840 nm 的全波長掃描圖譜與最大吸收波長下的吸光度值,既節省樣品又節省時間,因此能夠有效避免因操作時間過長而導致Vc 含量變化,大大降低了實驗誤差。
5 教學設計
本實驗面向藥學專業大二年級學生開設,受眾面廣,實驗內容不僅包含多組Vc 穩定性影響因素的考察,還涉及紫外分光光度法的應用以及較多的數據分析,而常規課堂實驗學時有限,無法充分滿足本實驗的教學需求。因此,課程組錄制了相關微課和微視頻,并掛到專門網站上供學生預習,學生可根據預習內容在網站上與教師進行反饋與互動。通過翻轉課堂的教學模式,教師可以在有限的學時里針對關鍵點和學生薄弱環節進行有的放矢的講解,提高了學生自主學習能力和實驗教學效率。值得一提的是,教師會在課后布置相關的開放性思考題供學生討論,如“Vc 注射液配制中,除焦亞硫酸鈉外,還有什么常用的抗氧化劑,請設計一個實驗,考察該成分對Vc 穩定性的影響”,開展課后研討不僅能夠夯實學生的課堂所學,激發學生的學習興趣,更有利于充分建立課堂知識與學生專業之間的關聯,進一步體現學科之間的交叉性,提高學生理論聯系實踐的能力[13-14]。
6 結語
Vc 是常見的基礎藥物之一,廣泛用于治療和預防多種疾病,其含量穩定性會直接影響到臨床應用。因此,考察影響Vc 穩定性的因素對于藥學專業中藥物制備、貯存和配伍顯得尤為重要。Vc 含量測定是我校生命科學學院面向藥學專業開設的常規實驗教學項目之一,為突出生物學基礎理論與實驗方法在藥學中的應用,增強生命科學與藥學的關聯性與交叉性,課程組對原先單一條件下對樣品進行定量的實驗教學內容進行改革,通過建立準確、便捷、安全的紫外分光光度法,對溫度、作用時間、pH、抗氧化劑、金屬離子和絡合劑等因素導致的Vc 含量變化進行了檢測。改革后的實驗內容與藥學專業領域的研究內容更加契合,對于打破學科知識界限,促進2 個學科知識技能的深度融合,進一步培養學生綜合素質與協同創新能力具有積極作用[15]。

