人ACE2蛋白結構和功能的生物信息學分析
段瑞芳,武翠玲,王牛牛,任晨霞
血管緊張素轉化酶2(Angiotensin I converting enzyme 2, ACE2),該基因編碼的蛋白質屬于二肽基羧二肽酶的血管緊張素轉化酶家族[1],被證明是嚴重急性呼吸綜合征病毒(Sever acute respiratory syndrome coronavirus, SARS-CoV)的功能性受體[2-3],最近又被證明是新型冠狀病毒(severe acute respiratory syndrome coronavirus 2, SARS-CoV-2)受體[4]。研究表明ACE2極大地促進了SARS-CoV復制的效率,SARS-CoV S蛋白介導細胞間融合的能力取決于ACE2蛋白的存在[2]。人、小鼠和大鼠對SARS-CoV病毒的感染效率與各物種的ACE2支持病毒復制的能力相關[5-7],阻斷ACE2結合SARS-CoV S蛋白的抗體可保護小鼠免受SARS-CoV病毒感染[8]。自2002年SARS-CoV暴發以來,廣泛的結構分析揭示了SARS-CoV穗蛋白受體結合域(Receptor-binding domain, RBD)與宿主受體ACE2之間的相互作用,該相互作用調節了SARS-CoV的物種和人類之間的傳播。目前已有研究發現,SARS-CoV-2的 RBD序列(包括直接接觸ACE2的受體結合基序(Receptor-binding motif, RBM)與SARS-CoV的序列相似,SARS-CoV-2 RBM中的幾個關鍵殘基與人ACE2有良好的相互作用,雖然SARS-CoV-2 RBM中的其他幾個關鍵殘基與ACE2結合不理想,但這些證件仍表明ACE2為致使人類細胞感染SARS-CoV-2病毒的受體[9]。此外,石正麗課題組的研究報道,確認新型冠狀病毒SARS-CoV-2進入細胞的方式與SARS-CoV病毒一致,都是通過ACE2受體介導。他們對不同物種中ACE2是否為介導SARS-CoV-2病毒進入細胞的受體進行研究發現,除小鼠外,SARS-CoV-2病毒可進入人類、中華菊頭蝠、果子貍和豬等物種表達ACE2的HeLa細胞,但SARS-CoV-2病毒不能進入未表達ACE2的HeLa細胞中[4]。對72個人體組織的實時定量PCR分析表明,ACE2 mRNA在支氣管和肺實質以及心臟,腎臟和胃腸道中高效表達[10]。這也與新型冠狀病毒SARS-CoV-2引起呼吸系統、消化道反應為主的癥狀高度吻合。基于這些研究,對ACE2基因和蛋白進行結構和功能進行生物信息學分析具有重要意義,以期為此次新型冠狀病毒SARS-CoV-2的作用機制及治療提供一定的理論支持。
1 材料與方法
1.1材料 ACE2的氨基酸序列由NCBI數據庫中GenBank中下載,檢索號為NP_001358344.1。
1.2方法 運用Promoter Scan軟件對ACE2基因的啟動子與相關轉錄因子進行預測;分別使用SMOPA、Swiss-Model數據庫對ACE2蛋白的二級結構、三級結構進行預測;通過SignalP5.0軟件預測出ACE2蛋白信號肽區域;用TMHMM對其跨膜結構進行預測;ACE2蛋白的理化性質與親疏水性分別用ProtParam、ProtScale進行分析;利用NetNGlyc1.0Server和NetOGlyc4.0Server軟件對ACE2蛋白的N-糖基化和O-糖基化位點進行在線分析;經過Netphos3.1aServer分析出ACE2蛋白的磷酸化位點;此外,ACE2蛋白的相關作用蛋白也通過String在線服務器做了預測,并對ACE2的互作蛋白進行GO和KEGG功能富集分析,分析結果利用Image GP作圖展示。
2 結 果
2.1ACE2蛋白二級結構預測 獲得ACE2蛋白序列后,在SMOPA數據庫中對ACE2蛋白質的二級結構進行預測。圖1顯示為預測結果,其中α螺旋占比超過一半以上達51.18%,α螺旋有利于蛋白質結構的穩定,因此ACE2蛋白二級結構中如此高的α螺旋結構暗示此蛋白構象穩定。無規則卷曲常位于蛋白質的特異性功能部位,常出現在蛋白質表面,無規卷曲在該蛋白二級結構中占比達33.42%,符合ACE2蛋白作為受體蛋白的性質。其次,延伸結構和β轉角分別占比11.18%和4.22%。

圖1 ACE2蛋白二級結構預測Fig.1 Prediction of secondary structure of ACE2 protein
2.2ACE2蛋白三級結構預測 三級結構預測通過Swiss-Model 數據庫進行,首先將目的蛋白在數據庫中已有的蛋白進行序列比對后,選擇相似度高或同源蛋白質進行自動化比對建模,從而預測未知蛋白質的三級結構,ACE2蛋白三級結構預測的結果如圖2所示。

圖2 ACE2蛋白三級結構預測及其同源蛋白相似性波形圖Fig.2 Prediction of secondary structure of ACE2 protein and homologous protein similarity waveform
2.3ACE2蛋白信號肽序列 SignalP5.0軟件用于ACE2蛋白信號肽序列分析,輸入ACE2氨基酸序列N端前70個氨基酸,通過預測這段氨基酸序列中是否存在潛在酶切位點,從而預測蛋白是否存在信號肽。如圖3所示,ACE2存在信號肽,切割位點位于第19-20位氨基酸殘基之間。
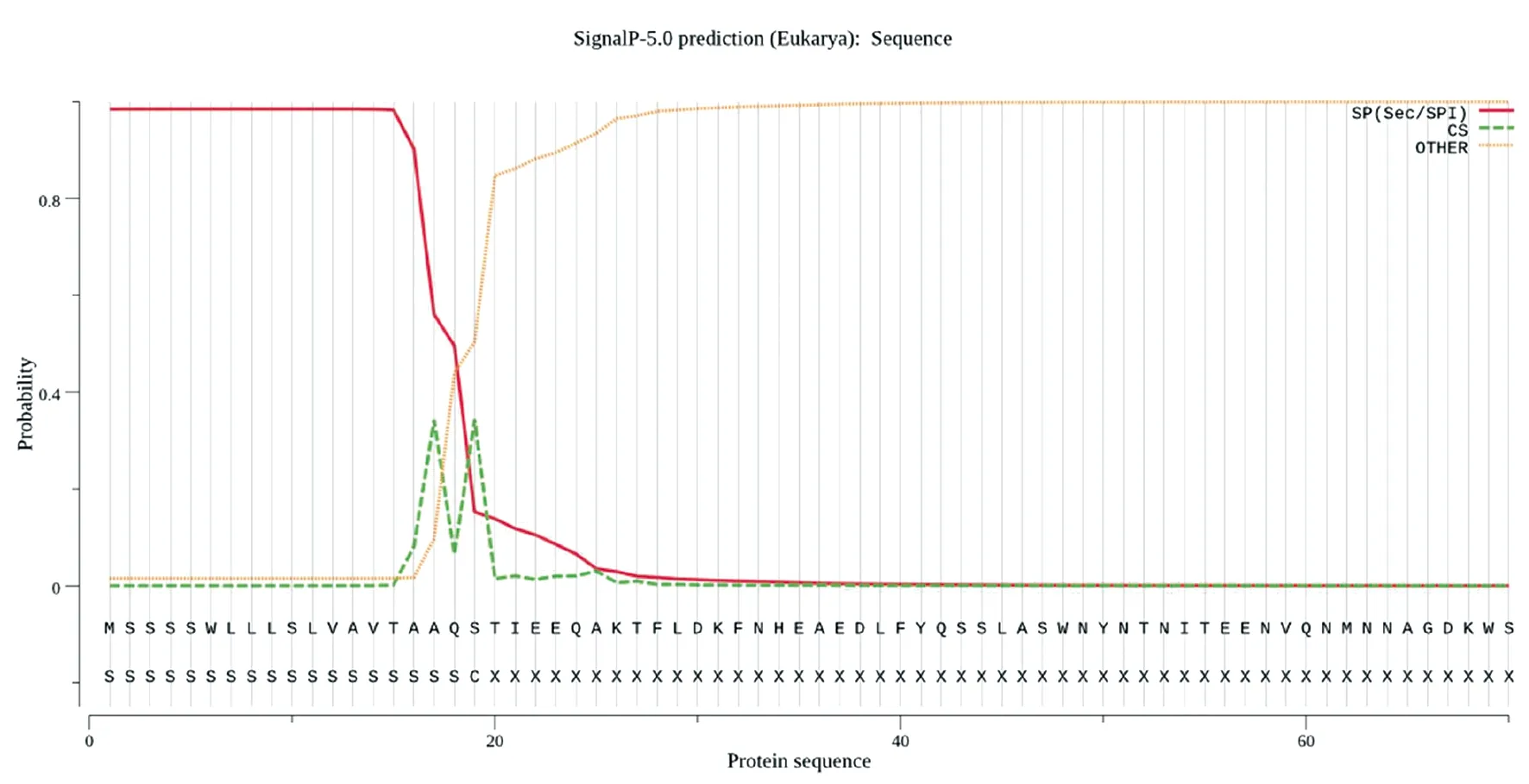
圖3 ACE2 蛋白信號肽分析Fig.3 Signal peptide analysis of ACE2 protein
2.4ACE2蛋白跨膜結構分析 TMHMM軟件被用于ACE2蛋白的跨膜結構信息預測,結果見圖4。預測結果顯示,ACE2氨基酸序列中1-740位氨基酸位于細胞膜外,跨膜區位741-761位氨基酸序列,764-805位氨基酸位于細胞內。ACE2蛋白的氨基酸有90%以上位于細胞膜外,此結果與ACE2蛋白成為SARA-Cov和SARS-CoV-2病毒受體的研究結果高度匹配。
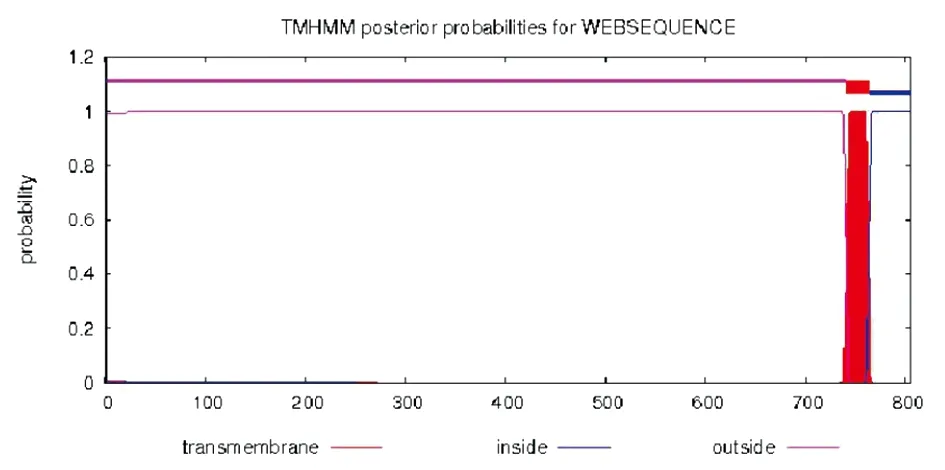
圖4 ACE2蛋白跨膜區的預測Fig.4 Prediction of transmembrane region of ACE2 protein
2.5ACE2蛋白的理化性質 使用ProtParam軟件對ACE2蛋白的理化性質進行預測。ACE2蛋白由805個氨基酸序列組成,蛋白分子量為92 463.04,總分子式為C4170H6358N1092O1222S35,總原子數為12 877,其中帶正電荷的氨基酸殘基Arg(arginine)和Lys(lysine)占 9.7%(78/805);帶負電荷的氨基酸殘基 Asp(asparticacid)和Glu(glutamicacid)占 12.3%(99/805)。軟件分析顯示ACE2蛋白等電點PI=5.36,意味著ACE2蛋白偏酸性。此外,預測結果還顯示ACE2蛋白為不穩定蛋白,其預測不穩定指標為40.09。其脂肪系數為80.55,平均親水性系數-0.375。ACE2蛋白質的親疏水性通過ProtScale軟件分析,結果見圖5。其最大的疏水性分值為3.778,親水性的最大值為-3.311。如圖5所示,ACE2蛋白親水性氨基酸多于疏水性氨基酸,結合其親水性系數,推測ACE2蛋白為親水性蛋白。

圖5 ACE2 蛋白親疏水性分析Fig.5 Analysis of hydrophilicity and hydrophobicity of ACE2 protein
2.6ACE2蛋白翻譯后修飾 蛋白質翻譯后修飾使得蛋白具有特定功能,對于真核細胞的生命活動具有重要意義。常見的蛋白質翻譯后修飾包括有泛素化、磷酸化、糖基化、甲基化、乙酰化、酯基化等。在此,我們對ACE2蛋白糖基化與磷酸化位點進行分析,結果見圖6、7。分析結果顯示,ACE2蛋白N-糖基化位點有6個,分別位于第53、90、103、322、432、690位氨基酸(圖6)。

圖6 ACE2 蛋白N-糖基化分析Fig.6 ACE2 protein N-glycosylation analysis

圖7 ACE2 蛋白磷酸化的分析Fig.7 Analysis of phosphorylation of ACE2 protein
如圖7所示,ACE2蛋白磷酸化位點有77個,分別為第2、3、4、10、19、43、44、47、70、105、106、109、113、128、129、155、167、218、254、257、317、409、420、425、545、547、563、602、617、623、626、646、680、707、709、721、776、787、804位的絲氨酸(serine)位點;第20、52、92、118、125、129、229、276、282、324、414、434、445、496、517、519、548、593、686、698、763、803位的蘇氨酸(threonine)位點;以及第41、196、199、202、207、217、237、252、255、497、510、515、613、633、641、649、781位的酪氨酸(tyrosine)位點。
2.7ACE2相互作用網絡 利用STRING構建蛋白相互作用網絡,發現與ACE2相互作用的蛋白有很多,圖8中展示出其中聯系密切的30個,分別是 I型血管緊張素受體(Type-1 angiotensin II receptor I, AGTR1);II型血管緊張素受體(Type-2 angiotensin II receptor II, AGTR2);血管緊張素原(Angiotensinogen, AGT);血管緊張素轉換酶(Angiotensin-converting enzyme, ACE);腎素(Renin, REN);內皮素1(Endothelin 1, EDN1);內皮素2(Endothelin 2, EDN2);X-脯氨酰氨肽酶2(X-prolyl aminopeptidase 2, XPNPEP2);脯氨酰羧肽酶(ProlylCarboxypeptidase, PRCP);膜金屬內肽酶(Membrane metalloendopeptidase, MME);激肽原1(Kininogen 1, KNG1);激肽釋放酶B1(Kallikrein B1, KLKB1);谷氨酰胺基肽酶(Glutamyl aminopeptidase, ENPEP);ATPase H+轉運輔助蛋白2(ATPase H+ transporting accessory protein 2, ATP6AP2);胰酶1(Chymase 1, CMA1); 阿佩林(Apelin, APLN);凝血因子II(Coagulation factor II, F2);甲基多巴α亞基(Meprin A subunit alpha, MEP1A);甲基多巴β亞基(Meprin A subunit beta, MEP1B);G蛋白亞基alpha q(G protein subunit alpha q, GNAQ);G蛋白耦聯受體激酶2(G protein-coupled receptor kinase 2, ADRBK1);G蛋白耦聯受體激酶5(G protein-coupled receptor kinase5, GRK5);β抑制蛋白1(Arrestin beta 1, ARRB1);β抑制蛋白2(Arrestin beta 2, ARRB2);胃抑制多肽(Gastric inhibitory polypeptide, GIP);胰高血糖素(Glucagon, GCG);二肽基肽酶4(Dipeptidyl peptidase 4, DPP4);組織蛋白酶G(Cathepsin G, CTSG);表皮生長因子受體(Epidermal growth factor receptor, EGFR);絲裂原激活的蛋白激酶3(Mitogen-activated protein kinase 3, MAPK3)。

圖8 ACE2 蛋白相互作用的預測Fig.8 Prediction of ACE2 protein interaction
2.8ACE2相互作用蛋白功能富集 將STRING的GO和KEGG功能富集結果可視化,如圖9所示顯著富集到的ACE2相互作用蛋白的生物學過程包括全身動脈血壓的激素調節過程(regulation of systemic arterial blood pressure by hormone)、全身動脈血壓的調節(regulation of systemic arterial blood pressure)、腎素-血管緊張素對全身動脈血壓的調節(regulation of systemic arterial blood pressure by renin-angiotensin)、血液循環(blood circulation)、激素水平調節(regulation of hormone levels)等。顯著富集到的ACE2相互作用蛋白主要位于細胞外空間(extracellular space)、細胞質膜(plasma membrane)、囊泡(cytoplasmic vesicle)、胞質囊泡(vesicle)、質膜部分(plasma membrane part)、分泌顆粒(secretory granule)等。顯著富集到的ACE2相互作用蛋白的分子功能包括G蛋白耦聯受體的結合(G protein-coupled receptor binding)、信號受體結合(signaling receptor binding)、肽鏈內切酶活性(endopeptidase activity)、肽酶活性(peptidase activity)、催化活性(catalytic activity)、金屬肽酶活性(metallopeptidase activity)等。顯著富集到的ACE2相互作用蛋白的信號通路包括腎素-血管緊張素系統(Renin-angiotensin system)、蛋白質消化吸收(Protein digestion and absorption)、腎素分泌(Renin secretion)、松弛素信號通路(Relaxin signaling pathway)、趨化因子信號通路(Chemokine signaling pathway)、內吞作用(Endocytosis)、以及心肌細胞的腎上腺素能信號(Adrenergic signaling in cardiomyocytes)等。

圖9 ACE2 相互作用蛋白功能富集Fig.9 Function of ACE2 interacting proteins
3 討 論
目前研究已發現的ACE2蛋白功能主要包括2個方面,其一ACE2被證明是冠狀病毒SARS-CoV、SARS-CoV-2、HCoV-NL63(human coronavirus NL63)的受體,是上述3種病毒入侵細胞的必要條件[2,4,11],其二在腎素-血管緊張素系統(Renin-angiotensin system, RAS)中發揮重要作用。本研究通過各種生物信息學軟件對ACE2蛋白的詳細生物信息學信息進行了分析。結果顯示ACE2蛋白為含有信號肽的跨膜蛋白,該蛋白90%以上的結構位于細胞膜外,已有研究表明 SARS-CoV-2 與 ACE2 結合的位置位于胞外段頂端[12],分析結果與其作為細胞外病毒受體的生物學功能相吻合。結構學研究揭示了, SARS-CoV及SARS-CoV-2通過病毒受體結合結構域與ACE2的細胞外催化結構域互動結合,這種互動能夠導致細胞內吞、膜融合從而使得SARS-CoV進入宿主細胞[12-13]。而本研究中對ACE2蛋白功能富集分析也發現與ACE2相互作用蛋白主要分布在細胞外、細胞質膜以及囊泡等區域,并且與介導內吞作用的信號通路相關。
對ACE2相互作用蛋白的分析發現,ACE2與多個蛋白發生相互作用,我們在圖8中展示了30個。其中有19個蛋白與RAS調節相關,包括ACE、AGT、REN等[14-17];這與ACE2功能富集分析結果吻合,即人ACE2蛋白主要通過參與腎素-血管緊張素系統、腎素分泌、松弛素信號通路、心肌細胞的腎上腺素等信號通路,在全身動脈血壓調節、血液循環以及體液調節的生物學過程中發揮作用。其次,相互作用蛋白中有5個與G蛋白耦聯受體結合相關,包括GNAQ、GRK5、ADPBK1、ARRB1、ARRB2,而RAS系統調節也被證明與G蛋白耦聯受體信號通路相關[18-20]。RAS是機體重要的體液調節系統,血管緊張素轉化酶(angiotensin converting enzyme,ACE)作用于 血 管 緊 張 素 I(angiotensin I,Ang I),產生血管緊張素 II (Ang II),進一步激活 G 蛋白耦聯受體,從而促血管收縮、促炎、促進細胞凋亡等。ACE2與 ACE屬同工酶。ACE2可水解 AngⅡ,產生 Ang(1-7),起到舒張血管、抗心肌肥大、抗炎、抗纖維化、改善心肌重構等保護性作用。正常人體中 ACE2/ACE處于動態平衡,調節機體生理功能[21]。周元琳等[21]研究提到,在SARS-CoV侵染小鼠細胞后,ACE2蛋白水平顯著降低,Ang II大量堆積,從而使RAS系統穩態失衡。Imai等[22]發現,在肺組織中,Ang II高表達會增加血管通透性,導致肺水腫肺炎、心肌炎、急性呼吸窘迫綜合征等各種疾病。基于SARS-CoV與SARS-CoV-2基因序列、進入細胞的方式及其感染癥狀的相似性,并且SARS-CoV-2與ACE2結合的親和力為SARS-CoV的10~20倍[12],推測SARS-CoV-2與大量ACE2結合,使得ACE2蛋白水平急劇減少,進而產生一系列肺部損傷癥狀。值得注意的是,ACE2蛋白具有豐富的糖基化位點和磷酸化位點,糖基化對其與病毒結合是至關重要的[23],此外與ACE2蛋白相互作用蛋白多為蛋白酶類,推測其可能通過在不同的氨基酸位點發生磷酸化,從而與多種酶蛋白相互作用發揮其生物學功能。
由于ACE2蛋白在介導SARS-CoV-2感染宿主細胞過程中發揮必不可少的作用,并且ACE2蛋白水平的變化對肺部組織損傷有顯著影響,ACE2已成為SARS-CoV-2感染的治療靶點。Liu等人經過研究分析后建議將基于ACE2的肽作為治療SARS-CoV-2病毒感染的潛在藥物靶點[24]。選擇性破壞SARS-CoV-2與 ACE2 的結合也是一種選擇[25]。并且Wan等[9]的研究發現,SARS-CoV-2可從多種物種(除了大鼠和小鼠)中識別ACE2,他們認為提出可以從受體ACE2入手,研究SARS-CoV-2的中間宿主。因此對于ACE2蛋白作為病毒受體的功能和機制研究是極有價值的。本研究對ACE2蛋白結構和功能進行生物信息學分析,希望能為SARS-CoV-2病毒的攻克提供一些理論基礎。
利益沖突:無

