魔芋葡甘露低聚糖的熱穩定特性以及與低聚果糖益生元的對比分析
葉 楓,湯宏赤,張劍堡,和竹新,和正鵬,范銳鴻,林麗華,郭 媛,劉江麗,龐 浩,,*
(1.廣西大學生命科學與技術學院,廣西 南寧 530004;2.廣西科學院 國家非糧生物質能源工程技術研究中心,非糧生物質酶解國家重點實驗室,廣西生物煉制重點實驗室,廣西 南寧 530007;3.麗江大然生物有限公司,云南 麗江 674100)
低聚糖是低分子質量的碳水化合物,又稱寡糖,一般是由10 個以內的單糖以糖苷鍵連接成直鏈或支鏈的聚合物,介于單糖與多糖之間,按照生理特性又可分為普通低聚糖和功能性低聚糖[1-2]。國內外研究中,一些功能性低聚糖在促進益生菌生長、增強免疫、改善腸道疾病等方面有突出作用[3-5],這些功能性低聚糖被歸類為益生元。Gibson等[6-7]在1995年首次提出益生元的概念并在2004年對其定義進行更新,益生元指一些不被宿主消化吸收,卻能夠選擇性地促進體內有益菌的代謝和增殖,從而改善宿主健康的有機物。
近年來,益生元在醫藥、飼料、食品等領域的應用成為國內外的研究熱點。在醫藥領域,益生元對于治療胃腸道疾病和過敏反應具有突出作用[8-9]。在飼料中添加益生元,能夠有效促進動物腸道有益菌的增殖、提高內源消化酶活性、保護動物肝臟、調節脂類代謝以及降低膽固醇和血脂等[10-11],Markowiak等[12]報道將益生元應用于動物養殖中,能夠提高動物免疫狀況以及改善肉類、牛奶和雞蛋的品質。益生元在食品領域中的應用最為廣泛,可應用于面包、餅干、嬰兒奶粉、發酵牛奶和乳制品等產品中[13-14]。Alizadeh等[15]研究表明在嬰兒奶粉配方中添加了低聚半乳糖,通過刺激機體免疫,增加唾液和結腸中免疫球蛋白A(immunoglobulin A,IgA)的分泌量,同時促進腸道菌群生長以及調節腸道平衡;Longoria-García等[16]將益生元作為反式脂肪的替代物應用于烘焙食品中,避免反式脂肪的不良影響,使產品質構和口感良好且具有健康腸道的功能作用。
低聚糖作為功能成分添加到藥物、飼料、食品等中,其熱力學穩定性和分解特性成為藥物、食品等加工工藝設計的一個關注點[17-18]。目前,國內外研究學者對于低聚糖類化合物的相關研究主要集中在對糖的分離純化、結構解析、合成和生物活性功能等方面[19-20],對于低聚糖的熱分解和熱穩定性研究較少。特別是對于新型的益生元,如魔芋葡甘露低聚糖等缺乏相關熱穩定性的分析數據。來自魔芋的葡甘露低聚糖是一種新型的益生元,是由D-甘露糖以β-1,4-糖苷鍵連接形成主鏈以及主鏈或支鏈上以β-1,3-糖苷鍵連接葡萄糖而成的水溶性多糖,主要由魔芋塊莖中葡甘聚糖降解得到,已成為國內外市場上新型的益生元[21-22]。為探究葡甘露低聚糖和低聚果糖熱穩定性的影響,本實驗以這兩種益生元為材料,采用Kissinger、Kissinger-Akahira-Sunose(KAS)和Flynn-Wall-Ozawa(FWO)3 種動力學分析方法對兩種益生元熱解后的穩定性進行分析,以便于后續研究工作中深入分析低聚糖化合物的結構和性質,同時也為葡甘露低聚糖和低聚果糖在藥物和食品工業領域進行配方設計和加工工藝設計提供依據。
1 材料與方法
1.1 材料與試劑
葡甘露低聚糖(聚合度2~6,純度99%) 麗江大然生物有限公司;低聚果糖(聚合度2~5,純度99%)山東保齡寶生物股份有限公司;葡萄糖(分析純)國藥集團化學試劑(上海)有限公司;D-果糖、D-甘露糖(純度99%) 上海源葉生物科技有限公司;乙腈賽默飛世爾(上海)科技有限公司。
1.2 儀器與設備
TGA Q50熱重分析儀 美國TA儀器公司;高效液相色譜(high performance liquid chromatography,HPLC)系統 沃特世科技(上海)有限公司。
1.3 方法
1.3.1 低聚糖含量HPLC分析
1.3.1.1 色譜條件
色譜柱:ZORBAX NH2色譜柱(4.6 mm×250 mm,5 μm);流動相為體積分數80%乙腈,流動速率為1 mL/min,柱溫為25 ℃,進樣量20 μL。
1.3.1.2 HPLC分析
分別以超純水為溶劑配制質量分數為2%的葡萄糖、D-果糖、D-甘露糖溶液,用超純水配制質量分數40%葡甘露低聚糖溶液和10%低聚果糖溶液,所有試劑通過0.22 μm的濾膜過濾,用單糖進行標樣,定量分析多糖中單糖的質量分數,每個樣品做兩次平行。
1.3.2 低聚糖熱穩定性測定
對TGA Q50進行溫度和質量校準。所有樣品在實驗之前進行烘干處理,稱取適量(不高于11 mg)樣品放入帶有吊籃的Al2O3坩堝中。溫度30~600 ℃,升溫速率為5、10、15、20 ℃/min,使用高純氮氣作為保護氣,氣流速率為50 mL/min,每個樣品做兩次平行。
1.3.3 低聚糖熱分解動力學分析
固體一步熱解過程可以表示為:低分子聚糖→碳+揮發性氣體。從低分子聚糖到揮發性氣體的熱力學參數依據Arrhenius定律按公式(1)[23]計算。通常無模式函數法采用非等溫線性升溫速率β,按公式(2)計算。由公式(1)、(2)得到公式(3)。
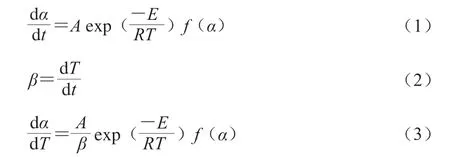
式 中:α為 轉 化 率;A為 指 前 因 子/s-1;β為 升溫速率;E為活化能/(k J/m o l);R為氣體常數8.314 J/(K·mol);T為溫度/℃;t為時間/min。
轉化率α又可以按公式(4)表示。

式中:m0為樣品初始質量/g;mt為任意t時刻樣品質量/g;mf為樣品最終質量/g。
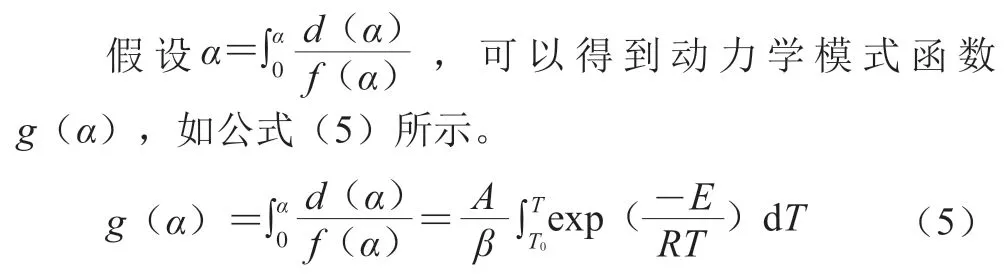
采用非等溫無模式函數法[23-24],分別用Kissinger法、KAS法和FWO法對葡甘露低聚糖和低聚果糖熱解過程進行非等溫動力學分析。分別按公式(6)、(7)、(8)計算。
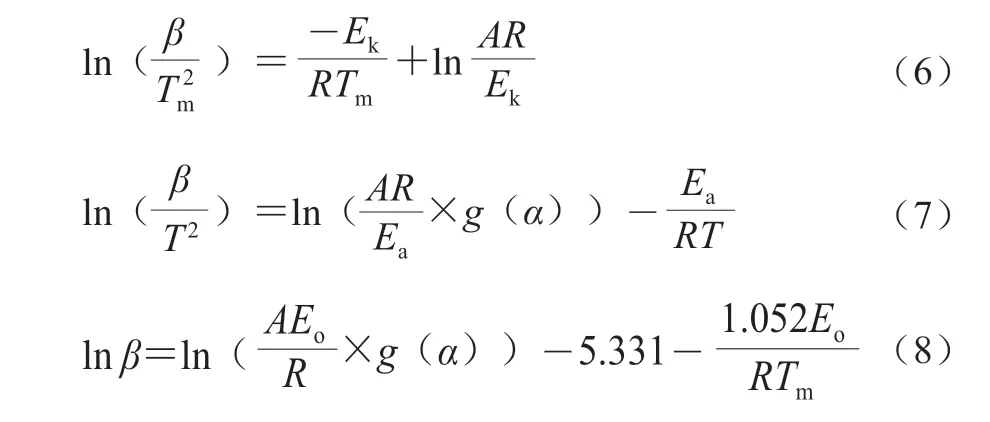
式中:Tm為微商熱重( differential thermogravimetry,DTG)曲線峰溫;Ek、Ea和Eo分別為對應分析方法所得的活化能。
在Kissinger法中,由于非等溫過程改變加熱速率,DTG曲線峰溫隨之改變,以ln(β/Tm2)對1/Tm作圖進行擬合性分析,得到直線斜率后對應-Ek/R可以計算出活化能Ek,由截距可求得指前因子A;在KAS法中,由于-與β/T2無直接聯系,而Ea是等轉化率α所對應的表觀活化能,以ln(β/T2)對1/T作圖進行擬合性分析,得到直線斜率后對應-Ea/R可以計算出活化能Ea;在FWO方法中,固定轉化率α所對應的的表觀活化能,以lnβ對1/Tm作圖擬合性分析,得到直線斜率后對應-1.052Eo/R可以計算出活化能Eo。
1.3.4 低聚糖熱解機理的判定
由公式(8)得到公式(9)。
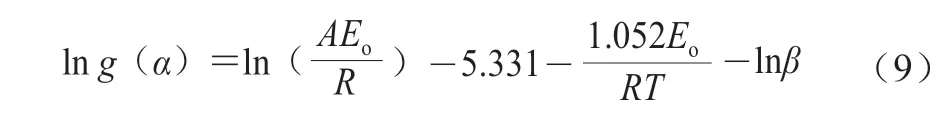
根據楊鵬等[25]的方法采用同一溫度所對應的轉化率α與不同升溫速率,通過化合物熱分解最常用的30 種最概然機理函數的積分形式G(α),以lng(α)對lnβ作圖,用最小乘二法進行線性擬合獲取線性較好且斜率接近-1所對應的機理函數,即為該反應的最概然機理函數,并將其帶入公式(10)得到指前因子A。

1.3.5 熱解過程動力學參數計算
根據Lei Zhihui等[26]的方法,用KAS法求得Ea和lnA后,熱力學參數焓變(ΔH)、吉布斯自由能(ΔG)和熵變(ΔS)分別由公式(11)~(13)計算。
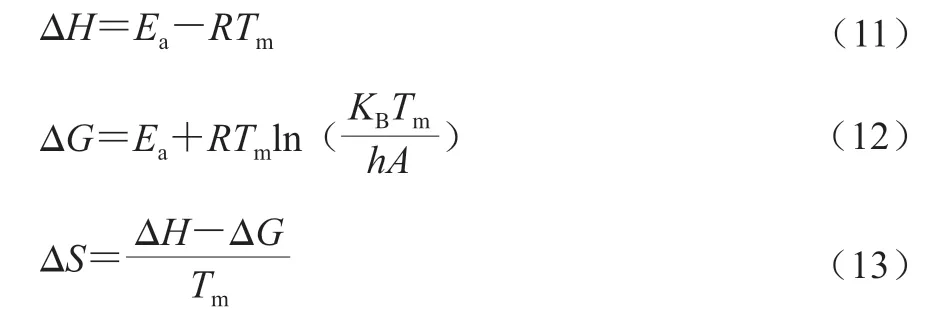
式中:KB為波爾茲曼常數(1.381×10-23J/K);h為普朗克常數(6.626×10-34J·s)。
1.4 數據處理與分析
采用TA Universal Analysis軟件對數據進行處理與分析,利用Origin 9.0軟件處理數據并作圖。
2 結果與分析
2.1 低聚糖HPLC分析結果
由圖1A可知,用質量分數為2%的D-果糖、D-甘露糖和葡萄糖作為標準樣品,出峰時間分別在8.47、8.89 min和9.65 min左右,圖1B中質量分數為10%低聚果糖和圖1C中質量分數為40%葡甘露低聚糖,與圖1A中質量分數為1%單糖的峰面積對比分析,結果表明兩種低聚糖中單糖質量分數均低于1%。
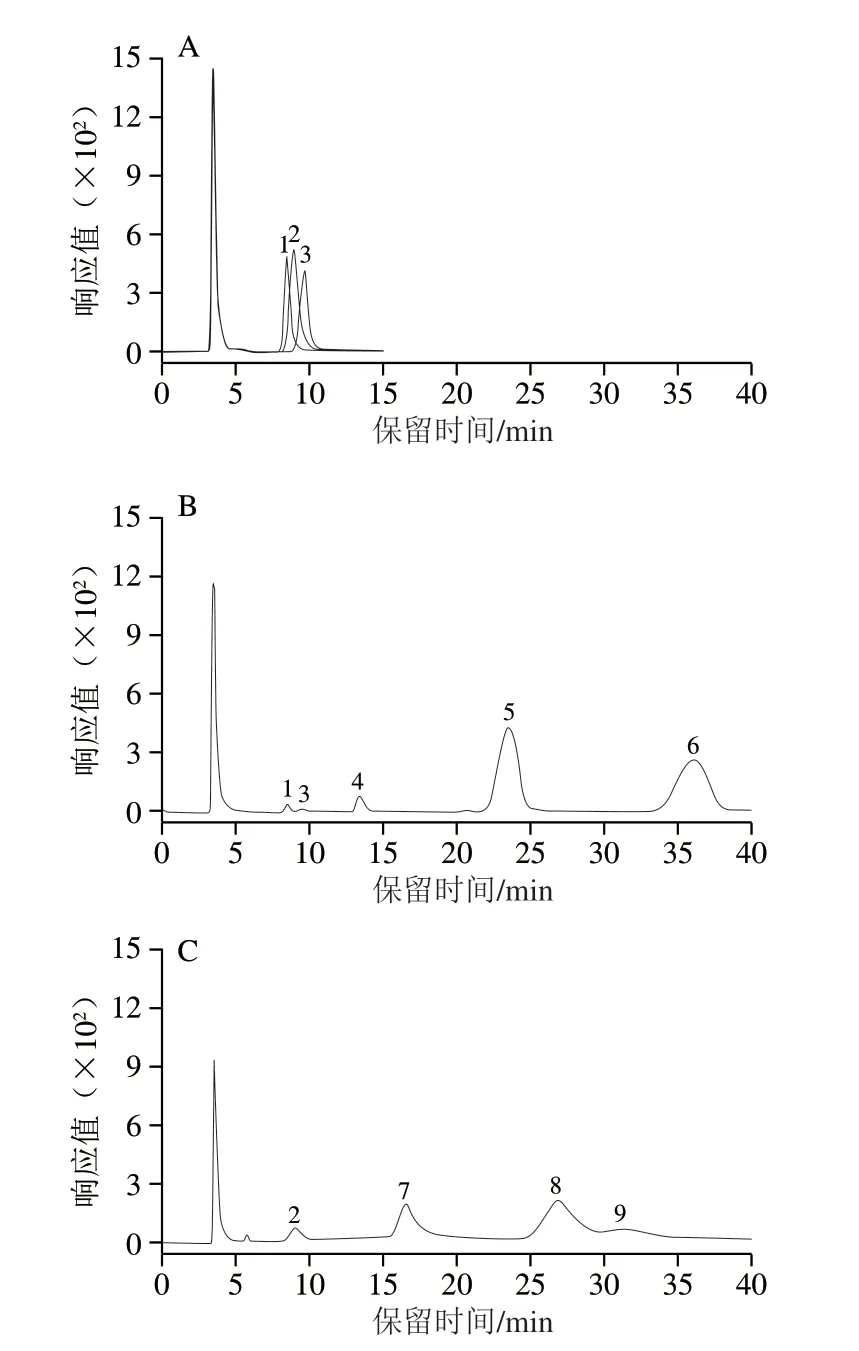
圖 1 單糖與低聚糖高效液相色譜圖Fig. 1 High performance liquid chromatography analysis of monosaccharide and oligosaccharide standards
2.2 低聚糖熱重分析結果
根據程澤[27]和陳穎欽[28]等對單糖熱分解研究,由圖2A、B中DTG曲線可知,單糖的分解峰溫比低聚糖的分解峰溫低,說明單糖比低聚糖更易分解。鑒于單糖相關研究的基礎,本實驗主要突出比較兩種低聚糖的熱分解穩定性。
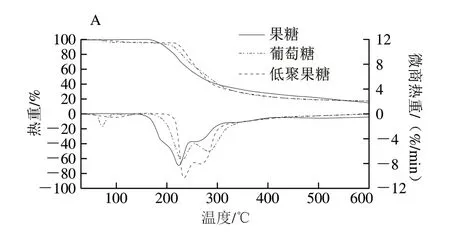
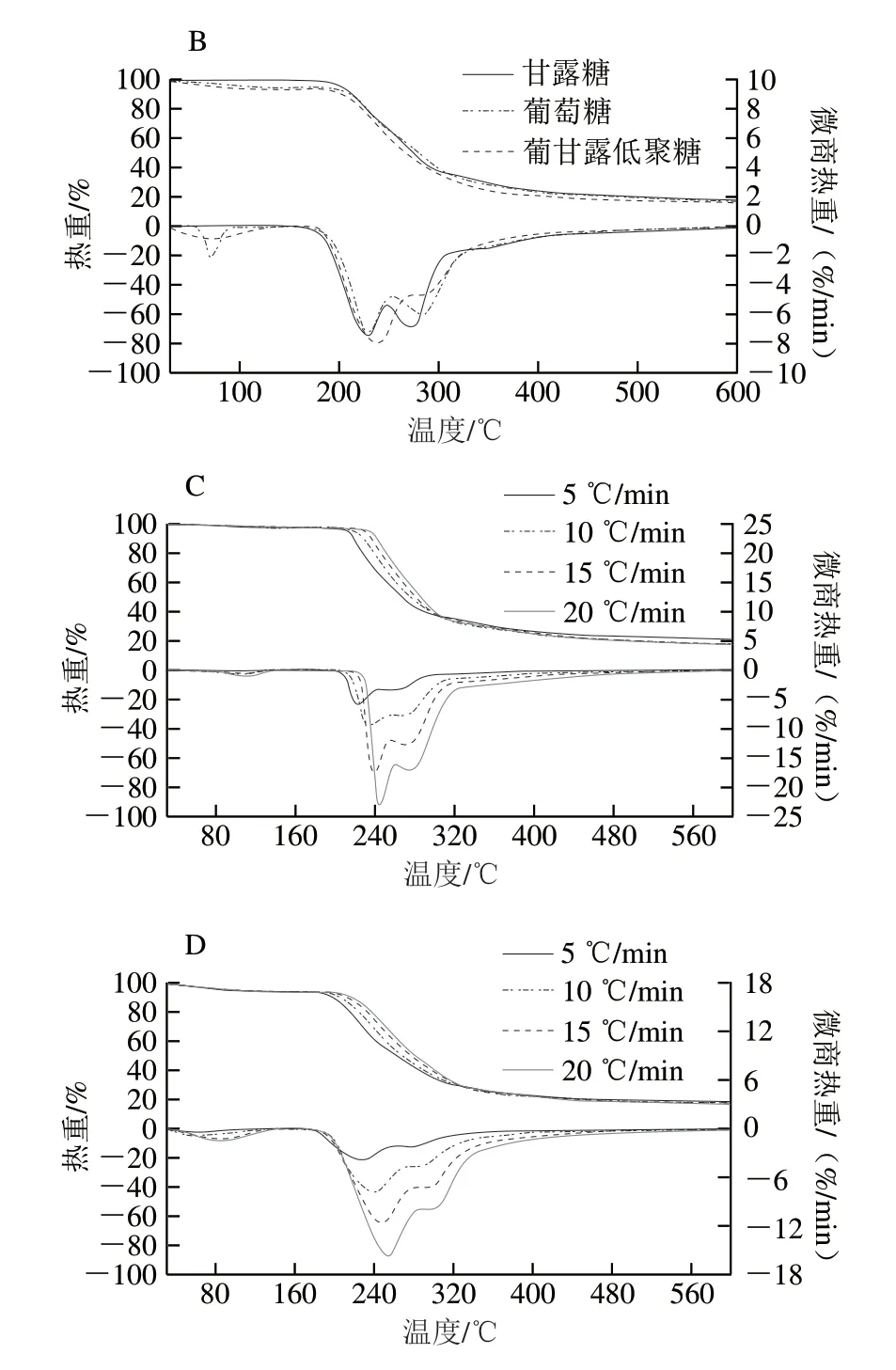
圖 2 低聚糖和單糖的TG曲線與DTG曲線Fig. 2 Thermogravimetry and differential thermogravimetry curves of oligosaccharides at different heating rates
由圖2C、D可以看出,在不同升溫速率下兩種低聚糖的熱重(thermogravimetry,TG)曲線與DTG曲線變化的趨勢保持一致,由于熱滯后和傳熱限制的影響,TG曲線隨加熱速率的增加而橫向移動,DTG曲線的峰形越來越突出,通過最大升溫速率20 ℃/min可以看出[29]。兩種低聚糖的熱解過程大致可以分為3 個階段:第一階段,在30~100 ℃內主要是脫去水分,由TG曲線呈現出微小下降,DTG曲線出現平峰(失水峰);第二階段和第三階段,在160~370 ℃內,TG曲線呈現大幅度下降,由DTG曲線可看出兩種低聚糖包含一個尖峰和一個單肩峰并且有部分重疊,由表1峰溫數據可知,兩個階段的峰溫值相差不大,第二階段的質量損失速率大于第三階段的質量損失速率,說明在第二階段低聚糖分子主要以熔融和分解體為主,葡甘露低聚糖不同分子質量的聚合物解聚成單糖及包含少量葡萄糖的聚合物,而低聚果糖中果四糖、果五糖解聚成果二糖和果三糖,果二糖和果三糖能迅速形成結晶固體狀物[30-31],第三階段對解聚后的產物進一步分解成碳和氣體。在370 ℃之后,TG曲線和DTG曲線都呈現緩慢變化直至趨于平直。

表 1 不同升溫速率下低聚糖的熱解參數Table 1 Pyrolysis parameters of oligosaccharides at different heating rates
兩種低聚糖的熱解參數如表1所示,由不同速率下低聚糖熱解參數可知,兩種低聚糖的Ti和Tm隨著升溫速率的增加而升高,而Tf無明顯變化,說明兩種低聚糖的熱解溫度范圍相差不大。在所有升溫速率條件下,低聚果糖的Rmax最高,這表明低聚果糖的熱解機理相對簡單,熱分解過程相對較快[32]。在不同升溫速率下兩種低聚糖的Mf都很低,相差不大,表明Mf不受升溫速率的影響。
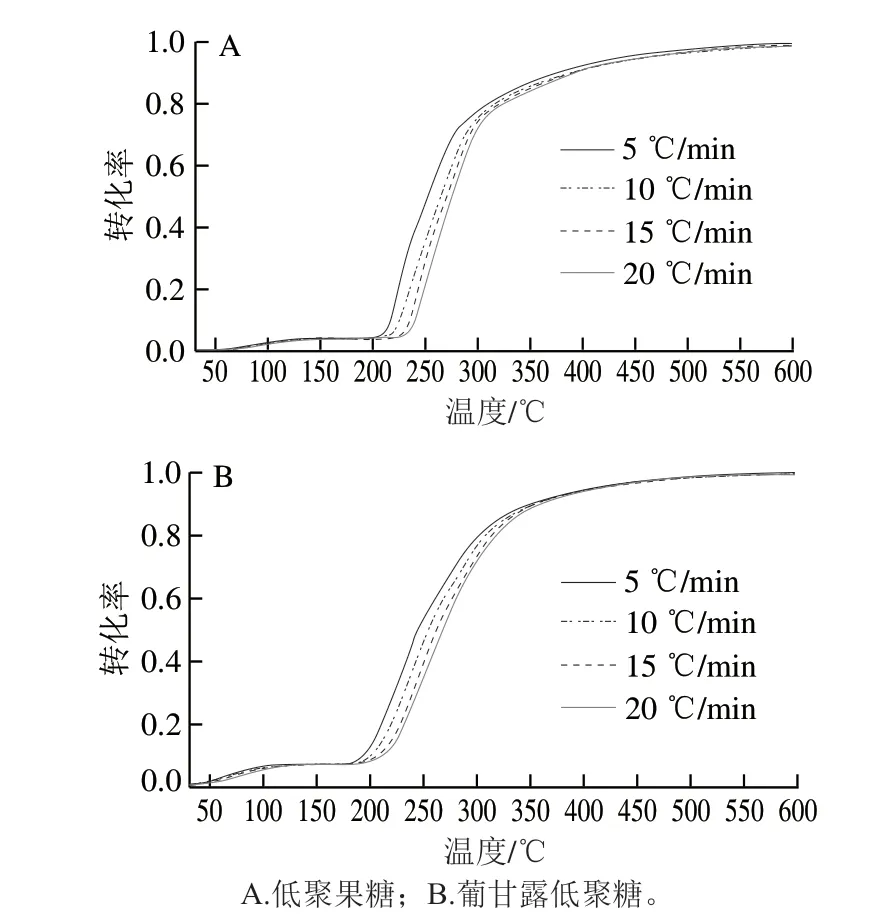
圖 3 不同升溫速率下低聚糖熱解過程轉化率曲線Fig. 3 Curves of α versus T of oligosaccharide pyrolysis at different heating rates
圖3為低聚糖熱解實驗得出的轉化率與溫度的曲線,隨著溫度的升高,轉化率逐漸增大,相同轉化率的條件下,升溫速率越快對應的溫度則越高。該曲線是后續分析熱解非等溫無模式函數法的基礎。
2.3 低聚糖動力學分析結果
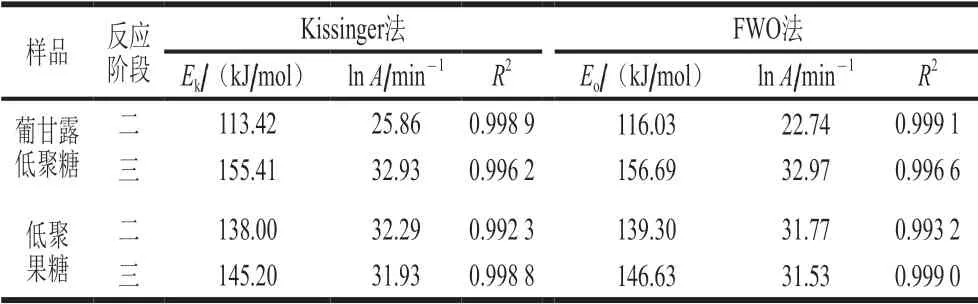
表 2 用Kissinger法和FWO法分別計算低聚糖熱分解活化能Table 2 Activation energy of oligosaccharide thermal decomposition calculated by Kissinger method and FWO method, separately
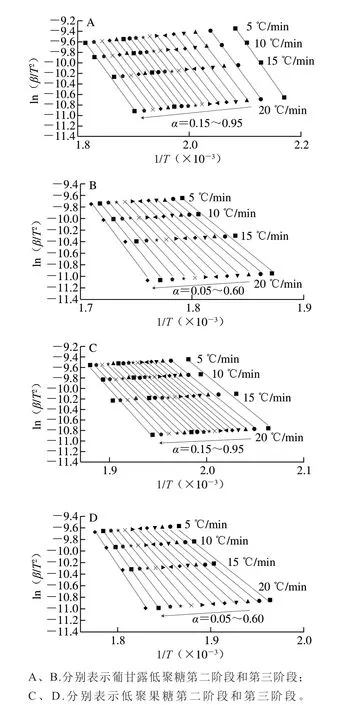
圖 4 低聚糖在不同轉化率下ln(β/T2)與1/T的曲線Fig. 4 Curve of ln (β/T2) against 1/T of oligosaccharides at different conversion rates
根據低聚糖的DTG曲線,用Kissinger、FWO法和KAS法分別對第二階段和第三階段進行分析。根據表2可知,分別采用Kissinger法和FWO法計算得到表觀活化能Ek和Eo,Kissinger法沒有考慮機理函數以線性擬合后截距求得指前因子A,FWO法根據最概然機理函數求得指前因子A,兩個方法計算的結果相差不大,葡甘露低聚糖第二階段的活化能低于低聚果糖第二階段的活化能,而第三階段的活化能高于低聚果糖第三階段的活化能,表明葡甘露低聚糖第二階段更易分解,第三階段更難分解,由于計算存在誤差,為避免有誤差的可能性,取Kissinger法和FWO法的平均值作為分解的活化能以及指前因子,葡甘露低聚糖第二階段和第三階段的活化能及指前因子分別為114.73 kJ/mol、24.30 min-1和156.05 kJ/mol、32.95 min-1,低聚果糖第二階段和第三階段的活化能及指前因子分別為138.65 kJ/mol、32.03 min-1和145.92 kJ/mol、31.73 min-1。由TG-DTG曲線以及表1可知,由于需要考慮葡甘露低聚糖和低聚果糖成分的有效性,在加工、貯藏、運輸以及應用等過程中,本實驗主要以第一個分解溫度進行分析,保證低聚糖有效成分最大利用。根據Yang Hang等[33]的研究方法,本實驗第二階段選取α為0.15~0.95,第三階段選取α為0.05~0.60,排除線性相關性差的轉化率,并以0.05為間隔進行分析,通過公式(9)以ln(β/T2)對1/T作圖,分別對兩種低聚糖第二階段和第三階段進行線性擬合性分析,如圖4所示,結果表明兩種低聚糖用KAS法分析均具有較好的線性相關性,R2均大于0.97。
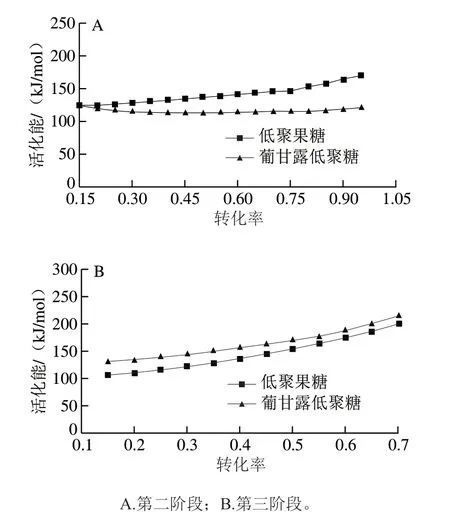
圖 5 KAS法在不同轉化率下獲得的低聚糖的活化能Fig. 5 Activation energy of oligosaccharides obtained by KAS method at different conversion rates
圖5為不同轉化率下用KAS法獲得兩種低聚糖活化能的對比圖,由圖5A可知,第二階段葡甘露低聚糖活化能基本保持不變,低聚果糖活化能呈上升的趨勢。Forgo等[30]的研究表明果糖的熱穩定性不如葡萄糖和甘露糖,第二階段兩種低聚糖活化能表明低聚果糖中果二糖和果三糖迅速結晶導致其活化能偏高。由圖5B可知,兩種低聚糖在第一個分解峰溫之后,隨著溫度升高,聚合物進一步解聚成單糖,為了達到第二個分解峰溫,活化能進一步升高,結果表明葡甘露低聚糖的活化能高于低聚果糖活化能,說明葡甘露低聚糖的熱穩定性高于低聚果糖。
2.4 低聚糖熱分解機理

表 3 低聚糖最概然機理函數擬合結果Table 3 Most probable mechanism functions of oligosaccharides
表3為葡甘露低聚糖和低聚果糖熱解機理函數擬合結果,本實驗分別以同一溫度所對應的α值帶入最常用的30 種機理函數的積分形式G(α)進行擬合性分析,選取斜率接近-1且擬合性較好的方程。結果表明,葡甘露低聚糖熱解反應第二階段的機理函數為G(α)=[1-(1-α)1/3]2,該階段的熱解機理為三維擴散和球形對稱的Jander方程;第三階段的機理函數為G(α)=[-ln(1-α)]4,該階段的熱解機理為隨機成核和隨后生長,遵循Avrami-Erofeev方程。低聚果糖熱解反應第二階段的機理函數為G(α)=1-(1-α)4;第三階段的機理函數為G(α)=[-ln(1-α)]2,該階段的熱解機理為隨機成核和隨后生長,遵循Avrami-Erofeev方程。
2.5 低聚糖熱分解的熱力學參數
表4為兩種低聚糖用KAS法線性擬合分析,本實驗選取擬合性較好的直線斜率來獲得表觀活化能,R2均在0.98以上,根據相關熱力學公式進行計算求得熱力學參數。葡甘露低聚糖熱解第二階段和第三階段各轉化率的Ea,平均值分別為114.42、163.77 kJ/mol,低聚果糖兩個階段的Ea分別為137.22、144.95 kJ/mol,通過與Kissinger法和FWO法分析得到的活化能進行比較,3 種方法分析得到的Ea相差不大;葡甘露低聚糖的第二和三階段的lnA,平均值分別為26.08、34.82 min-1,低聚果糖兩個階段的lnA分別為32.02、31.83 min-1,同樣與之前兩種方法分析得到的lnA相差不大,由于實驗計算可能存在誤差,取3 個方法的平均值作為本實驗研究的結果,即葡甘露低聚糖第二階段和第三階段的Ea及lnA分別為114.58 kJ/mol、25.19 min-1和159.91 kJ/mol、33.89 min-1,低聚果糖第二階段和第三階段的Ea及l nA分別為137.94 kJ/mol、32.03 min-1和145.44 kJ/mol、31.78 min-1。Gupta等[34]研究報道稱指前因子A<109s-1(<20.72 min-1)表示化合物表面控制反應,而A>109s-1(>20.72 min-1)表示簡單的化合物表面自由運動反應,A值越高表示該化合物分解更慢。兩種低聚糖第二階段lnA變化不大,均大于20.70 min-1,所以兩種低聚糖不受表面控制反應,而在第三階段兩種lnA變化較大,其中葡甘露低聚糖的lnA更大,表明葡甘露低聚糖熱解更緩慢,同時兩種低聚糖熱解機理發生的變化與表3兩階段不同熱解機理相符合。
另外,熱力學參數ΔG、ΔH、ΔS均為溫度的狀態函數。隨著溫度的升高,兩種低聚糖各階段的ΔG、ΔH均大于0,說明兩個階段的熱解反應需要吸收大量的熱。葡甘露低聚糖第二階段ΔS均為負值,表明該過程中低聚糖的解聚分解呈有序進行,相反,葡甘露低聚糖第三階段和低聚果糖第二、三階段ΔS均有正負值,表明葡甘露低聚糖解聚后產生的葡萄糖使成分熱解需要更多的熱量且更加復雜化,而低聚果糖ΔS初始階段為負值,表明低聚果糖中果三糖復合物水平增加并快速結晶呈有序性進行。
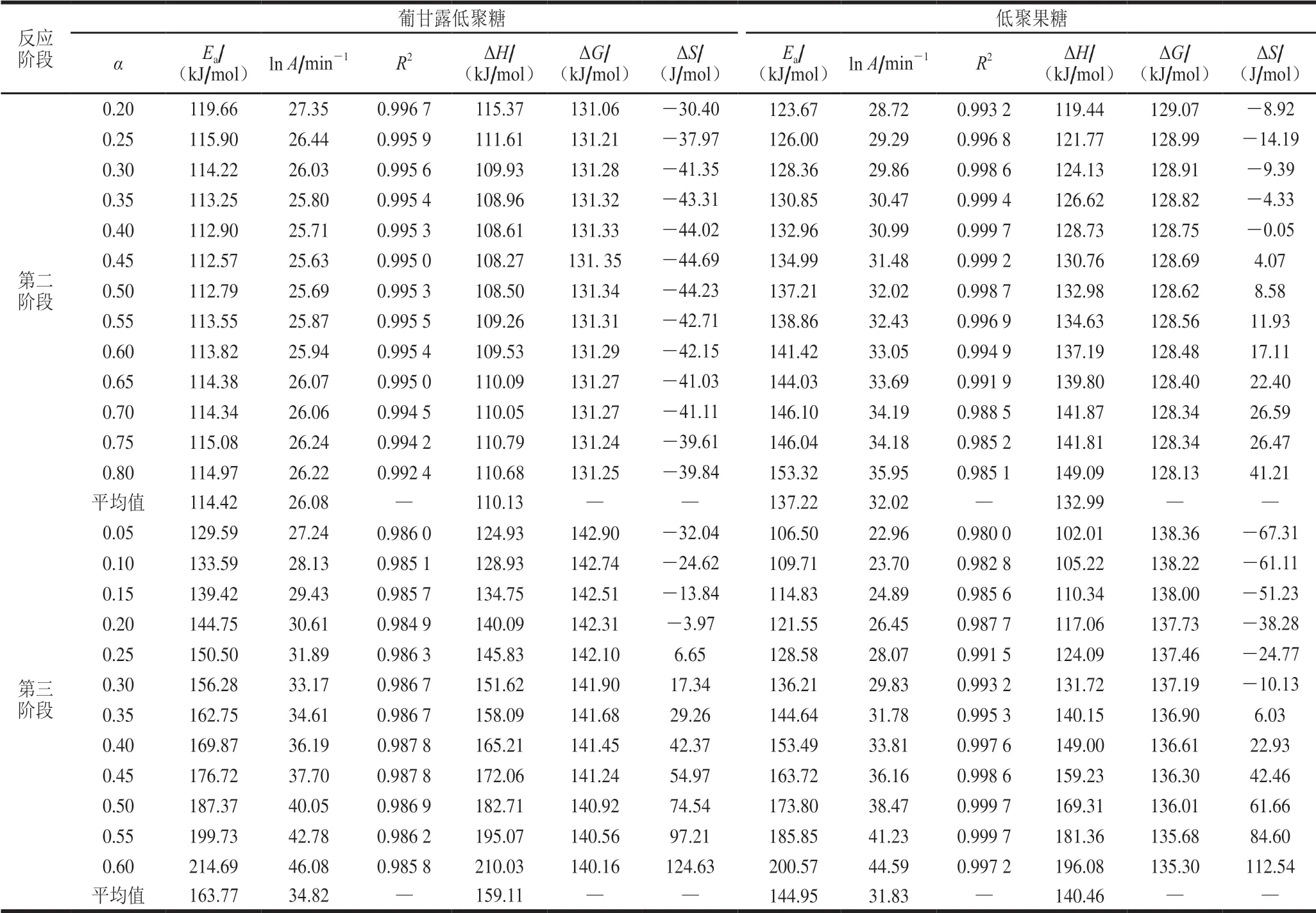
表 4 低聚糖動力學和熱力學參數Table 4 Kinetic and thermodynamic parameters of oligosaccharides
3 結 論
本實驗采用熱重分析儀以5、10、15、20 ℃/min非等溫升溫速率,對葡甘露低聚糖和低聚果糖的熱解性質進行分析,兩種低聚熱解過程分為3 個階段,且分解峰溫在220~300 ℃,分別用Kissinger、KAS、FWO 3 種熱力學分析方法分析比較兩種低聚糖的熱穩定性,第二階段低聚果糖和葡甘露低聚糖的活化能分別為137.94 kJ/mol和114.58 kJ/mol,結果表明低聚果糖中果二糖和果三糖迅速結晶導致其活化能偏高,第三階段低聚果糖和葡甘露低聚糖的活化能分別為145.44 kJ/mol和159.91 kJ/mol,隨著溫度進一步升高,兩種低聚糖解聚成單糖,結果表明葡甘露低聚糖熱穩定性高于低聚果糖。低聚果糖和葡甘露低聚糖lnA分別為32.03、31.78 min-1和25.19、33.89 min-1;分析葡甘露低聚糖和低聚果糖的熱解機理函數,第二階段和第三階段分別為G(α)=[1-(1-α)1/3]2、G(α)=[-ln(1-α)]4和G(α)=1-(1-α)4、G(α)=[-ln(1-α)]2;熱力學參數葡甘露低聚糖第二階段和三階段的ΔH為110.13 kJ/mol和159.11 kJ/mol,低聚果糖第二階段和三階段的ΔH為132.99 kJ/mol和140.46 kJ/mol。葡甘露低聚糖和低聚果糖熱穩定性及動力學機理的比較分析,為其在食品、醫藥領域的應用提供理論參考依據。

