烷過氧自由基氧化對(duì)草魚肌原纖維蛋白熱聚集行為的影響
李學(xué)鵬,劉慈坤,王金廂,周明言,藺博燕,李文協(xié),朱文慧,勵(lì)建榮,林 洪
(1.中國(guó)海洋大學(xué)食品科學(xué)與工程學(xué)院,山東 青島 266003;2.渤海大學(xué)食品科學(xué)與工程學(xué)院,生鮮農(nóng)產(chǎn)品貯藏加工及安全控制技術(shù)國(guó)家地方聯(lián)合工程研究中心,國(guó)家魚糜及魚糜制品加工技術(shù)研發(fā)分中心,遼寧 錦州 121013)
草魚又名鯇魚,屬鯉形目、鯉科、草魚屬,是我國(guó)重要淡水經(jīng)濟(jì)魚類之一。2018年我國(guó)草魚養(yǎng)殖產(chǎn)量達(dá)550.43萬(wàn) t,在全國(guó)淡水養(yǎng)殖主要魚類中排第一位[1]。草魚營(yíng)養(yǎng)價(jià)值高,是一種高蛋白、低脂肪的健康食品,含有豐富的VB1、VB2、煙酸、不飽和脂肪酸,以及鈣、磷、鐵、鋅、硒等微量元素[2]。此外草魚肉質(zhì)鮮美且價(jià)格低廉,深受廣大消費(fèi)者的喜愛。然而,草魚肌肉含水量高、肉質(zhì)嫩、易腐敗變質(zhì)。另外,因含有豐富的多不飽和脂肪酸,在脂肪氧合酶的作用下易發(fā)生脂質(zhì)過氧化反應(yīng),導(dǎo)致草魚在貯藏加工過程中易氧化酸敗[3-4]。
脂質(zhì)過氧化反應(yīng)較為復(fù)雜,其中活性物質(zhì)主要包括脂質(zhì)自由基和活性脂質(zhì)氧化產(chǎn)物,這些活性物質(zhì)具有氧化蛋白質(zhì)的能力,可導(dǎo)致蛋白質(zhì)結(jié)構(gòu)及功能性質(zhì)的變化[5-7]。已有研究表明,烷過氧自由基是脂質(zhì)過氧化反應(yīng)中最主要的自由基中間體,在誘導(dǎo)水產(chǎn)品蛋白質(zhì)氧化過程中扮演重要角色[8-9]。近年來,由于具有可預(yù)測(cè)、可控來源等特點(diǎn),2,2’-偶氮(2-脒基丙烷)二鹽酸鹽(2,2’-azobis(2-amidinopropane)dihydrochloride,AAPH)有氧分解產(chǎn)生的烷過氧自由基模型被廣泛用作產(chǎn)生活性氧的誘導(dǎo)劑[10-11]。Wu Wei[12]、Ye Lin[13]、尤翔宇[14]、Zhou Feibai[15]等分別采用AAPH在有氧條件下熱降解產(chǎn)生烷過氧自由基氧化大豆蛋白、花生蛋白、米糠蛋白和豬肉蛋白,均發(fā)現(xiàn)烷過氧自由基會(huì)對(duì)這些蛋白質(zhì)結(jié)構(gòu)和性質(zhì)產(chǎn)生重要影響,但烷過氧自由基對(duì)魚肉蛋白氧化及對(duì)其功能性質(zhì)影響的研究目前仍鮮見報(bào)道。
肌原纖維蛋白是魚肉的主要組成成分,凝膠性能是肌原纖維蛋白的主要功能特性之一,凝膠質(zhì)量決定了魚糜制品的品質(zhì)。肌原纖維蛋白在熱誘導(dǎo)作用下發(fā)生變性,并通過二硫鍵、氫鍵、疏水相互作用等分子間作用發(fā)生交聯(lián)、聚集和凝膠化,進(jìn)而形成高度有序的三維網(wǎng)絡(luò)結(jié)構(gòu)[16]。凝膠網(wǎng)絡(luò)的質(zhì)量不僅與肌原纖維蛋白結(jié)構(gòu)性質(zhì)有關(guān),且受到凝膠過程的影響。熱聚集是肌原纖維蛋白凝膠過程中的關(guān)鍵步驟,其行為直接決定凝膠基質(zhì)的結(jié)構(gòu)和物理化學(xué)特性(即凝膠特性);有序的熱聚集有利于形成細(xì)致的凝膠網(wǎng)絡(luò),反之則易形成粗糙的凝膠結(jié)構(gòu)[17]。大量研究表明,不同自由基和不同氧化途徑引起的肌原纖維蛋白氧化均會(huì)影響其凝膠性能[18-21],而氧化對(duì)肌原纖維蛋白熱聚集行為的影響一直被忽視。鑒于此,本實(shí)驗(yàn)采用不同濃度AAPH溶液有氧熱分解產(chǎn)生的烷過氧自由基作為氧化體系,對(duì)草魚肌原纖維蛋白進(jìn)行模擬氧化,獲得不同氧化程度的肌原纖維蛋白,并在不同溫度條件下進(jìn)行熱處理,研究氧化肌原纖維蛋白溶液在熱處理過程中熱穩(wěn)定性、表面疏水性、Zeta電位、內(nèi)源熒光光譜、濁度、粒徑分布、聚集體形貌等變化,分析氧化對(duì)魚肉蛋白的熱聚集行為的影響規(guī)律,為深入揭示氧化對(duì)魚肉蛋白凝膠性質(zhì)的影響機(jī)制及凝膠品質(zhì)調(diào)控提供理論依據(jù)。
1 材料與方法
1.1 材料與試劑
新鮮草魚購(gòu)于錦州林西街海鮮批發(fā)市場(chǎng),平均體質(zhì)量(2 000±30)g。
AAPH(純度97%) 上海Macklin公司;三羥甲基氨基甲烷(Tris)、8-苯胺基-1-萘磺酸銨(8-anilino-1-naphthalenesulfonic acid ammonium salt,ANS)、氯化鈉、氯化鉀、無(wú)水乙醇、磷酸氫二鈉、磷酸二氫鈉等(均為分析純) 國(guó)藥集團(tuán)化學(xué)試劑有限公司。
1.2 儀器與設(shè)備
DF-101S集熱式恒溫加熱磁力攪拌器 鄭州長(zhǎng)城科工貿(mào)有限公司;JHG-Q60-P100型實(shí)驗(yàn)室均質(zhì)機(jī) 上海融合公司機(jī)械設(shè)備有限公司;SORVALL Stratos冷凍高速離心機(jī) 美國(guó)Thermo公司;2.5L冷凍干燥機(jī) 美國(guó)Labconco公司;MS105DU分析天平 梅特勒-托利多儀器(上海)有限公司;UV-2550紫外-可見光分光光度計(jì)島津儀器(蘇州)有限公司;F96Pro熒光分光光度計(jì)上海棱光技術(shù)儀器有限公司;Nano-ZS90激光粒度儀英國(guó)馬爾文公司;204 F1差示掃描量熱(differential scanning calorimeter,DSC)儀 德國(guó)耐馳公司;Dimension Icon原子力顯微鏡(atomic force microscope,AFM) 美國(guó)Bruker公司。
1.3 方法
1.3.1 草魚肌原纖維蛋白的提取
新鮮草魚電擊暈后宰殺、去皮,取背部肌肉絞碎,加入5 倍體積10 mmol/L Tris-HCl(pH 7.2),高速均質(zhì)3 次,每次30 s,4 ℃條件下5 000 r/min離心20 min,取沉淀。上述過程反復(fù)3 次,在最后一次沉淀中加入5 倍體積10 mmol/L Tris-HCl緩沖液(含0.6 mol/L NaCl,pH 7.2),高速均質(zhì),4 ℃下4 500 r/min離心20 min,取上清液備用。采用雙縮脲法測(cè)定提取的肌原纖維蛋白濃度。
1.3.2 烷過氧自由基氧化肌原纖維蛋白的制備
參考Zhou Feibai等[15]的方法,將制備的肌原纖維蛋白與不同濃度(0、0.2、1.0、5.0 mmol/L)的APPH溶液以體積比2∶1混合,置于37 ℃避光條件下,在恒溫水浴中孵化24 h,并充分混勻,使肌原纖維蛋白發(fā)生不同程度的氧化。反應(yīng)結(jié)束后,將反應(yīng)液溫度迅速降到4 ℃以下,再將溶液在4 ℃去離子水中透析24 h除去殘余未反應(yīng)的AAPH,之后取部分溶液冷凍干燥制得氧化蛋白用于熱穩(wěn)定性測(cè)定,剩余溶液用于其他指標(biāo)分析。
1.3.3 肌原纖維蛋白熱穩(wěn)定性分析
取5~10 mg凍干的氧化后蛋白樣品于鋁盒中,采用DSC儀進(jìn)行測(cè)定。參數(shù)設(shè)定為:初始溫度為20 ℃、升溫速率為5 ℃/min、結(jié)束溫度為140 ℃,對(duì)照組為空盤子,整個(gè)過程需要氮?dú)猓?.8~1.0 Pa)保護(hù)。采用STAR軟件進(jìn)行數(shù)據(jù)處理和分析得到DSC曲線。每個(gè)樣品重復(fù)3 次,取平均值。
1.3.4 表面疏水性的測(cè)定
參考S a e e d 等[22]的方法并加以修改。將樣品用20 mmol/L含0.6 mol/L KCl的磷酸鹽緩沖溶液(pH 7.0)稀釋至0~1 mg/mL,加入25 μL 8 mmol/L ANS(用20 mmol/L pH 7.0的磷酸鹽緩沖液配制)后混合均勻,避光靜置10 min,然后用熒光分光光度計(jì)測(cè)定其熒光強(qiáng)度。測(cè)定條件為:激發(fā)波長(zhǎng)374 nm,狹縫5 nm,掃描范圍250~500 nm。以蛋白質(zhì)量濃度為橫坐標(biāo)、熒光強(qiáng)度為縱坐標(biāo)作圖,曲線初始斜率即為所求的表面疏水性指數(shù)。
1.3.5 Zeta電位的測(cè)定
采用Nano-ZS90激光粒度儀Zeta電位分析功能測(cè)定熱處理后的草魚肌原纖維蛋白溶液的Zeta電位。測(cè)定溫度為25 ℃,溫度平衡時(shí)間2 min,每組測(cè)定50~100 次。
1.3.6 內(nèi)源熒光光譜的測(cè)定
將熱處理后的蛋白樣品質(zhì)量濃度調(diào)整至0.25 mg/mL。采用F96Pro熒光分光光度計(jì)在激發(fā)波長(zhǎng)295 nm條件下得到300~450 nm之間的發(fā)射光譜(靈敏度為2)。
1.3.7 濁度的測(cè)定
將氧化后肌原纖維蛋白溶液調(diào)至2 mg/mL,置于100 mL的燒杯中,用鋁箔紙封口,溫度計(jì)與轉(zhuǎn)子由中心孔插入,以1 ℃/min升溫速率水浴加熱,水浴溫度由30 ℃升至90 ℃,每升高10 ℃取5 mL樣液在350 nm波長(zhǎng)處測(cè)定吸光度。
1.3.8 粒徑分布的測(cè)定
采用Nano-ZS90激光粒度儀測(cè)定蛋白質(zhì)的粒徑分布,先用0.45 μm濾膜過濾不同氧化程度的草魚肌原纖維蛋白溶液,再配成1 mg/mL。隨后將上述不同氧化程度的蛋白溶液分裝至具塞試管中進(jìn)行水浴加熱,水浴溫度由30 ℃升至90 ℃,每升高10 ℃取5 mL樣液,冷卻至室溫。然后將熱變性的蛋白液加入測(cè)量池中,測(cè)定溫度25 ℃,平衡時(shí)間1 min。
1.3.9 AFM測(cè)試
取2 μL加熱后的樣品溶液(0.1 g/mL)置于云母片上,用氮吹儀小心吹干。將樣品均勻的涂在載玻片上,放置于Dimension Icon AFM載物臺(tái)進(jìn)行觀察。測(cè)試采用輕敲模式。使用Digital Nanoscope 軟件分析AFM圖片。
1.4 數(shù)據(jù)處理與分析
采用SPSS statistics 19軟件中的方差分析法進(jìn)行顯著性分析,以P<0.05表示差異顯著,數(shù)據(jù)繪圖采用Origin軟件。
2 結(jié)果與分析
2.1 AAPH氧化對(duì)草魚肌原纖維蛋白熱穩(wěn)定性的影響
DSC法廣泛應(yīng)用于蛋白質(zhì)熱穩(wěn)定性研究。在DSC圖譜中,最高峰對(duì)應(yīng)的溫度為變性的轉(zhuǎn)變溫度,直接體現(xiàn)蛋白質(zhì)的熱穩(wěn)定性;峰面積的積分為變性焓(ΔH),反映蛋白質(zhì)分子的疏水性或親水性,同時(shí)也反映蛋白質(zhì)分子的聚集程度,因此可采用DSC表征結(jié)構(gòu)變化所引起的焓變化及樣品結(jié)構(gòu)變化信息[23-24]。AAPH氧化后草魚肌原纖維蛋白DSC分析得到的起始溫度、轉(zhuǎn)變溫度及ΔH如圖1所示,隨著AAPH濃度的增加,肌原纖維蛋白起始溫度呈現(xiàn)先升高再降低的趨勢(shì),轉(zhuǎn)變溫度及ΔH變化規(guī)律較為一致。與對(duì)照組相比,0.2、1.0 mmol/L AAPH處理組的起始溫度顯著提高(P<0.05),經(jīng)5.0 mmol/L AAPH處理后又顯著下降(P<0.05)。另外,1.0 mmol/L AAPH氧化組樣品的轉(zhuǎn)變溫度較對(duì)照組顯著提高(P<0.05)。說明低濃度AAPH(0.2、1.0 mmol/L)氧化使草魚肌原纖維蛋白的熱穩(wěn)定性增強(qiáng),而高濃度氧化時(shí)使其熱穩(wěn)定性下降。其原因可能是較低濃度AAPH氧化時(shí)產(chǎn)生二硫鍵等作用促進(jìn)了蛋白質(zhì)分子交聯(lián),提高了熱穩(wěn)定性;高濃度時(shí)過度氧化破壞了肌原纖維蛋白結(jié)構(gòu),使蛋白發(fā)生去折疊反應(yīng),從而導(dǎo)致熱穩(wěn)定性下降[17]。
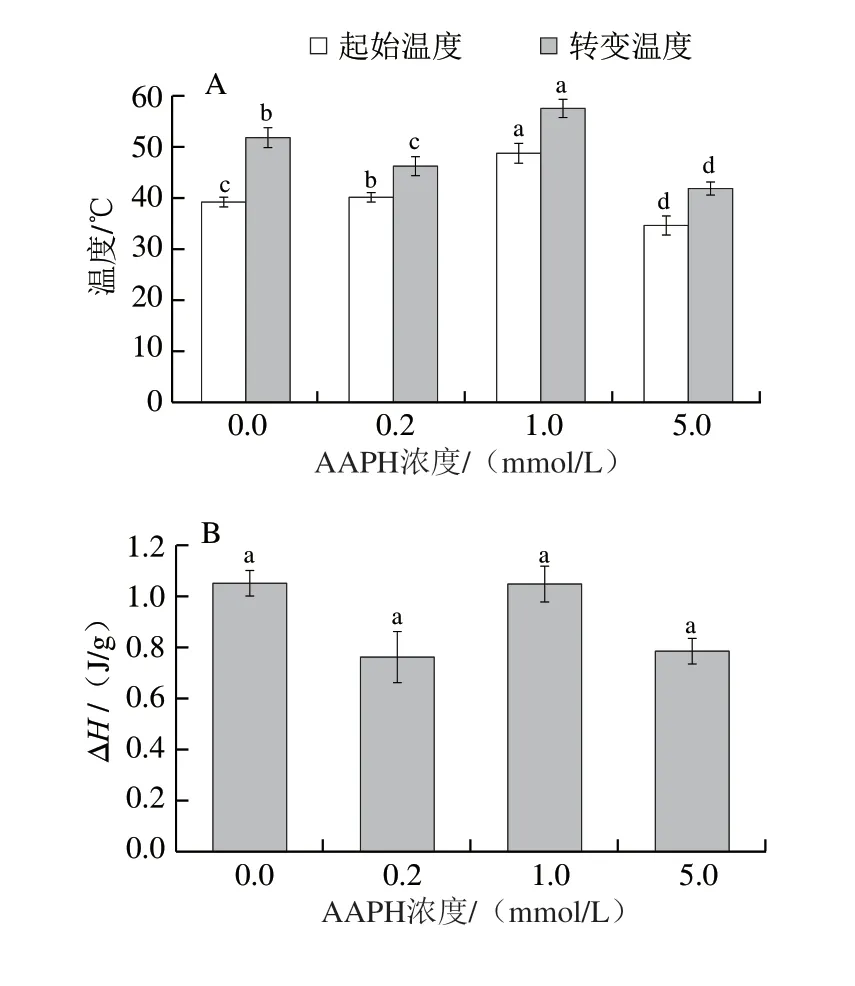
圖 1 不同氧化程度草魚肌原纖維蛋白的熱穩(wěn)定性Fig. 1 Thermal stability of grass carp myofibrillar protein oxidized with different concentrations of AAPH
2.2 AAPH氧化對(duì)草魚肌原纖維熱處理過程中表面疏水性變化的影響

圖 2 不同氧化程度草魚肌原纖維蛋白熱聚集過程中表面疏水性的變化Fig. 2 Changes in surface hydrophobicity of grass carp myofibrillar protein oxidized with different concentrations of AAPH during heat-induced aggregation
蛋白質(zhì)的表面疏水性不僅能間接反映蛋白質(zhì)構(gòu)象,同時(shí)也能夠表征蛋白質(zhì)的溶解度、穩(wěn)定性及自締合的能力[25]。熱處理過程中,加熱會(huì)使蛋白質(zhì)結(jié)構(gòu)變性展開,造成分子內(nèi)部的疏水性基團(tuán)暴露出來,導(dǎo)致疏水性增加[26]。不同濃度AAPH氧化的草魚肌原纖維蛋白加熱過程中表面疏水性指數(shù)的變化如圖2所示。除了50 ℃下0.2 mmol/L AAPH處理的樣品外,其他氧化組樣品在不同加熱溫度時(shí)的表面疏水性指數(shù)均顯著高于對(duì)照組(P<0.05),說明AAPH氧化破壞肌原纖維蛋白結(jié)構(gòu),導(dǎo)致疏水性基團(tuán)的暴露。隨著加熱溫度的升高,各組樣品表面疏水性指數(shù)變化趨勢(shì)大致相同,均呈現(xiàn)先增加后降低趨勢(shì)。對(duì)照組和低濃度AAPH氧化組均在70 ℃表面疏水性指數(shù)達(dá)到最大值,5.0 mmol/L AAPH氧化組在60 ℃達(dá)到最大值。說明對(duì)照組和低濃度AAPH氧化組加熱到70 ℃時(shí)蛋白結(jié)構(gòu)完全展開,而5.0 mmol/L AAPH氧化組樣品熱穩(wěn)定性低,60 ℃時(shí)已充分展開。繼續(xù)升高溫度,表面疏水性指數(shù)下降,可能是聚集體的形成將部分疏水基團(tuán)重新被包埋所致[26]。蛋白質(zhì)表面疏水性增加,會(huì)使其更容易發(fā)生聚集,導(dǎo)致蛋白質(zhì)溶解度下降,該結(jié)果也印證了2.5節(jié)肌原纖維蛋白溶液濁度的變化結(jié)果。
2.3 AAPH氧化草魚肌原纖維蛋白熱處理過程中表面電位變化的影響
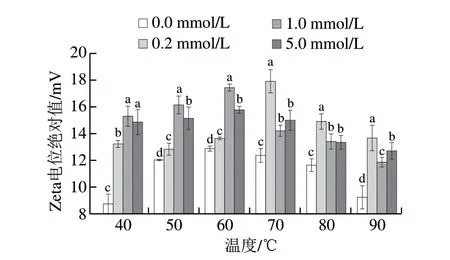
圖 3 不同氧化程度的草魚肌原纖維蛋白熱聚集過程中Zeta電位的變化Fig. 3 Changes in zeta potential of grass carp myofibrillar protein oxidized with different concentrations of AAPH during heat-induced aggregation
蛋白質(zhì)的Zeta電位能夠反映蛋白表面的所帶電荷情況,同時(shí)也對(duì)聚集體形成和維持體系的穩(wěn)定性具有重要作用[27]。加熱過程中不同濃度AAPH氧化的草魚肌原纖維蛋白表面電位變化如圖3所示,隨著溫度的升高,不同處理組樣品Zeta電位的絕對(duì)值均呈先升高再下降的趨勢(shì)。Zeta電位絕對(duì)值的變化趨勢(shì)基本與表面疏水性指數(shù)變化一致,均在60~70 ℃左右達(dá)到最大值。這可能是因?yàn)闊崽幚磉^程中,肌原纖維蛋白變性,結(jié)構(gòu)逐步展開,一些原來包埋在分子內(nèi)部的帶電氨基酸殘基逐漸暴露使蛋白表面電荷增多;之后肌原纖維蛋白發(fā)生熱聚集,形成的聚集體又把部分帶電氨基酸殘基包埋起來,使表面電荷減少[28]。另外,從圖中同時(shí)可以看出,AAPH氧化后肌原纖維蛋白
Zeta電位絕對(duì)值均高于對(duì)照組,這可能是烷過氧自由基改變了肌原纖維蛋白表面電荷和氨基酸殘基的分布,使得蛋白表面靜電作用力失衡。Chen Nannan[29]、Ye Lin[30]、吳偉[31]等發(fā)現(xiàn)過氧自由基氧化可使大豆蛋白、花生蛋白和大米蛋白Zeta電位絕對(duì)值下降,其變化也與氧化改變蛋白表面電荷和氨基酸殘基分布、改變表面吸引力/排斥力分布有關(guān)。
2.4 AAPH氧化對(duì)草魚肌原纖維蛋白熱處理過程中內(nèi)源熒光光譜變化的影響
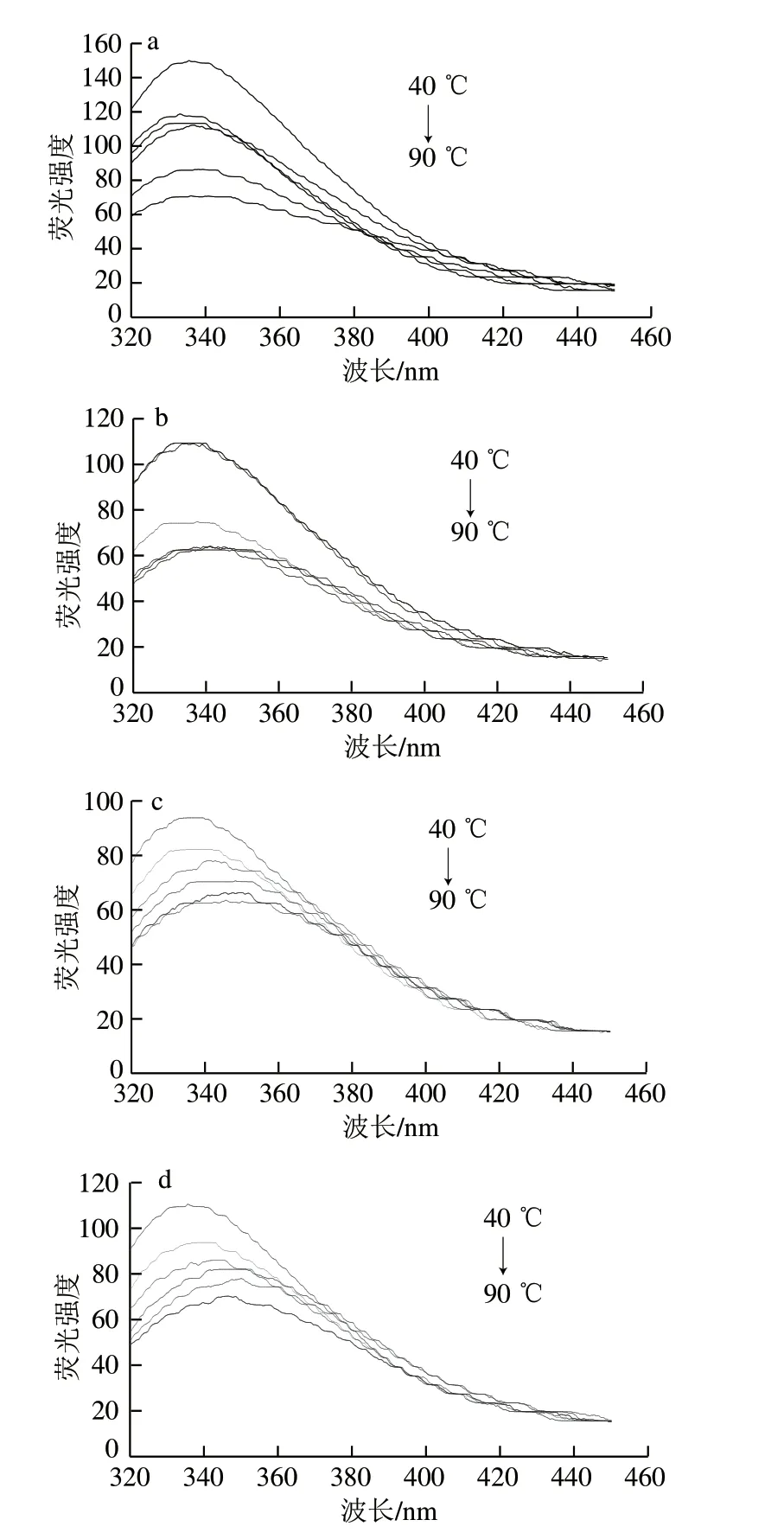
圖 4 不同氧化程度草魚肌原纖維蛋白熱聚集過程中內(nèi)源熒光光譜的變化Fig. 4 Changes in intrinsic fluorescence spectra of grass carp myofibrillar protein oxidized with different concentrations of AAPH during heat-induced aggregation
蛋白質(zhì)的內(nèi)源熒光主要來自于色氨酸等芳香族氨基酸殘基,通過內(nèi)源熒光光譜可以了解蛋白分子多肽鏈空間結(jié)構(gòu)的變化。從圖4可以看出,草魚肌原纖維球蛋白在295 nm激發(fā)波長(zhǎng)下,色氨酸熒光光譜在335 nm左右有一個(gè)強(qiáng)熒光吸收值。隨著加熱溫度的升高,所有處理組樣品肌原纖維蛋白熒光強(qiáng)度均逐漸減少,該趨勢(shì)與Lefevre等[32]的研究結(jié)果較為一致。這可能是因?yàn)榧訜岷螅≡w維蛋白變性,結(jié)構(gòu)逐步展開,埋藏在分子內(nèi)部的色氨酸殘基暴露于外部極性的環(huán)境,促進(jìn)聚集體的形成,分子間的疏水性相互作用增強(qiáng)[33]。此外,從圖4中還可以看出,AAPH氧化導(dǎo)致肌原纖維蛋白熒光強(qiáng)度下降,且隨著加熱溫度的升高,氧化程度越大的樣品肌原纖維蛋白的熒光峰紅移現(xiàn)象越明顯。紅移表示色氨酸的微環(huán)境極性增加,即熒光發(fā)射基團(tuán)暴露于高極性的水性環(huán)境中。這說明AAPH氧化處理能使肌原纖維蛋白色氨酸的微環(huán)境在熱聚集過程中變得親水,蛋白質(zhì)構(gòu)象更易發(fā)生變化。
2.5 AAPH氧化對(duì)草魚肌原纖維蛋白熱處理過程中濁度變化的影響

圖 5 不同氧化程度草魚肌原纖維蛋白熱聚集過程中濁度的變化Fig. 5 Changes in turbidity of grass carp myofibrillar protein oxidized with different concentrations of AAPH during heat-induced aggregation
濁度可以反映溶液中不溶懸浮粒子的大小和數(shù)量,常作為蛋白質(zhì)聚集的測(cè)定指標(biāo)。蛋白質(zhì)在溶液中發(fā)生聚集后,顆粒直徑會(huì)變大,濁度會(huì)升高[34]。不同濃度AAPH氧化肌原纖維蛋白在加熱過程中濁度的變化如圖5所示,隨著溫度的升高,不同組樣品的濁度總體均先增加,并在達(dá)到峰值后略微降低。當(dāng)樣品在40~50 ℃加熱時(shí),對(duì)照組和低濃度(0.2 mmol/L和1.0 mmol/L)AAPH處理組濁度沒有發(fā)生顯著變化(P>0.05)。而加熱溫度達(dá)到60 ℃時(shí),對(duì)照組和0.2 mmol/L AAPH處理組樣品濁度達(dá)到最大值;溫度達(dá)到70 ℃時(shí),1.0 mmol/L和5.0 mmol/L AAPH處理組樣品濁度達(dá)到最大值,繼續(xù)升高溫度,濁度變化不顯著(P>0.05)。加熱過程中肌原纖維蛋白溶液濁度增加說明蛋白發(fā)生了變性聚集,溶液中不可溶聚集體的大小和數(shù)量均明顯增加;當(dāng)升高到一定溫度時(shí),蛋白溶液濁度趨于穩(wěn)定或略降,是因?yàn)殡S著溫度的升高不可溶聚集體顆粒變大,同時(shí)可能產(chǎn)生了沉淀,導(dǎo)致溶液中聚集體數(shù)量降低[35]。對(duì)照組和0.2 mmol/L AAPH氧化組樣品濁度在60 ℃時(shí)達(dá)到最大值,而1.0 mmol/L和5.0 mmol/L AAPH氧化組樣品濁度達(dá)到最高值時(shí)的溫度為70 ℃,且最大濁度均高于對(duì)照組,說明AAPH氧化一定程度上改變了肌原纖維蛋白的熱聚集規(guī)律。分析其可能原因是,肌原纖維蛋白經(jīng)低濃度AAPH氧化產(chǎn)生二硫鍵、二聚酪氨酸等作用力并改變了其結(jié)構(gòu)和構(gòu)象[17],使其分子鏈在較低加熱溫度時(shí)難以完全展開、變性和聚集,該結(jié)論與熱穩(wěn)定性結(jié)果相一致。而高濃度AAPH氧化可能引起肌原纖維蛋白肽鏈斷裂和降解,降解形成的肽鏈較肌原纖維蛋白分子難以聚集,但隨著加熱溫度的升高,它們可通過非共價(jià)鍵和二硫鍵等結(jié)合形成聚集體,使溶液中不可溶聚集體數(shù)量增加,因此高濃度AAPH氧化組濁度達(dá)最高值時(shí)溫度較高、濁度較大。濁度的變化與表面疏水性的結(jié)果相一致。
2.6 AAPH氧化對(duì)草魚肌原纖維蛋白熱處理過程中粒徑分布的影響

圖 6 不同氧化程度草魚肌原纖維蛋白熱聚集過程中粒徑分布的變化Fig. 6 Changes in particle size distribution of grass carp myofibrillar protein oxidized with different concentrations of AAPH during heat-induced aggregation
蛋白質(zhì)在一定條件下加熱變性,通過次級(jí)鍵和二硫鍵等形成可溶性聚集體,在一定條件下可溶性聚集體進(jìn)一步聚集交聯(lián)就可形成凝膠網(wǎng)絡(luò),因此熱聚集體的粒徑對(duì)蛋白質(zhì)的凝膠性質(zhì)產(chǎn)生重要影響[36]。加熱過程中不同濃度AAPH氧化的草魚肌原纖維蛋白的粒徑分布變化如圖6所示,隨著加熱溫度由30 ℃升到90 ℃,對(duì)照組樣品中熱聚集體的平均粒徑逐漸增大,說明未氧化草魚肌原纖維蛋白加熱過程中發(fā)生了相對(duì)有序的熱變性聚集。0.2 mmol/L AAPH氧化組樣品粒徑變化規(guī)律基本與對(duì)照組一致。1.0 mmol/L AAPH氧化組樣品加熱過程中粒徑變化趨勢(shì)較為復(fù)雜,在30~40 ℃時(shí)粒徑變化不大,這可能是因?yàn)椴蒴~肌原纖維蛋白經(jīng)1.0 mmol/L AAPH氧化后熱變性溫度升高(由2.1節(jié)可知其熱轉(zhuǎn)變溫度為48.75 ℃),蛋白沒有發(fā)生明顯的變性和聚集;加熱溫度在50~70 ℃時(shí),聚集體粒徑隨著溫度升高逐漸增大;進(jìn)一步升高溫度(80~90 ℃)聚集體粒徑又發(fā)生了降低。5.0 mmol/L AAPH氧化組樣品在40 ℃加熱時(shí)粒徑顯著增大,這是由于該氧化樣品熱變性溫度低于40 ℃,故樣品在溫度達(dá)到40 ℃時(shí)已發(fā)生明顯聚集;繼續(xù)升高溫度,聚集體粒徑逐漸增大,當(dāng)加熱溫度達(dá)70 ℃后粒徑又有所降低。此外,由圖6還可以看出,不同組樣品初始平均粒徑(30 ℃時(shí))隨著AAPH氧化濃度的增加呈現(xiàn)先增加后降低趨勢(shì)。可見AAPH氧化使草魚肌原纖維蛋白聚集體粒徑發(fā)生不規(guī)則變化,上述粒徑變化規(guī)律可能是由于低濃度氧化時(shí)蛋白形成可溶性聚集體,而高濃度氧化時(shí)部分蛋白形成不可溶性聚集體,AAPH氧化使得肌原纖維蛋白在熱變性過程中形成可溶聚集體的能力下降,高溫時(shí)部分可溶性聚集體可轉(zhuǎn)化為不可溶性聚集體形成沉淀,導(dǎo)致平均粒徑降低[37]。
2.7 AAPH氧化對(duì)草魚肌原纖維蛋白熱聚集體形貌變化的影響
AFM技術(shù)利用納米級(jí)尺寸及pN級(jí)力靈敏度的探針在樣品表面進(jìn)行逐級(jí)光柵掃描得到樣品表面的形貌。利用AFM觀察蛋白質(zhì)聚集過程中微觀形態(tài)的變化能夠直觀反映蛋白溶液的聚集狀態(tài)[38]。不同濃度AAPH氧化的草魚肌原纖維蛋白加熱過程中形成的聚集體形貌如圖7所示。未氧化的草魚肌原纖維蛋白加熱過程中聚集體顆粒相對(duì)較小且分布均勻,加熱溫度越高,聚集體的顆粒也越大。經(jīng)0.2 mmol/L和1.0 mmol/L AAPH氧化處理后的肌原纖維蛋白加熱過程中聚集體顆粒也隨著加熱溫度的升高而增大,但形貌特征發(fā)生了一定變化,顆粒大小不一、分布不均勻。而且相同溫度下,蛋白氧化程度越高形成的聚集體顆粒越大、數(shù)量越少。這說明AAPH氧化會(huì)使草魚肌原纖維蛋白發(fā)生不規(guī)則地?zé)峋奂纬纱蟮牟灰?guī)則蛋白簇,且改變了熱聚集體的形貌特征。

圖 7 不同氧化程度草魚肌原纖維蛋白熱聚集過程中聚集體AFM形貌Fig. 7 AFM images of heat-induced aggregates of grass carp myofibrillar protein oxidized with different concentrations of AAPH
3 結(jié) 論
較低濃度(不高于1.0 mmol/L)AAPH氧化處理有助于增強(qiáng)草魚肌原纖維蛋白的熱穩(wěn)定性,而高濃度(5.0 mmol/L)氧化則降低其熱穩(wěn)定性。隨著加熱溫度的升高,對(duì)照組和氧化組樣品蛋白溶液的表面疏水性指數(shù)、Zeta電位絕對(duì)值、濁度呈先增加后降低趨勢(shì)。內(nèi)源熒光強(qiáng)度隨加熱溫度的升高逐漸減少并出現(xiàn)紅移,且氧化程度越大,紅移現(xiàn)象越明顯。對(duì)照組和0.2 mmol/L AAPH氧化組樣品熱聚集體的平均粒徑隨著加熱溫度的升高逐漸增大,1.0 mmol/L和5.0 mmol/L AAPH氧化組樣品則呈先增大后減小趨勢(shì)。氧化組樣品熱聚集體大小不一且分布不均勻,隨著加熱溫度的升高聚集體顆粒增大,且氧化程度越高顆粒越大。總之,烷過氧自由基氧化顯著影響草魚肌原纖維蛋白的熱變性聚集規(guī)律,使其從有序變?yōu)闊o(wú)序和不規(guī)則,進(jìn)一步可能會(huì)影響肌原纖維蛋白的凝膠性質(zhì)。

