氧自由基在納米細菌致腎結石形成過程中的作用
王敬珅,郝志強,楊 恒,汪 淵,李永樂,錢 彪,鄭麗英,冷 欣,王艷軍,張志強
(1石河子大學醫學院,新疆 石河子 832000;2贛南醫學院第一附屬醫院泌尿外科,江西 贛州 341000;3贛南醫學院第一附屬醫院科研管理科,江西 贛州 341000;4新疆生產建設兵團第九師醫院泌尿外科,新疆 塔城 834601;5新疆生產建設兵團第十三師紅星醫院泌尿外科,新疆 哈密 839000;6新疆生產建設兵團第七師醫院泌尿外科,新疆 奎屯 833200)
納米細菌(Nanobacteria,NB)是直徑為納米級的革蘭陰性菌,呈球桿狀,無莢膜和鞭毛[1-3]。Kajander研究發現95%以上腎結石患者的血液、尿液和結石中存在NB[4]。由于體內NB的清除是通過腎臟完成的,且NB具備生物礦化能力,可黏附血液中的鈣磷離子形成結石,因此,關于NB與腎結石形成的研究越來越成為熱點[5-7]。
褚浩等證明了NB可通過早期損傷腎臟誘導結晶形成[8]。腎小管損傷是結石形成的重要原因,損傷后基底膜暴露于小管液中,細胞的晶體黏附性明顯增強,細胞與細菌的黏附量增加,從而形成結石[7,9]。劉鑫總結認為是氧自由基介導腎小管上皮細胞結構改變,胞膜破壞,細胞碎片脫落入管腔,促進了鈣鹽晶體的聚集、成核和生長[10]。本試驗研究探討氧自由基與腎結石形成的關系,并探究四環素是否有助于腎結石的防治。
1 材料與方法
1.1主要試劑及儀器:人腎小管上皮細胞HK-2購自武漢大學保藏中心。DMEM培養基,1640培養基,胎牛血清,PBS緩沖液,一水草酸鈣(Calcium oxalate monohydrate,COM),納米級羥基磷灰石(Nanograde hydroxuapatite,nHAP),四環素,過氧化氫(H2O2)試劑盒、丙二醛(MDA)試劑盒、乳酸脫氫酶(LDH)試劑盒、Na+/K+ATP酶試劑盒、Ca2+/Mg2+ATP酶試劑盒,phalloidin-FITC。細胞孵育箱,倒置相差顯微鏡,透射電子顯微鏡,激光掃描共聚焦顯微鏡,酶標儀。本次研究經過本院醫學倫理委員會同意。
1.2NB培養與鑒定:于新疆石河子大學醫學院第一附屬醫院泌尿外科收集臨床確診腎結石且未應用藥物或手術治療患者的尿液,將無菌條件下獲得的尿液2 ml用生理鹽水稀釋5倍,4℃離心45 min(14 000 g);取管底2 ml混勻,以0.45 μm濾紙過濾后,再以生理鹽水稀釋5倍,4℃離心45 min(14 000 g);取管底1 ml液體充分混勻后,經0.22 μm的濾紙加壓過濾。將濾液1 ml注入含DMEM培養液、10%γ-FBS和1%HEPES緩沖液的細胞培養瓶中,37℃、5% CO2條件下培養,5~7 d換1次液。倒置相差顯微鏡觀察NB生長,篩選出無污染的標本,用吸管吹打均勻后,吸入EP管。12 000 r/min,離心20 min,棄上清液,再加入無菌注射用水1.5 ml吹打混勻。重復上面步驟共計清洗NB 3次,應用透射電鏡掃描(負染法)鑒定。
1.3實驗分組:選取HK-2細胞,隨機分為五組,空白對照組(胎牛血清、1640培養液+HK-2細胞),NB組(NB菌液、胎牛血清、1640培養液+HK-2細胞),一水草酸鈣(Calcium oxalate monohydrate,COM)組(5 mmol/L COM懸液、胎牛血清、1640培養液+HK-2細胞),納米級羥基磷灰石(Nanograde hydroxuapatite,nHAP)組(nHAP、胎牛血清、1640培養液+HK-2細胞)和四環素組(四環素、NB菌液、胎牛血清、1640培養液+HK-2細胞)。
1.4各組細胞透射電子顯微鏡觀察:分別于6 h、12 h、24 h提取各組細胞制成細胞懸液,離心后轉移至EP管內,PBS浸泡10 min后棄上清;加入預冷的3%戊二醛固定2 h,PBS洗2次,3 min/次;再加入1%鋨酸固定2 h,PBS洗2次,3 min/次;梯度酒精脫水,經Epon812:環氧丙烷=1∶1浸透,包埋后80℃聚合過夜。行超薄切片、染色。于透射電子顯微鏡下觀察細胞形態與超微結構變化。
1.5細胞損傷因子指標檢測:分別在6 h、12 h、24 h取各組細胞上清液,按照試劑盒說明書分別檢測H2O2、MDA、LDH含量;向吸盡培養液的細胞中加入0.25%胰蛋白酶并反復吹打將細胞消化,轉移至EP管中,分別加入PBS緩沖液400 μl。用超聲粉碎機粉碎,ATP酶試劑盒比色法測定各組細胞Na+/K+ATP酶和Ca2+/Mg2+ATP酶活性。
1.6激光共聚焦顯微鏡檢測晶體滯留實驗:將HK-2細胞接種于鋪有清潔蓋玻片的24孔板內,共同培養6 h、12 h、24 h后取出各組樣本,加入COM懸液(每孔內COM濃度200 mg/L),輕搖5~10 s,使COM晶體與底部細胞充分接觸。3 min后吸凈蓋玻片上方液體,加入飽和草酸鈉溶液漂洗3次。將蓋玻片從孔板中取出,4%多聚甲醛固定20 min,PBS洗2次,5 min/次,搖床輕晃;加入5 mg/L的phalloidin-FITC 50 μl,室溫避光孵育20 min;PBS洗2次,5 min/次;甘油封片。在488 nm和633 nm激發光下逐一觀察各組玻片并進行圖像采集。
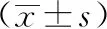
2 結果
2.1各組細胞透射電子顯微鏡觀察結果:電鏡結果見圖1。實驗過程中,空白對照組(圖2A,B,C和D)細胞膜結構完整正常,膜外微絨毛(黑色箭頭)數量豐富,排列規則;雙層核膜(黃色箭頭)結構正常,核周隙正常;線粒體(紅色箭頭)形態正常,未見腫脹或萎縮;細胞亞顯微結構正常。

對照組:A,B,C,D;NB組:E,F,G,H;COM組:I,J,K,L;nHAP組:M,N,O,P;四環素組:Q,R,S,T
實驗開始12 h后,NB組細胞膜結構完整,微絨毛結構稍紊亂,局部絨毛消失(黑色箭頭,圖2E);細胞核畸形,染色質輕度分布不均,局部染色質凝集(黃色箭頭,圖2E);核外膜局部區域降解(藍色箭頭,圖2E);部分線粒體結構輕度腫脹,脊結構模糊不清(紅色箭頭,圖2F);胞漿中偶見髓樣小體(圖2F)。nHAP組細胞膜局部區域結構破損,微絨毛結構消失(黑色箭頭,圖2M),絨毛結構消失;部分線粒體結構輕度腫脹,脊結構模糊不清(紅色箭頭圖2N)。胞漿中見髓樣小體(綠色箭頭,圖2N)。四環素組細胞膜結構完整,微絨毛結構稍紊亂,局部絨毛消失(圖2Q,黑色箭頭),絨毛結構消失;細胞核畸形,染色質輕度分布不均,局部染色質凝集(圖2Q,黃色箭頭);核外膜局部區域降解(圖2R,藍色箭頭);部分線粒體結構輕度腫脹,脊結構模糊不清(圖2R,紅色箭頭)。胞漿中偶見髓樣小體(圖2R,綠色箭頭)。COM組細胞膜局部區域結構紊亂,微絨毛分布不均,局部區域絨毛消失(圖2I,黑色箭頭);細胞核染色質邊集(圖2I,藍色箭頭);線粒體結構正常,脊結構清晰。胞漿中偶見自噬小體。
實驗開始24 h后,NB組細胞膜結構破損,胞核裸露在外(粉色箭頭,圖2G);微絨毛基本消失(黑色箭頭,圖2G),線粒體數量較少,結構腫脹,脊模糊不清(紅色箭頭,圖2H);胞漿中可見較多髓樣小體(綠色箭頭,圖2H),胞漿中自噬小體數量較多(棕黃色箭頭,圖2H)。nHAP組細胞膜結構完整,核膜結構正常;微絨毛分布不均,局部區域絨毛消失(圖2O,黑色箭頭);細胞核染色質邊集(圖2O,藍色箭頭);線粒體結構腫脹,脊模糊不清,局部區域降解(圖2P,藍色箭頭)。胞漿中偶見髓樣小體(圖2P,綠色箭頭);胞漿中可見自噬小體(圖2P,棕黃色箭頭)。四環素組細胞膜結構完整,微絨毛基本消失(圖2S,黑色箭頭);線粒體數量較少,結構腫脹,脊模糊不清(圖2S,紅色箭頭)。胞漿中可見較多髓樣小體(圖2T,綠色箭頭);胞漿中自噬小體數量較多(圖2T,棕黃色箭頭)。COM組細胞膜結構破損,微絨毛分布紊亂,絨毛消失;細胞核膜階段性溶解,核膜結構模糊不清(圖2L,藍色箭頭);線粒體結構腫脹,脊模糊不清(圖2L,紅色箭頭)。胞漿中見髓樣小體(圖2L,綠色箭頭)及自噬小體(圖2L,黃色箭頭)。

圖2 激光共聚焦顯示細胞晶體黏附情況(×100)
2.2各組細胞細胞損傷因子指標檢測結果:如表1所示,共培養12 h和24 h后,NB組和COM組細胞的Na+/K+ATP酶和Ca2+/Mg2+ATP酶活性均低于對照組(P<0.05),而nHAP組僅在12h時低于空白對照組(P<0.05),四環素組細胞在各時間點的酶活性均高于NB組(P<0.05)。

表1 各時間點各組Na+/K+ATP和Ca2+/Mg2+ATP酶活性比較
如表2所示,在各時間點,COM組LDH含量均高于對照組(P<0.05),NB組、nHAP組、四環素組的LDH含量顯著低于COM組(P<0.05)。共培養12 h和24 h后,NB組和COM組培養液中H2O2和MDA的含量顯著高于對照組(P<0.05),nHAP組中H2O2和MDA的含量與對照組無明顯差異(P>0.05),干擾組中H2O2和MDA的含量顯著低于NB組(P<0.05)。

表2 各時間點各組培養液LDH、H2O2和MDA含量比較
2.3激光共聚焦顯微鏡觀察結果:如圖2所示,培養6 h時,NB組、COM組可觀察到少量晶體黏附,隨著共培養時間延長,兩組細胞晶體黏附量進一步增加。共培養6 h和12 h時,nHAP組未觀察到明顯的晶體黏附現象,當共培養24 h時,可觀察到少量晶體黏附。各時間點,干擾組中晶體黏附量均顯著少于NB組。
3 討論
腎結石發病率居高不下,大量研究證實腎結石的形成是一個復雜的過程,涉及尿過飽和度、晶體的形成和晶體的生長成熟等多種因素,其中晶體與尿上皮細胞的黏附是腎結石形成的關鍵步驟[5,7,9,11,12]。
本實驗結果表明,NB對HK-2細胞的損傷程度與nHAP組相似(透射電鏡觀察和ATP酶活性檢測),12 h時兩組細胞膜結構完整,但NB組細胞核已經出現畸形;24 h時NB組線粒體腫脹、核膜溶解和胞核裸露的細胞數較nHAP組明顯增多,NB和nHAP對細胞的損傷程度也隨著作用時間而加重,主要表現為刷狀緣排列紊亂,細胞膜逐漸破壞,說明NB對HK-2細胞的損傷并不僅僅是羥基磷灰石殼損傷。NB組和COM組細胞的Na+/K+ATP酶和Ca2+/Mg2+ATP酶活性均低于nHAP組,而LDH水平升高,說明細胞膜的完整性和連續性遭到破壞,NB組和COM組H2O2和MDA水平顯著升高說明損傷過程有脂質過氧化反應的參與。這一結果與既往的研究結果相同,Hong Xin[7]通過比色法檢測發現,在12 h和24 h,NB組CAT比對照組和nHAP組均高,在24 h時,CAT含量比COM組含量更高,MDA 和Na+/K+ATP酶活性檢測結果與本文類似。因此可以認為,氧化反應介導了NB對HK-2細胞的損傷。而在激光共聚焦顯微鏡的觀察下,隨著時間的增加,NB組和COM組的晶體黏附量逐漸增高,但nHAP組未觀察到明顯的晶體黏附,進一步說明單純的形成納米羥基磷灰石殼不足形成結石,而氧化反應可能是NB損傷HK-2細胞的重要因素。目前文獻[10,13]歸納氧化反應參與NB形成腎結石的依據是氧自由基通過過氧化反應增強COM晶體與細胞膜的黏附,同時可損傷線粒體,腎臟細胞損傷時發生的氧化應激反應會進一步加重腎損傷,另外氧自由基還可干擾腎小管上皮細胞膜極性,加速鈣鹽晶體沉積,促使結石生長。甘瓊枝等[14](腎上皮細胞損傷使草酸鈣晶體黏附增強的分子機制)通過共聚焦顯微鏡觀察研究非洲綠猴腎上皮細胞(Vero)在損傷后晶體黏附分子透明質酸的表達增強,透明質酸不但可以通過靜電作用力與草酸鈣晶體結合,而且可以通過氫鍵與草酸鈣中的草酸根(Oxalate)作用,導致損傷細胞對晶體的滯留能力大大增強,從而增加了結石形成的危險。
四環素是可以穿透NB的鈣質外殼從而殺滅NB的抗菌藥,在治療牙周病、慢性前列腺炎等NB相關的疾病方面取得一定成效[15-16]。Shoskes[16]等探討NB在Ⅲ型慢性前列腺炎/慢性盆腔疼痛綜合征發病機制中的作用,結果表明,comET治療[四環素+乙二胺四乙酸(EDTA)+營養素]3個月后,國家衛生研究院慢性前列腺炎癥狀指數顯示,12例(80%)患者病情改善率達25%,其中8例(53%)指數改善率超過50%。表明四環素在治療NB相關的慢性前列腺炎方面有效。胡衛國[17]通過尾靜脈注射NB建立大鼠腎結石模型,發現四環素灌胃可以減少大鼠24 h尿LDH以及腎小管結晶數,推測四環素可能有抑制腎結石形成的作用。但目前為止,尚缺乏相關體外實驗的證據。本研究通過體外共培養NB和HK-2細胞,在同一時間節點,四環素組的細胞膜損傷和線粒體腫脹程度均較NB組輕,Na+/K+ATP酶和Ca2+/Mg2+ATP酶活性的抑制程度低,晶體滯留量少,發現四環素可以抑制NB對HK-2細胞的損傷并減少損傷后的晶體滯留。這一結果進一步確認了四環素在腎結石的預防和治療方面的有效性,對于該病在臨床上的診治具有積極的意義。
綜上所述,NB導致腎結石形成的過程為:腎小管上皮細胞損傷后引起細胞膜結構發生變化,為鈣鹽晶體的黏附提供有效位點;同時,釋放氧自由基物質,改變細胞膜結構,損傷線粒體,加重過氧化反應,干擾胞膜極性;并且,損傷后的細胞表達出透明質酸等負電荷晶體黏附分子與鈣磷晶體等陽性離子結合,進一步促進了鈣鹽晶體的黏附、聚集和生長,最終形成結石。進一步實驗研究可探討,NB對動物或人體產生的炎性反應是否與腎結石形成相關,同時四環素能否預防早中期腎結石的進展有待進一步確定。

