新疆傳統(tǒng)發(fā)酵乳制品中產(chǎn)γ-氨基丁酸乳酸菌的篩選與益生特性研究
王騰斌,李寶坤,盧士玲,王慶玲,董娟
(石河子大學 食品學院,新疆 石河子 832003)
γ-氨基丁酸(γ-aminobutyric acid,GABA)是一種四碳的非蛋白質(zhì)氨基酸,廣泛存在于微生物、植物、脊椎動物以及昆蟲中。在植物和細菌中,它在三羧酸循環(huán)中起到關(guān)鍵的代謝作用,在脊椎動物大腦中起到神經(jīng)信號傳遞的作用[1]。GABA具有突出的生理功能,例如:降血壓、治療肝損傷、治療抑郁和癲癇等神經(jīng)性疾病、預(yù)防糖尿病等[2-5]。
現(xiàn)今GABA合成的方法主要有4種:化學合成法、植物富集法、酶合成法與微生物合成法。對這4種方法對比發(fā)現(xiàn):化學合成法制備的GABA無法運用于食品工業(yè)與飼料中;植物富集法通過富集后,GABA含量仍然較低;酶合成法由于多以固定化酶的方式生產(chǎn),成本相對過高;而微生物合成法則具有成本低、含量高、可用于食品等特點[6],因此高產(chǎn)GABA菌株的篩選也變得更加重要。
新疆擁有豐富的乳品資源與千古流傳的傳統(tǒng)制作工藝,各民族憑借這種優(yōu)勢,制作出各種傳統(tǒng)發(fā)酵乳制品。由于在制作過程中,經(jīng)天然的乳酸菌與酵母菌參與,使得這些傳統(tǒng)乳制品中具有豐富的微生物資源,這為功能性乳酸菌、酵母菌的篩選提供了寶貴的微生物資源[7]。并且乳酸菌一般被視為GRAS級微生物,其能生產(chǎn)食品級GABA已被普遍共識。因此,本研究旨在從新疆傳統(tǒng)發(fā)酵乳制品奶酪、酥油、酸奶中篩選出GABA合成量較高的乳酸菌,并對其益生特性進行初步分析,為今后富含GABA食品的研發(fā)提供優(yōu)良的乳酸菌資源。
1 材料與方法
1.1 材料與試劑
材料:新疆傳統(tǒng)奶酪、酥油、酸奶,分別采自新疆阿勒泰市和伊寧縣的不同牧民家庭和市場。
試劑:乙腈、三乙胺、苯異硫氰酸酯、γ-氨基丁酸均為色譜級,美國Sigma公司;谷氨酸鈉、DPPH、鄰菲羅啉、過氧化氫、鐵氰化鉀、三氯乙酸、正丁醇、冰乙酸、硫代乙醇酸鈉,上海麥克林生化科技有限公司;薄層色譜硅膠,上海盛亞化工有限公司;PCRMix試劑,天根生化科技有限公司;MRS培養(yǎng)基,青島高科園海博生物技術(shù)有限公司。
1.2 培養(yǎng)基
MSG-MRS培養(yǎng)基:向MRS液體培養(yǎng)基中加入1%谷氨酸鈉,pH調(diào)至6.5。
MRS-THIO培養(yǎng)基:向MRS液體培養(yǎng)基中加入0.2%硫代乙醇酸鈉。
1.3 實驗菌株
指示菌株:表皮葡萄球菌CICC10294、大腸桿菌CICC10662、金黃色葡萄球菌CICC10348、腸炎沙門氏菌CICC21482,由中國工業(yè)微生物菌種保藏管理中心保藏。
1.4 儀器與設(shè)備
LDZX-30KBS立式壓力蒸汽滅菌器 上海申安醫(yī)療器械廠;5417R型高速冷凍離心機 德國Eppendorf公司;多功能酶標儀 美國BioTek儀器有限公司;SPX-150B-Z型生化培養(yǎng)箱 蘇州江東精密儀器有限公司;梯度PCR儀 美國BIO-RAD公司;BenchTop Pro冷凍干燥機 美國VirTis公司;LC-20A高效液相色譜儀 日本島津公司。
1.5 乳酸菌的篩選
1.5.1 菌株的分離純化
參考Xiong等[8]的方法,利用梯度稀釋涂布法與平板劃線法對新疆傳統(tǒng)奶酪、酥油、酸奶中的菌株進行分離與純化,將分離的菌株于-80 ℃甘油管保藏。
1.5.2 16S rDNA分子學鑒定
利用細菌基因組DNA提取試劑盒進行分離菌株DNA的提取。PCR擴增引物:27f(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492r(5′-GGTTACCTTGTTACGACTT-3′);PCR擴增體系:12.5 μL PCRMix、9.5 μL ddH2O、27f與1492r引物各1 μL、模板DNA 1 μL;PCR擴增程序:95 ℃ 5 min,94 ℃ 30 s,48 ℃ 30 s,72 ℃ 1 min,30個循環(huán),72 ℃ 8 min。將擴增后的PCR產(chǎn)物進行1%瓊脂糖凝膠電泳,若在1450 bp處有單一條帶且無非特異性條帶存在,則送至上海生工生物工程公司進行測序,將測序結(jié)果于NCBI上進行BLAST比對,利用MEGA 7建立系統(tǒng)發(fā)育樹。
1.6 產(chǎn)γ-氨基丁酸乳酸菌的篩選
1.6.1 菌株的準備
取-80 ℃保藏的乳酸菌甘油管,按4%的接種量接種于MRS液體培養(yǎng)基中,沾取菌液劃線純化,挑取單菌落于5 mL MRS液體培養(yǎng)基中,連續(xù)活化2次,最后一次培養(yǎng)至OD600=1備用。
1.6.2 薄層色譜法定性
參考Kwon等[9]的方法,稍作修改:將1.6.1中菌液按4%接種于5 mL MSG-MRS培養(yǎng)基中,培養(yǎng)48 h后,10000 r/min離心10 min,獲得上清液。各取1 μL 1 mg/mL MSG標準溶液、1 mg/mL與2 mg/mL GABA標準溶液,菌株上清液點樣于薄層色譜硅膠板上,在含有0.4 g茚三酮的正丁醇∶冰醋酸∶蒸餾水為3∶1∶1的100 mL展開劑中層析90 min,105 ℃顯色15 min。
1.6.3 Berthelot法初步定量
將1.6.2中方法獲得的上清液按照梁慧等[10]的方法進行定量。標準曲線的繪制稍作修改:取0.1 mg/mL(0.9 mg/mL MSG)、0.2 mg/mL(0.8 mg/mL MSG)、0.4 mg/mL(0.6 mg/mL MSG)、0.6 mg/mL(0.4 mg/mL MSG)、0.8 mg/mL(0.2 mg/mL MSG)、1 mg/mL(0 mg/mL MSG)的混合標準溶液繪制GABA標準曲線。
1.6.4 HPLC精確定量
參考Kantachote等[11]的方法,部分優(yōu)化。
柱前衍生:按照1.6.2中方法獲得上清液,取1 mL GABA標準溶液或適當稀釋的上清液冷凍干燥,將殘余物中加入1 mL乙醇-水-三乙胺(4∶4∶2)溶液和80 μL乙醇-水-三乙胺-苯異硫氰酸酯(6∶1∶1∶1),在室溫下避光反應(yīng)20 min,形成PITC-GABA,經(jīng)0.22 μm濾膜過濾,上樣分析。
色譜條件:色譜柱:Shimazu C18色譜柱(4.6 mm×250 mm),流動相A:1.4 mmol/L乙酸鈉緩沖溶液,并加入0.1%三乙胺和6%乙腈, pH調(diào)至6.1,流動相B:60%乙腈;洗脫程序:0%~100%流動相B;梯度洗脫50 min;0%流動相B,保持10 min,流速:1 mL/min,進樣量:10 μL。選取0.01,0.1,0.25,0.4,0.5 mg/mL的GABA標準溶液,繪制標準曲線。
1.7 耐酸能力分析與膽鹽耐受性評價
1.7.1 耐酸能力評價與添加谷氨酸鈉的影響
參考Leite等[12]的方法,稍作修改:將1.6.1中菌液在12000 r/min下離心10 min,去除上清液,并重懸于0.02 mol/L pH 6.5的PBS緩沖液中,稀釋至OD600=0.6,并以10倍稀釋接種于pH 2.5,3.0,4的MRS-THIO液體培養(yǎng)基中,以pH 6.5作為對照,在37 ℃培養(yǎng)0,1,2,3,4 h,分別進行活菌計數(shù)。存活率(%)=[人工胃液/腸液處理后活菌數(shù)(log CFU/mL)]/最初活菌數(shù)(log CFU/mL)。
基于對食品安全與風味考慮,食品中谷氨酸鈉推薦添加量為0.1%~0.8%[13],因此向MRS-THIO液體培養(yǎng)基中加入0.5%谷氨酸鈉,其他操作相同,進行活菌計數(shù),確定谷氨酸鈉對菌株耐酸能力的影響。
1.7.2 膽鹽耐受性評價
參考Delgado等[14]的方法,稍作修改:將1.6.1中菌液按照4%接種量接入含有0.15%、0.3%、0.4%牛膽鹽的MRS-THIO液體培養(yǎng)基中,在37 ℃下培養(yǎng),以不添加牛膽鹽MRS液體培養(yǎng)基作為對照,培養(yǎng)至OD620上升0.3個單位。對比添加牛膽鹽組與對照組,觀察生長情況與滯后時間。
1.8 益生特性評價
1.8.1 胃腸道模擬與添加谷氨酸鈉的影響
參考Guo等[15]的方法進行人工胃液與腸液的配制。食物在胃里的停留時間一般為3~4 h,流體食物一般為1~3 h。人體胃中pH由于飲食結(jié)構(gòu)的不同波動較大,一般在pH 3.0左右,而腸道內(nèi)pH值約為8.0,食物在腸道內(nèi)停留的時間一般為2~6 h[16],因此本文選擇在pH 3的人工胃液中處理3 h進行活菌計數(shù),之后連續(xù)接種于pH 8的人工腸液中處理6 h進行計數(shù)。另外,向人工胃液中加入0.5%谷氨酸鈉,其他操作相同,確定谷氨酸鈉對胃腸道模擬實驗的影響。存活率計算同1.7.1。
1.8.2 抗氧化能力
1.8.2.1 完整細胞組與無細胞提取物的制備
按照1.6.1中方法獲得菌液,8000 r/min離心15 min,去除培養(yǎng)基,用0.02 mol/L pH 7.2的PBS緩沖溶液洗去培養(yǎng)基,重復3次,最后重懸于PBS緩沖溶液,使OD600=1。一組作為完整細胞組進行測定,另一組進行超聲波破碎(總功率750 W,破碎效率75%,溫度4 ℃,破碎時間5 min,破碎6 s間歇3 s),破碎后10000 r/min離心15 min,取上清液于離心管中,在顯微鏡下鏡檢,至無完整細胞后立刻進行抗氧化實驗。
1.8.2.2 DPPH自由基清除能力
參考He等[17]的方法進行DPPH清除率實驗與計算。
1.8.2.3 羥自由基清除能力
參考Zhang等[18]的方法進行羥自由基清除率實驗與計算。
1.8.2.4 還原能力測定
參考楊靜秋[19]的方法進行乳酸菌還原能力實驗與計算。
1.8.3 抑菌能力
參考楊靖鵬等[20]的方法,以表皮葡萄球菌CICC10294、大腸桿菌CICC10662、金黃色葡萄球菌CICC10348、腸炎沙門氏菌CICC21482作為指示菌,利用雙層瓊脂牛津杯法進行實驗。
1.9 數(shù)據(jù)處理
本文利用Edraw進行細胞圖繪制;OriginPro 2016進行圖表的制作;利用SPSS進行顯著性分析;實驗均為3次平行3次重復,以平均值±標準偏差表示。
2 結(jié)果與分析
2.1 乳酸菌篩選結(jié)果
從新疆傳統(tǒng)乳制品奶酪、酥油、酸奶中共分離出163株菌株,其中有4株革蘭氏染色結(jié)果為陰性,9株過氧化氫酶實驗結(jié)果為陽性,則共有150株菌株疑似為乳酸菌。經(jīng)16S rDNA分子學鑒定主要涵蓋4個屬11個種,見圖1。主要為乳桿菌屬(Lactobacillus):短乳桿菌(Lactobacillusbrevis)63株、瑞士乳桿菌(Lactobacillushelveticus)26株、副干酪乳桿菌(Lactobacillusparacasei)12株、植物乳桿菌(Lactobacillusplantarum)10株、羅伊氏乳桿菌(Lactobacillusreuteri)5株、發(fā)酵乳桿菌 (Lactobacillusfermentum) 3株、鼠李糖乳桿菌(Lactobacillusrhamnosus)3株;腸球菌屬(Enterococcus):屎腸球菌(Enterococcusfaecium)8株、鳥腸球菌(Enterococcusavium)4株;片球菌屬(Pediococcus):戊糖片球菌(Pediococcuspentosaceus)13株;魏斯氏菌屬(Weissella):融合魏斯氏菌(Weissellaconfusa)3株。

圖1 部分乳酸菌的系統(tǒng)發(fā)育樹Fig.1 Phylogenetic tree of some lactic acid bacteria
分析發(fā)現(xiàn),新疆傳統(tǒng)奶酪、酥油、酸奶中優(yōu)勢菌屬主要為乳桿菌屬,其中短乳桿菌、瑞士乳桿菌為主要的優(yōu)勢菌種。劉曉蓉[21]對新疆不同地區(qū)傳統(tǒng)酸奶樣品中的乳酸菌進行分析發(fā)現(xiàn)乳桿菌屬為優(yōu)勢菌屬,德式乳桿菌為主要的優(yōu)勢菌種,張興吉[22]通過對青海、甘肅、新疆、內(nèi)蒙古、西藏地區(qū)的乳酸菌多樣性進行分析發(fā)現(xiàn),乳桿菌屬為主要的優(yōu)勢菌屬,其中青海地區(qū)以瑞士乳桿菌、發(fā)酵乳桿菌與德式乳桿菌保加利亞亞種為主要的優(yōu)勢菌種,甘肅與新疆地區(qū)以瑞士乳桿菌為主要的優(yōu)勢菌種,內(nèi)蒙古地區(qū)以開菲爾乳桿菌與瑞士乳桿菌為主要的優(yōu)勢菌種,西藏地區(qū)以副干酪乳桿菌、植物乳桿菌與德式乳桿菌保加利亞亞種為主要的優(yōu)勢菌種。與本文相比,在菌屬方面與其他研究者得到相同的結(jié)論,而在優(yōu)勢菌種上具有一定的差異,這可能是由于不同地區(qū)因海拔、溫度、氣候、季節(jié)、傳統(tǒng)工藝等不同,導致乳酸菌的分布具有一定的差異[23]。
2.2 產(chǎn)γ-氨基丁酸乳酸菌篩選結(jié)果
2.2.1 薄層色譜結(jié)果
從150株乳酸菌中共篩選得到57株乳酸菌具有GABA合成能力,主要為短乳桿菌52株、屎腸球菌3株、戊糖片球菌2株,發(fā)現(xiàn)短乳桿菌在新疆傳統(tǒng)奶酪、酥油、酸奶中為主要的GABA合成菌種,并且Wu等[24]得到相同的結(jié)論,在篩選出的產(chǎn)GABA乳酸菌中,短乳桿菌為主要的關(guān)鍵菌種,這充分證明短乳桿菌在傳統(tǒng)發(fā)酵乳制品中,與GABA的形成有著緊密的聯(lián)系。并且發(fā)現(xiàn)并不是所有的短乳桿菌、戊糖片球菌、屎腸球菌均能夠合成GABA,這充分證明同一菌種的菌株之間的變異性,菌株合成GABA的能力取決于菌株本身,而非同一菌種的菌株之間都具有合成GABA的能力[25]。

圖2 部分乳酸菌發(fā)酵上清液薄層色譜圖Fig.2 Thin layer chromatogram of some lactic acid bacteria fermentation supernatant
2.2.2 Berthelot法初步定量




圖3 Berthelot法定量結(jié)果Fig.3 Quantitative results by Berthelot method
通過Berthelot法繪制GABA標準曲線,見圖3中A。短乳桿菌NL8 GABA合成能力最強,達到(4.25±0.1) mg/mL。通過分析發(fā)現(xiàn),短乳桿菌GABA合成量均高于1 mg/mL,相比其他兩種菌種,在合成GABA方面具有較大的優(yōu)勢,Barrett等[26]通過對人腸道內(nèi)青春雙歧桿菌、嬰兒雙歧桿菌、齒雙歧桿菌以及短乳桿菌的GABA合成能力進行對比,發(fā)現(xiàn)短乳桿菌的合成量均高于其他菌種;Renes等[27]從巴西干酪中分離出產(chǎn)GABA的短乳桿菌以及乳酸乳球菌,發(fā)現(xiàn)短乳桿菌的合成量整體高于乳酸乳球菌;呂常江發(fā)現(xiàn)基于數(shù)據(jù)庫中基因組或功能基因注釋的分析顯示短乳桿菌通常具有相對較高的GABA合成能力。充分證明短乳桿菌在合成GABA方面是一種很有價值的菌種。
2.2.3 HPLC精確定量

圖4 HPLC峰圖Fig.4 HPLC peak figure
由于Berthelot法定量可能會受培養(yǎng)基中其他游離氨基酸的影響[28],因此利用HPLC法對短乳桿菌NL8進行精確測量,經(jīng)統(tǒng)計分析得回歸方程為y=140210996.8x-1323464.582,相關(guān)系數(shù)R=0.9993,證明GABA含量在0~0.5 mg/mL與峰面積具有良好的線性關(guān)系。
經(jīng)HPLC精確測定,短乳桿菌NL8 的GABA合成量為(4.17±0.05) mg/mL,相比通過紫外誘變提高GABA合成量的植物乳桿菌CICC6238(1.196 mg/mL)、從韓國泡菜中分離出的短乳桿菌OPY-1(0.825 mg/mL)和短乳桿菌OPK-3(2.023 mg/mL)[29]等具有相對較高的合成量。
2.3 耐酸能力分析與膽鹽耐受性評價
2.3.1 耐酸能力
以2.2.1中篩選得到的不同菌種具有GABA合成能力的戊糖片球菌NL56(產(chǎn)量為(1.51±0.08) mg/mL,記作NL56)與不具備GABA合成能力的瑞士乳桿菌NL13(記作NL13)作為短乳桿菌NL8(記作NL8)的參照菌株,見圖5。在未加谷氨酸鈉(MSG)時,NL8、NL56、NL13均具有相對較好的耐酸能力,在pH 3條件下處理4 h后,存活率分別為(80.7±1.25)%、(73.39±0.905)%、(76.47±1.05)%,在pH 2.5條件下處理4 h后,存活率分別約為(69.27±0.658)%、(59.31±1.15)%、(62.8±0.675)%。通過對比,NL8具有更好的耐酸能力(p<0.05),Wu等[30]的研究表明能夠合成GABA的乳酸菌一般具有較強的耐酸潛力,并建立一種新的方法,通過pH 6.5,1.5,4.0的連續(xù)酸化液體培養(yǎng),結(jié)合后期產(chǎn)氣現(xiàn)象對產(chǎn)GABA乳酸菌進行篩選,這表明產(chǎn)GABA乳酸菌一般具有較好的耐酸能力,但是可以發(fā)現(xiàn)NL13的耐酸能力強于NL56,這可能是由于乳酸菌具有多種耐酸機制且與谷氨酸脫羧酶的活性有一定的關(guān)系。



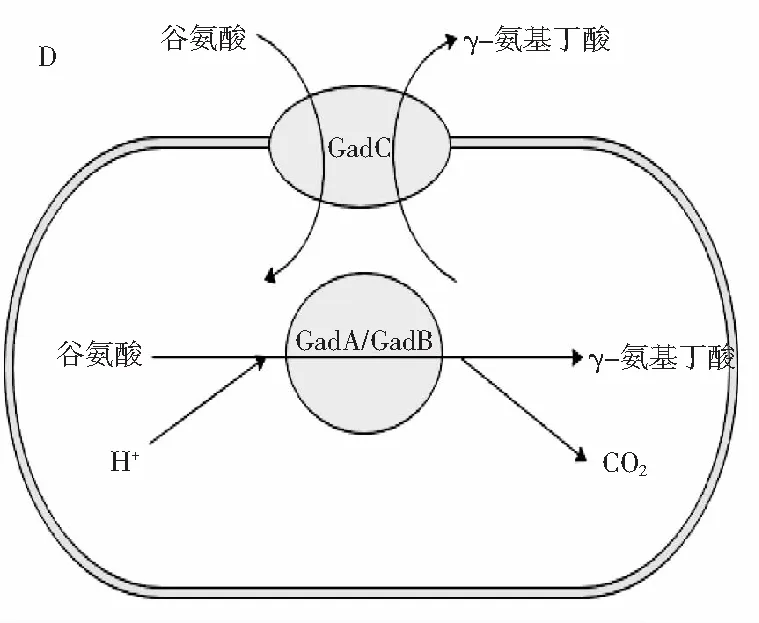
圖5 0.5%谷氨酸鈉對耐酸能力的影響Fig.5 Effect of 0.5% sodium glutamate on acid resistance
由圖5可知,當加入MSG后,NL8與NL56的存活率在pH 3或pH 2.5的條件下處理4 h后,均有顯著增加(p<0.05)。NL8在pH 3或pH 2.5處理4 h后,存活率分別增加了約8.02%、6.04%,NL56存活率分別增加了約4.43%、3.75%,而不具備GABA合成能力的NL13存活率未發(fā)生改變。這種現(xiàn)象主要是由于產(chǎn)GABA乳酸菌所特有的谷氨酸脫羧酶(GAD)系統(tǒng)所導致的,見圖5中D。細胞在受到外界環(huán)境酸脅迫的條件下,細胞膜上的Glu/GABA轉(zhuǎn)運蛋白被激活,使得外界的谷氨酸或其鹽類進入細胞,在胞質(zhì)中谷氨酸脫羧酶的作用下消耗胞內(nèi)H+并生成GABA,使得胞內(nèi)pH值回升,GABA由Glu/GABA轉(zhuǎn)運蛋白轉(zhuǎn)移至細胞外,由于GABA偏堿,導致胞外pH回升,從而使細胞內(nèi)外pH平衡,提高細胞在酸脅迫環(huán)境中的生存能力[31]。可以發(fā)現(xiàn),NL8的存活率相比NL64增加的更多,這可能是由于NL8具有更強的GABA合成能力,其谷氨酸脫羧酶活性更強,在酸脅迫條件下,使胞內(nèi)外pH平衡的效率更高,從而有更多細胞存活。
2.3.2 膽鹽耐受性


圖6 膽鹽耐受性評價Fig.6 Evaluation of bile salt tolerance
由圖6可知,NL8的膽鹽耐受能力相比NL56較弱,NL56在含有0.15%、0.3%、0.4%膽鹽濃度的環(huán)境中,生長滯后時間分別約為1,2.5,4 h,而NL8在0.15%膽鹽濃度下滯后時間約為4 h,膽鹽濃度為0.3%以上時,生長受到強烈抑制,10 h內(nèi)OD620值仍未上升0.3,這主要是由于膽鹽可以通過破壞乳酸菌細胞膜上的脂質(zhì)和脂肪酸從而引起細菌衰亡,而乳酸菌耐受膽鹽主要有兩種方式:通過分泌膽鹽水解酶降解膽汁鹽,使其正常生長以及胞外多糖包裹細胞,防止膽鹽的破壞[32]。NL8膽鹽耐受能力較差,因此如何增強細胞對膽鹽的耐受能力也變得尤為重要。
2.4 益生特性評價
2.4.1 胃腸道模擬耐受性
在2.3.1中通過對兩株菌的耐酸能力進行分析發(fā)現(xiàn),兩株菌均具有較好的耐酸能力,且通過添加0.5% MSG,在pH 3或pH 2.5處理3 h或4 h后,存活率均有顯著的提高,因此有必要確定MSG是否可以在胃腸道模擬過程中起到積極作用。


圖7 0.5%谷氨酸鈉對模擬胃腸道耐受能力的影響Fig.7 Effect of 0.5% sodium glutamate on simulated gastrointestinal tolerance
由圖7可知,在未加0.5%MSG的環(huán)境中,NL8經(jīng)人工胃液、腸液處理后存活率分別為(86.36±1.25)%、(80.5±1.05)%,NL56分別為(81.48±0.758)%、(71.08±0.865)%。史曉萌等通過對植物乳桿菌 CICC 6238以及從怡能菌粉中分離出的嗜酸乳桿菌NCFM和鼠李糖乳桿菌HN001進行胃腸道模擬試驗,最終存活率分別約為61.5%、79.4%、77.4%,對比發(fā)現(xiàn),NL8和NL56均具有較好的胃腸道耐受能力且NL8的耐受能力更強(p<0.05)。
在加入0.5% MSG后,經(jīng)人工胃液處理3 h、人工腸液處理6 h后,NL8和NL56的存活率相比未加MSG均顯著升高(p<0.05),這主要是由于添加MSG后增強了NL8與NL56的耐酸能力(如2.3.1所述),使得在人工胃液中處理3 h后細胞數(shù)增多,而人工腸液對乳酸菌的抑制作用是一定的,從而使得最終存活率顯著增加。因此,通過添加0.5% MSG可以有效改善NL8與NL56在人體胃腸道中的耐受情況。
2.4.2 抗氧化能力評價
通過對NL8與NL56的抗氧化能力進行分析發(fā)現(xiàn),NL8具有較強的DPPH自由基清除能力,其完整細胞與無細胞提取物分別達到約(25.59±0.54)%、(42.29±0.87)%。李默[33]從發(fā)酵肉制品中分離出30株乳酸菌并對完整細胞和無細胞提取物進行DPPH自由基清除能力的測定,發(fā)現(xiàn)清除范圍在0%~34.8%,而NL8的無細胞提取物高于這個范圍,并且相比嗜酸乳桿菌874(32.9%)、商業(yè)菌種嗜酸乳桿菌NCFM(22.6%)、植物乳桿菌ATCC14917(38.0%)[34]均高,則說明NL8具有較強的DPPH清除能力。



圖8 抗氧化能力評價Fig.8 Evaluation of antioxidant capacity
通過對比李默、劉珊春[35]對發(fā)酵肉制品、傳統(tǒng)發(fā)酵酸乳中乳酸菌羥自由基清除能力和還原能力的測定結(jié)果,NL8與NL56清除羥自由基能力和還原能力適中,在清除羥自由基方面并無明顯差異(p>0.05),在還原能力方面,NL56相比NL8具有更強的能力(p>0.05)。
2.4.3 抑菌能力評價

圖9 抑菌能力評價Fig.9 Evaluation of antibacterial ability
由圖9可知,NL8對大腸桿菌CICC10662與腸炎沙門氏菌CICC21482具有顯著的抑制作用(p<0.05),抑菌圈直徑分別為(18.62±0.58) mm和(18.13±0.56) mm,而對金黃色葡萄球菌CICC10348與表皮葡萄球菌CICC10294的抑菌作用顯著較弱(p<0.05),僅為(12.29±0.48) mm和(11.62±0.33) mm。Kim等[36]發(fā)現(xiàn),通過將短乳桿菌DF01的粗細菌素與大腸桿菌、鼠傷寒沙門氏菌共同孵育,能夠減少大腸桿菌與鼠傷寒沙門氏菌的生物膜形成,從而起到抑制生長的作用,證明大腸桿菌與沙門氏菌對短乳桿菌產(chǎn)生的細菌素較為敏感,因此抑制作用較強。
3 結(jié)論
從新疆傳統(tǒng)奶酪、酥油、酸奶各6份樣品中共分離出150株乳酸菌,主要涵蓋4個屬11個種,其中乳桿菌屬為優(yōu)勢菌屬,短乳桿菌與瑞士乳桿菌為主要的優(yōu)勢菌種;通過利用薄層色譜法對產(chǎn)GABA乳酸菌進行篩選,150株乳酸菌中共有57株乳酸菌具有合成GABA的能力,其中包括52株短乳桿菌、3株屎腸球菌、2株戊糖片球菌。利用Berthelot法與HPLC法進行定量發(fā)現(xiàn),短乳桿菌在合成GABA方面較有優(yōu)勢,且篩選出一株產(chǎn)量較高的菌株短乳桿菌NL8,產(chǎn)量達到(4.17±0.05) mg/mL。因此,選擇短乳桿菌NL8與具有GABA合成能力的戊糖片球菌NL56[(1.51±0.08) mg/mL]進行后續(xù)益生特性的評價。
短乳桿菌NL8相比戊糖片球菌NL56具有更好的耐酸能力(p<0.05),且與不具備GABA合成能力的瑞士乳桿菌NL13進行對比,通過添加0.5% MSG能夠使兩株菌在低pH的環(huán)境下耐受能力顯著增強(p<0.05);短乳桿菌NL8相比戊糖片球菌NL56在耐膽鹽能力上較弱,短乳桿菌NL8在0.3%膽鹽環(huán)境中生長開始受到強烈抑制,而戊糖片球菌NL56能夠較好地耐受膽鹽進行生長;經(jīng)人工胃腸液處理,短乳桿菌NL8表現(xiàn)出更強的耐受性,且通過添加0.5% MSG可使兩株菌在人工胃液環(huán)境中耐受性顯著增強,從而提高最終存活率(p<0.05);短乳桿菌NL8相比戊糖片球菌NL56具有更強的DPPH自由基清除能力(p<0.05),且兩株菌均具有一定的羥自由基清除能力與還原能力;短乳桿菌NL8能夠顯著抑制大腸桿菌與腸炎沙門氏菌的生長(p<0.05),而對金黃色葡萄球菌與表皮葡萄球菌的抑制作用較弱,戊糖片球菌NL56對指示菌均具有一定的抑制作用。
綜上所述,短乳桿菌NL8具有較強的GABA合成能力與優(yōu)良的益生特性,戊糖片球菌NL56雖然GABA合成量相對較低,但也具有較好的益生特性,且在今后的富含GABA發(fā)酵產(chǎn)品中,一般會殘留一定量的MSG,而本文已證明通過添加MSG可以增強兩株菌在胃腸道中的耐受能力,因此可作為優(yōu)良發(fā)酵劑用于后續(xù)功能性產(chǎn)品的研發(fā)。

