羽脈山黃麻叢枝病感病植株內源激素含量水平的變化
萬瓊蓮,王連春,巢凱翔,趙 靜,蘇 帆,何孟蘭,蔡 紅
(1. 玉溪師范學院化學生物與環境學院,云南 玉溪 653100;2. 云南農業大學農業生物多樣性與病蟲害控制教育部重點實驗室,云南 昆明 650201)
【研究意義】羽脈山黃麻(Trema levigataHand.-Mazz.),又名麻椰樹,喬木或灌木,速生常綠植物,耐干旱,是干旱河谷造林和綠化裸巖山地的優良先鋒樹種,具有生態防護等經濟開發價值[1-2]。植原體(Phytoplasma)是一類無細胞壁、寄生在植株韌皮部篩管細胞內或昆蟲體內的原核生物,是引起植物病害的一類重要病原[3]。羽脈山黃麻叢枝病由植原體引起,感病植株表現為叢枝、小葉、節間縮短和葉片卷曲黃化等癥狀,影響植物的生長發育,嚴重的可導致植株死亡。研究植原體對羽脈山黃麻內源激素的影響及該病害的發病機制有利于為該病害的防治提供理論指導,為植原體的深入研究奠定基礎。
【前人研究進展】植原體侵染會引起植株體內各類化學物質的顯著變化,內源激素水平的失衡,最終導致病害癥狀的產生,不同植原體侵染不同植物所引起的激素水平變化并不相同[4-5]。植原體致病性涉及到許多效應蛋白,它們對植物的生長等方面有著深刻而多樣的影響,這些效應蛋白可以觸發植物的生理反應,導致癥狀發展。受感染的植物可以表現出不同的癥狀,如芽的增殖(即叢枝病)。這種生理變化是植原體單一或同時對寄主激素、營養、發育、應激信號途徑及它們之間相互作用影響的結果[6-7]。不同激素之間通過復雜的、相互交叉的網絡協同或拮抗發揮作用,水楊酸和茉莉酸在植物中的功能已被廣泛研究,其他激素如赤霉素、生長素、細胞分裂素和脫落酸等,單獨或通過調控水楊酸、茉莉酸和乙烯信號分子轉導網絡參與植物與病原物互作,然而目前對各種植物激素信號傳導的分子機制仍然知之甚少[8-9]。了解寄主植物體內激素水平的變化有助于發現激素間的相互作用,進而探索可能的致病機理。
【本研究切入點】目前對植原體引起寄主激素水平變化的研究主要集中在某一類或某幾類激素上,對生長素的研究相對較多,為了更好地了解植原體對寄主的影響,可同時結合多種激素進行研究[10]。【擬解決的關鍵問題】本研究基于液相色譜串聯質譜(LC-MS/MS)法定性定量檢測植原體侵染羽脈山黃麻后植株體內六大類植物激素(生長素、細胞分裂素、脫落酸、茉莉酸、水楊酸、赤霉素)中25種激素含量水平的變化,從而結合多類激素探討植原體對寄主激素水平的影響及其內在規律和可能的致病機制。
1 材料與方法
1.1 試驗材料
于2018年在野外采集云南省新平縣羽脈山黃麻同一植株上未表現癥狀的正常健康莖葉及表現為典型叢枝癥狀的感病莖葉,立即冷凍在液氮中,之后于-80 ℃保存,并將樣品分為健康組和感病組。其中赤霉素檢測為1個生物學重復,其余激素檢測為3個生物學重復。
標準品與試劑:包括色譜純乙腈(ACN)和甲醇(MeOH)和MilliQ水等。所有標準品均購自BioBioPha和Sigma-Aldrich。標準品以10 mg/mL濃度用乙腈或甲醇作為溶劑溶解后,-20 ℃保存。質譜分析前用乙腈稀釋成不同梯度濃度。
1.2 樣品制備和提取
赤霉素檢測:稱取磨碎的樣品粉末300 mg,4 ℃ 冰上溶解于600 μL70%乙睛提取液溶液中。溶解后渦旋15 s, 4 ℃ 12 000 r/min離心5 min,常溫超聲儀中超聲30 min。渦旋15 s,4 ℃ 14 000 r/min離心10 min,吸取上清液200 μL,加入800 μL純水。使用1 mL甲醇和1 mL水沖洗活化SPE小柱。用3 mL80%甲醇洗脫樣品,洗脫液于30 ℃加熱模式下氮氣吹干。用200 μL 30%甲醇-水復溶樣品,渦旋15 s,過0.22 μm濾膜后保存于進樣瓶。
其他激素檢測:稱取120 mg溶解于1.2 mL80%甲醇-水提取液中。溶解后隔0.5 h渦旋1次,共渦旋6次,4 ℃冰箱過夜。4 ℃12 000 r/min離心15 min,吸取上清,35 ℃加熱模式下液氮吹干。用100 μL 30%甲醇-水復溶樣品,12 000 r/min離心15 min,吸取上清,并保存于進樣瓶中。最后用于LC-MS/MS分析。
1.3 色譜質譜采集條件
數據采集儀器系統主要包括超高效液相色譜(Ultra Performance Liquid Chromatography,UPLC)和串聯質譜(Tandem mass spectrometry,MS/MS)。液相條件主要包括:色譜柱,Waters ACQUITY UPLC HSS T3 C18(1.8 μm,2.1 mm×100 mm);流動相,超純水(0.04%甲酸);洗脫梯度,0 min水/乙腈(95∶5,V/V),11.0 min為5∶95(V/V),12.0 min為5∶95(V/V),12.1 min為95∶5(V/V),15.0 min為95∶5(V/V);流速0.35 mL/min;柱溫40 ℃;進樣量5 μL。赤霉素檢測流動相,水相為超純水(加入0.04%甲酸),有機相為乙腈(加入0.04%乙酸);洗脫梯度,0 min水/乙腈(80∶5,V/V),10 min為50∶95(V/V),11 min為35∶95(V/V),11.1 min為25∶5(V/V),14 min為10∶5(V/V);流速0.35 mL/min;柱溫45 ℃;進樣量5 μL。質譜條件主要包括:電噴霧離子源(electrospray ionization,ESI)溫度500 ℃(赤霉素為550 ℃),質譜電壓5 500 V(赤霉素為4 500 V),簾氣(curtain gas,CUR)35 psi。
2 結果與分析
2.1 激素的定性與定量分析
根據基于植物激素標準品構建的MWDB(metware database)植物激素數據庫,對質譜檢測數據進行定性分析。利用三重四級桿質譜的多反應監測模式進行定量分析。獲得不同樣本的激素質譜分析數據后,對色譜峰進行峰面積積分和積分校正,將積分峰面積代入不同激素標準曲線線性方程進一步計算得到實際樣本中激素的絕對含量,激素的回收率和儀器檢出限見表1。
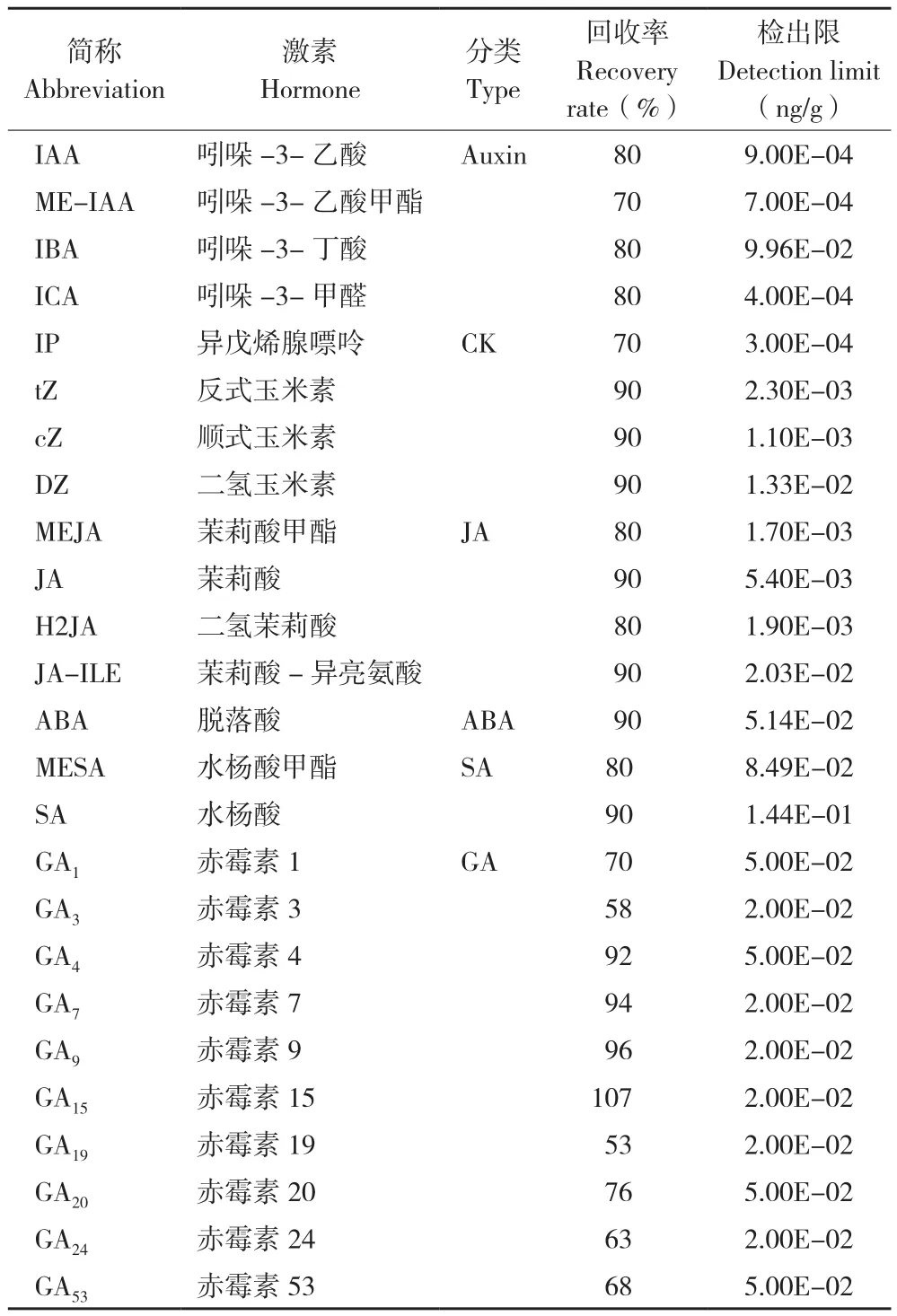
表1 激素的回收率和儀器檢出限Table 1 Recovery rates of hormones and detection limits of instruments
2.2 感病山黃麻植株五大類植物內源激素含量水平的變化
通過LC-MS/MS檢測得到植株中5類內源激素(生長素、細胞分裂素、脫落酸、茉莉酸、水楊酸)14種激素的含量(表2)。其中H2JA在健康樣品和感病樣品中含量均低于檢出限。cZ在感病樣品也未檢測到。14種激素在山黃麻中含量相對較高的有ABA、SA、MESA、JA-ILE和JA,其中MESA最高,在健康樣品中均值達9.3 μg/g以上,在感病樣品中均值達3.1 μg/g以上。健康樣品中的ME-IAA、IBA和MEJA及感病樣品中的ME-IAA含量在2 ng/g以上,其余種類激素基本低于1 ng/g。通過SPSS 20.0軟件分析表明IAA、IBA、ICA、MEJA、JA、JAILE、MESA、SA和ABA等9種激素含量在健康樣品和感病樣品之間存在極顯著差異,IP和tZ存在顯著差異,ME-IAA和DZ差異不顯著。對于這14種激素,感病樣品較健康樣品激素含量水平下降幅度多達70%以上,其中JA-ILE下降約93%,SA、JA、ICA和MEJA下降80%以上。總體來說感病植物激素水平除ME-IAA(約14%)、tZ(約18%)、DZ(約3%)小幅上升,IP小幅下降(約21%)外,其余都大幅下調。從激素類型來看,Auxin類除ME-IAA小幅上調,其余大幅下降,CK類除cZ減少明顯外,其余變化相對較小,最終感病樣品Auxin類降幅較CK類大,C(細胞分類素類)/A(生長素類)比值升高。JA類、SA類和ABA都顯著下降。
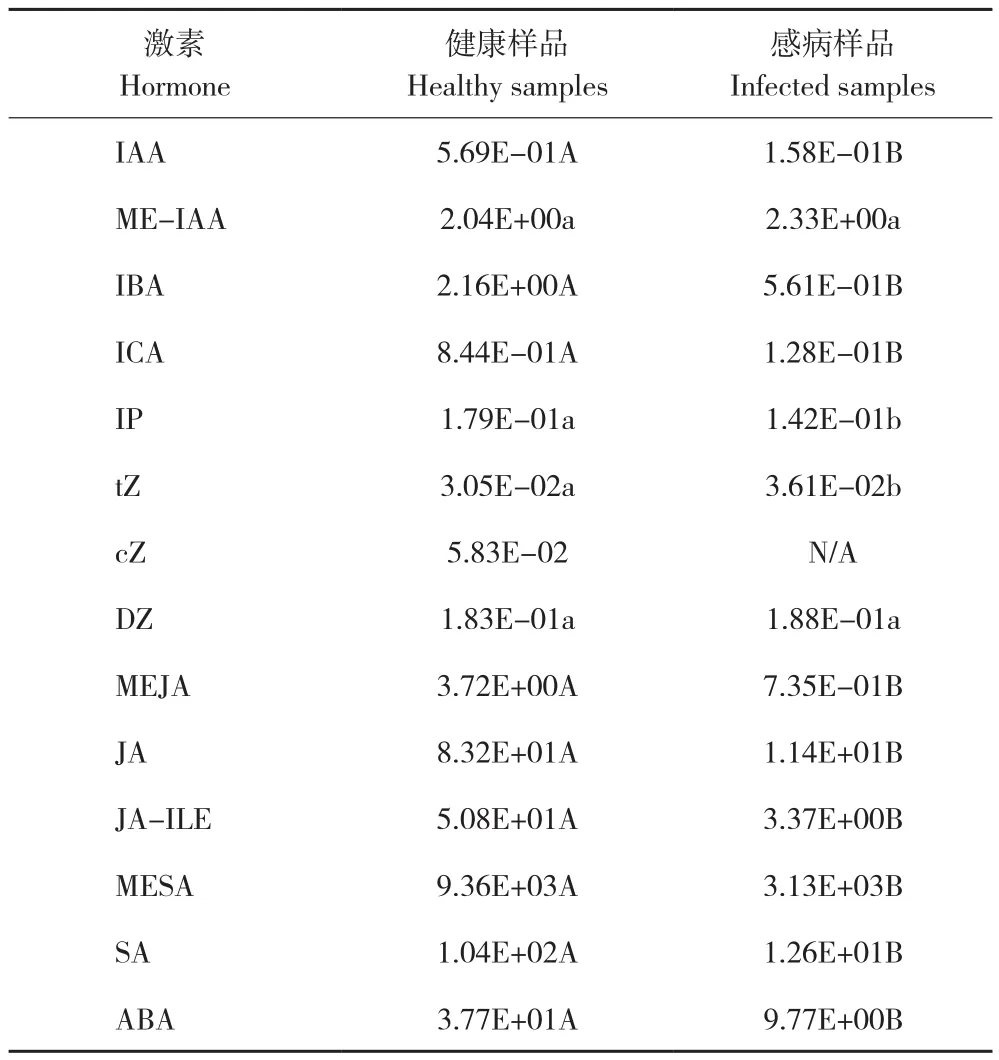
表2 山黃麻健康樣品和感病樣品中14種植物內源激素含量Table 2 Contents of 14 plant endogenous hormones in healthy samples and infected samples of Trema levigata(ng/g)
2.3 感病山黃麻植株赤霉素類植物內源激素含量變化
赤霉素類共檢測了10種,其中GA1、GA3、GA4、GA7、GA9和GA15在健康樣品和感病樣品中都有檢測到,GA19只在感病樣品中檢測到,GA20、GA24、GA53只在健康樣品中檢測到。檢測到的激素中GA1、GA3和GA19含量水平為上調,其他為下調。除GA1(上升約10%)、GA4(下降約0.3%)、GA24和GA53(都下降約0.08 ng/g)相對變化較小,其他赤霉素含量水平變化較大,其中GA3感病樣品較健康樣品增加10倍以上,GA19和GA20感病樣品較健康樣品分別增加約1 ng/g和減少約 4.5 ng/g,GA7、GA9和 GA15下降60%以上(表3)。
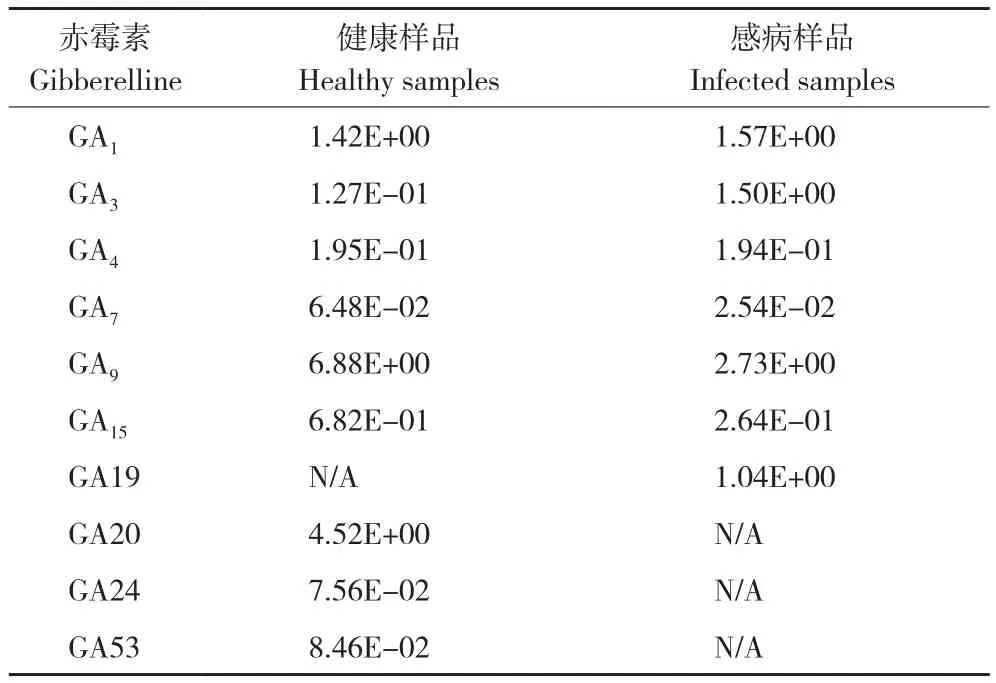
表3 山黃麻健康樣品和感病樣品中10種赤霉素含量Table 3 Contents of 10 gibberellins in healthy and infected Trema levigata(ng/g)
3 討論
3.1 山黃麻植原體對植株C/A比值的影響
本研究結果表明,感病羽脈山黃麻叢枝體內內源激素含量水平較健康植株發生了明顯變化,針對所檢測到的24種植物激素,六大類激素含量水平總體下降明顯,C/A比值升高。植物激素與植原體病害癥狀的發生可能是由于C/A失調而造成[11]。C/A的變化會導致植株頂端優勢消失,產生側芽,最后呈現叢枝癥狀。據報道,被植原體感染后植株C/A的變化主要有以下幾種情況:(1)細胞分裂素含量增加,同時生長素含量降低,如泡桐叢枝病[12]和棗瘋病[13];(2)細胞分裂素含量增加,生長素含量不變,如甘薯叢枝病[14];(3)細胞分裂素和生長素含量同時增加,C/A比值無明顯變化,如桑樹萎縮病[15]。前兩者導致C/A比值升高,誘導叢枝癥狀的產生。本研究與以上情況不同,感病樣品生長素和細胞分裂素含量同時降低,只是Auxin類降幅較CK類大,所以C/A比值升高,這可能是山黃麻叢枝癥狀產生的原因之一。
3.2 山黃麻植原體對植株生長素和細胞分裂素的影響
前期研究表明,山黃麻植原體侵染后會引起植株生長素含量的降低、升高或基本不變[11-15],本研究檢測了IAA、IBA、ICA和ME-IAA 4種生長素,前三者的含量水平顯著下降,可能是因為病株內過氧化物酶和IAA氧化酶活性增強導致其直接氧化分解所致,也可能是激素與氨基酸、糖等交聯使激素活性降低,或者是過氧化氫酶的活性受到抑制降低了植物生長素的生物合成[16-17]。生長素具有抗植原體活性,病原與寄主相互作用引起IAA水平增高可能是寄主抗病的一種表現,而IAA水平的降低則是一種致病表現[5,18],生長素水平降低導致植物節間縮短,頂端優勢消失,側芽萌生,有利于叢枝癥狀的產生。對于細胞分裂素,本次共檢測IP、tZ、cZ和DZ 4種細胞分裂素,前三者變化較為顯著,IP和cZ含量下降,tZ含量上升。研究表明棗樹植原體導致內源玉米素(ZT)含量提高,桑樹植原體同樣使寄主細胞分裂素的含量增加[13,15]。細胞分裂素(CK)水平的升高可能會引起叢枝病或增殖癥狀[17,19],但在本研究中4種細胞分裂素的變化趨勢并不相同,tZ的增加可能有利于側芽和叢枝的產生。
3.3 山黃麻植原體對植株赤霉素的影響
植原體對植物內源赤霉素的影響研究較多的是GA3。馬鈴薯紫頂植原體導致馬鈴薯GA3水平顯著降低[20],翠菊黃化植原體引起翠菊GA水平的降低[21],植原體侵染棗樹后GA含量提高,且與發病程度呈正相關[12],另一研究則表明棗樹被侵染后GA3無明顯變化[22]。桑樹植原體使病株中的GA3和GA4含量都明顯增加[15]。研究表明從赤霉菌及其他病菌中分離的GA以GA3或GA4為主,而高等植物體內GA1是主要活性物質,GA3含量則很低[5]。本試驗檢測的10種赤霉素中GA3上調幅度大,GA7下降明顯,GA3含量的上調可能是由植原體分泌引起的,同時GA3和GA7具有生物活性[23],GA3的上調或者GA7的下降可能和癥狀的關系最為密切。游離態赤霉素和結合態赤霉素之間能夠根據不同發育時期的需求相互轉化,因此其他赤霉素的變化可能導致GA3和GA7的變化。赤霉素具有提高生長素水平、形成頂端優勢的作用,GA3的上調沒有使生長素含量增加,這可能與其他激素或者是兩者生物合成交叉途徑中的關鍵酶或基因受到了植原體的影響有關。
3.4 山黃麻植原體對植株ABA、SA和JA的影響
前期研究表明,植原體侵染棗樹后,ABA含量有所提高[13,24],有的則無明顯變化[22]。本研究中ABA含量下降可能是由于采樣時山黃麻處于發病前期,叢枝生長旺盛,ABA含量減少有利于減輕它對芽的抑制作用。當植物受到病原菌侵染時,SA和JA的含量會發生變化[25],從而起到防御或抑制病害的作用,SA被認為是植物對病原菌產生抗性反應的信號分子,JA則是植物對昆蟲取食和機械損傷產生抗性反應的信號分子,SA可直接殺傷病原,積累后可激活SAR(系統獲得抗性),如果SA不能正常積累,植株對病原菌的入侵會變得更加敏感[26-27]。植原體效應子可以植物細胞核為靶點,破壞植物轉錄因子的穩態導致植株形態變化,使JA合成減少,抑制JA介導的防御,并改變植物和昆蟲載體的互作[28]。因此降低SA和JA的含量水平可能是植原體入侵寄主植物的一種手段,這樣更有利于植原體本身的寄生和傳播,具體的作用機制還需進一步研究。
4 結論
植原體對植物內源激素的影響與植物抗感程度[29]、植原體種類和寄主植物[10]有關,植原體侵染可影響寄主激素合成相關基因而導致相應激素含量水平的變化[30-31]。病害癥狀的產生是各種致病因子綜合影響的結果,這其中有主要致病因子,也會產生主要癥狀,同時主要因子會受到其他因子的調控,并使植株產生伴隨癥狀。山黃麻叢枝病的典型癥狀為叢枝小葉,本研究檢測山黃麻感病植株中六大類植物內源激素,發現每一類激素含量水平都發生了明顯變化,但具體是哪些激素在其中發揮主要作用,還需進一步研究。同時要考慮激素間的相互作用,可以從植物病理學、生理學、生物化學和分子生物學等方面來研究其致病機制。對于植原體的防治,補充外源激素可以起到一定效果,而且激素類型不同效果不同[18,32]。本研究得出山黃麻感染植原體后激素水平的變化情況,可以為山黃麻叢枝病的激素防治提供指導,同時為山黃麻叢枝病致病機理的研究奠定基礎。

