分光光度法測定水中磷酸鹽的不確定度評估


關鍵詞:磷酸鹽;不確定度
通過對分光光度法測定水中磷酸鹽的不確定的分析和評定,發現實驗過程中哪些環節對實驗結果有比較重要的影響,指導實驗室人員在分析過程中提高數據的準確性,在樣品的檢測結果接近限值時,測量的不確定度可以對樣品是否超標或符合要求提供重要參考[1]。
1 測量步驟簡介及說明
分取適量經濾膜過濾或消解的水樣(使含磷不超過30μg)加入50mL比色管中,用水稀釋至標線。向比色管中加入1mL10%抗壞血酸溶液,混勻。30s后加2mL鉬酸鹽溶液充分混勻,放置15min進行顯色后測量。減去空白實驗的吸光度,并從校準曲線上查處含磷量[2]。本報告中以直接取樣50mL測量為例,且測量過程中為經稀釋。
2 磷酸鹽含量的計算數學模型
3 不確定度的計算模型
4 不確定度的評定
4.1 取樣的相對合成標準不確定度ur(V)
取樣體積為50mL,不確定度主要來源為取樣所用的50mL單標移液管的不確定度,不確定度主要來自于校準、重復性、溫度這三大方面。
50mL單標移液管校準證書上查得擴展部確定度為:
實驗中所使用的玻璃器皿在20℃校準,實驗室溫度在(20±5)℃之間變化,由于玻璃器皿的體積隨溫度的變化遠小于所盛取的溶液體積的變化,這里只考慮溶液體積的變化,并以水來計算,水的體積膨脹系數為2.1×10-4/℃,按矩形分布,受溫度影響的不確定度為:
相對合成不確定度:
4.2 樣品測量含量的相對合成標準不確定度
儀器測量所得的樣品含量的不確定度主要來源有標準溶液的不確定度,標準溶液稀釋過程產生的不確定度和標準曲線的不確定度,所以相對合成標準不確定度可以表示為:
4.2.1 磷酸鹽標準物質的相對標準不確定度ur(標)
標準物質磷酸鹽溶液(102808)的濃度為C標=500mg/L,不確定度為1%,按矩型分布(k=)可得磷酸鹽標準溶液的不確定度:
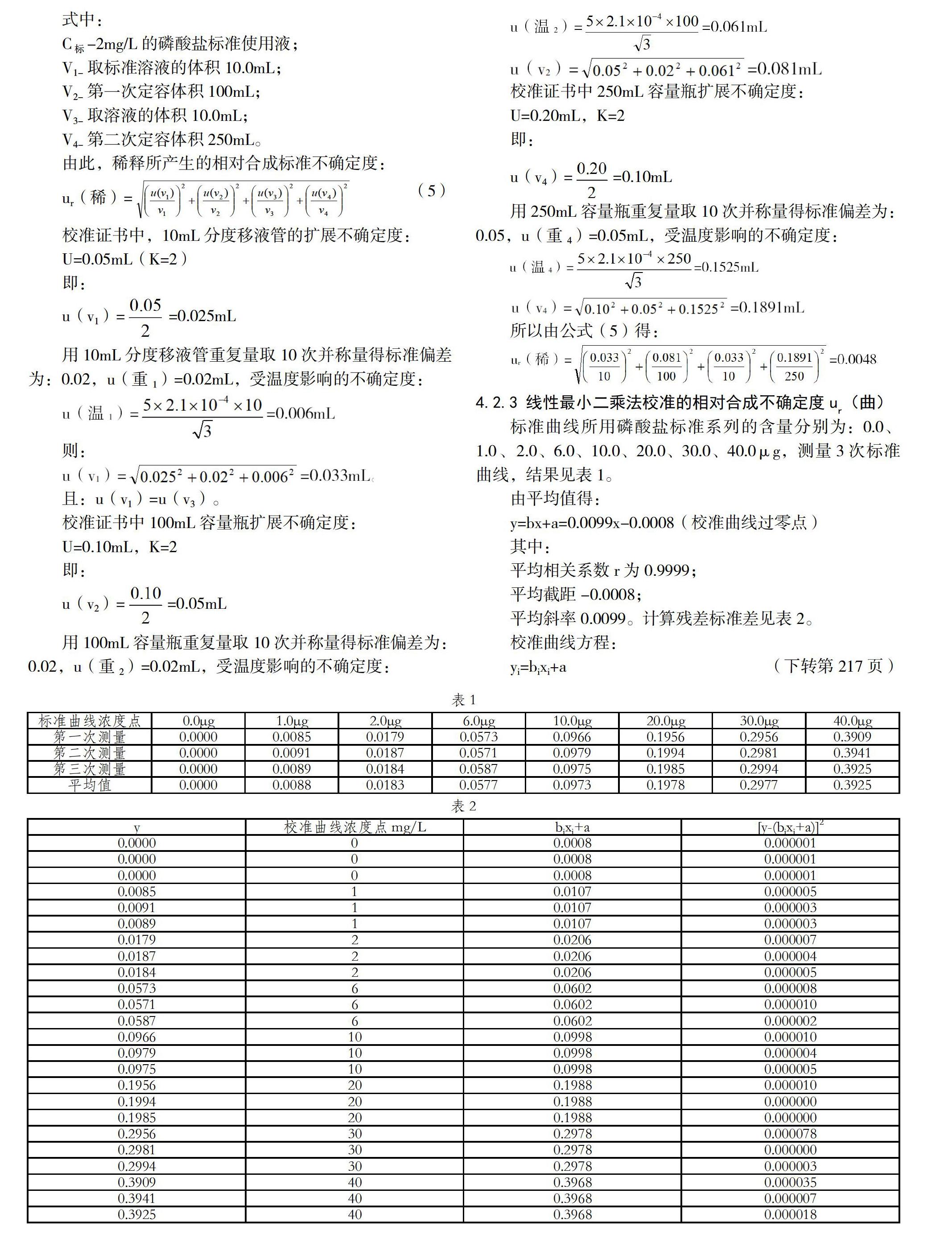
4.2.2 磷酸鹽標準溶液稀釋過程的相對合成不確定度ur(稀)
標準物質的稀釋過程:取10.0mL磷酸鹽標準溶液定容至100mL得到濃度為50mg/L,再從稀釋后的標液中取10mL定容至250mL得到2mg/L的磷酸鹽標準使用液。
4.2.3 線性最小二乘法校準的相對合成不確定度ur(曲)
標準曲線所用磷酸鹽標準系列的含量分別為:0.0、1.0、2.0、6.0、10.0、20.0、30.0、40.0μg,測量3次標準曲線,結果見表1。
4.2.4 樣品測量濃度的相對合成標準不確定度
從以上計算可以得出,測定水中磷酸鹽的不確定主要來源為校準曲線測量過程的不確定度。
4.2.5 相對合成標準不確定度
5 合成標準不確定度
7 結果表示
本次水樣測量磷酸鹽的含量結果可表示為:
8 結論
通過評估分光光度法測定水中磷酸鹽的不確定度,得出主要來源是校準曲線的繪制及實驗分析過程的稀釋操作過程。在實際分析過程中,控制好校準曲線的繪制過程及標準溶液的稀釋,可以一定程度減少不確定度的產生,提高數據的準確性,在實際工作及檢測結果表征中,具有重要的參考意義。
參考文獻:
[1]孫建云,王潔,李擁軍.磷鉬藍分光光度法測定食品中磷酸鹽含量測量不確定度評定[J].醫藥衛生,2009,38 (3):207-208.
[2] GB11893-1989.水質 總磷的測定 鉬酸銨分光光度法[S].北京:國家環境保護總局,1989.
作者簡介:
李小蘭(1986- ),女,工程師,研究方向:環境檢測。

