大豆皂苷B組分的分離純化研究
易清清 孟擁軍 常 慶 梁冬雨 章雨婷 姜國偉
(上海健康醫學院附屬嘉定區中心醫院中心實驗室1,上海 201800)(上海健康醫學院附屬嘉定區中心醫院藥劑科2,上海 201800)(上海健康醫學院藥學院3,上海 201318)
工業生產大豆異黃酮的過程會產生很多廢水,這些廢水中含有大豆皂苷組分[2]。大豆皂苷是一種生物活性物質,近年來,國內外許多專家、學者對大豆皂苷的生物學、生理學和藥理學進行了研究,發現大豆皂苷對人體不僅無毒害作用,而且具有許多有益的生理功能。大豆皂苷具有多種生理活性和良好藥理作用,具有抗癌、調節免疫功能、降低血清中膽固醇含量、防治心血管疾病、抗菌、抗病毒、護肝、減肥等多重生理功效[1]。結構不同的大豆皂苷生物活性不同,其中大豆皂苷B組分具有更強的生物活性[3,4]。大豆皂苷B組分是由低聚糖及齊墩果烯三萜縮合形成的一類化合物[5]。大豆皂苷A組分和大豆皂苷B組分具有極其相似的化學性質,因此單獨分離和選擇性利用大豆皂苷B組分非常困難[6]。本研究探索了從工業生產大豆異黃酮的廢水中分離純化大豆皂苷B組分的工藝參數,從而建立大豆皂苷B組分的分離純化工藝。
1 儀器和試劑
1.1 儀器
RE-52C旋轉蒸發儀;KQ-25OB回流冷凝管;HP1100高效液相色譜儀;2X-8旋片式真空泵;WMZK-01溫度指示控制儀。
1.2 試劑
98%磷酸、碳酸氫鈉、碳酸氫鈉、均為分析純;甲醇、冰醋酸,均為色譜純;98% A組分苷元標準品;97% B組分苷元標準品;AB-8大孔樹脂;D101型大孔樹脂。
2 方法
2.1 分離純化方法
2.1.1 酸堿度對分離純化的影響
由于大豆異黃酮廢液含有一些小的多肽和黏多糖類物質,當酸性太強時,會導致廢液變性,從而使廢液變成黏稠狀,不易上柱吸附[7]。此外,大豆皂苷在堿性溶液中不穩定,而且強堿性也會使一些小肽和蛋白質變性,故pH的選擇應為弱酸性,本研究選取pH為5、7兩個水平。
2.1.2 洗脫試劑的選擇
選用極性較弱的甲醇或乙醇溶液進行洗脫。
2.1.3 大孔樹脂的選擇
根據文獻和實驗室基礎條件[8],考察選用D101和AB-8大孔樹脂。皂苷的苷元部分為疏水性,能被非極性樹脂所吸附,同時皂苷分子較大,故應選擇孔徑較大的非極性吸附樹脂。AB-8型大孔吸附樹脂是苯乙烯型弱極性共聚體,比表面積高于DM-301,最適宜水溶性、弱極性物質的分離和純化。D101大孔吸附樹脂是一種具有多孔海綿狀結構人工合成的聚合物吸附劑,依靠樹脂骨架和被吸附的分子(吸附質)之間的范德華力,通過樹脂巨大的比表面積進行物理吸附,從而從水溶液中分離純化水溶性較差的有機大分子。
以樹脂選擇、 上柱pH、洗脫劑作為考察因素,各取2個水平,以測定提取產物的總質量和大豆總皂苷B組分的含量為指標,選用析因設計表進行實驗(表1)。收集80%洗脫劑的洗脫物,旋轉蒸發儀蒸干,通過HPLC檢測計算大豆皂苷B組分的含量。

表1 不同考察因素的分離純化方法
2.2 分離純化步驟
將直徑為4.5 cm,高度為80 cm的玻璃柱固定,下面放入紗布包的玻璃珠。然后將大孔樹脂導入含水燒杯中,攪拌均勻,緩慢倒入玻璃柱中。加入適量大孔樹脂,一般以加到玻璃柱的2/3左右為宜。每根玻璃柱約裝入500 g大孔樹脂。
調廢水pH:根據表1,用3%~5%左右的HCl和NaOH溶液來調節廢液至所需的pH值。
廢液上柱:2 500 mL(約2.5倍柱體積)廢液沿柱壁分批加入相應的大孔樹脂柱,廢液流速約為20 mL/min。分批上柱過程中小心廢水留空,避免色譜柱產生氣泡。
解吸附:根據表1,先用去離子水4 000 mL(約4倍柱體積)洗脫,至洗脫液為無色;再用體積分數為10%相應溶劑2 500 mL(約2.5倍柱體積)洗脫;最后用體積分數為80%的相應溶劑1 000 mL(約1倍柱體積)洗脫,收集中間部分約500 mL 的洗脫液(前100 mL和后400 mL舍棄)。
蒸干:利用旋轉蒸發儀分批將500 mL洗脫液濃縮蒸干,蒸發過程中避免暴沸。收集圓底燒瓶中的固體產物,于研缽中研磨至細粉狀,稱重,儲存備用。
2.3 結晶純化
考察因素[9]:pH、乙醇體積分數、料液比。
pH選擇:根據大豆皂苷的穩定性,選取pH為5、7。
乙醇體積分數:B組分大豆皂苷不溶于冷的低濃度乙醇溶液,而A組分大豆皂苷和其他的一些雜質能夠溶解,故選取純水、體積分數為10%乙醇、體積分數為20%乙醇作為考察對象。
料液比:每2 g樣品分別加入12 mL、18 mL、24 mL相應溶劑進行結晶。
結晶實驗設計:以乙醇濃度、溶劑pH、料液比作為考察因素,各取3個水平,以測定純化產物的總質量和大豆總皂苷B組分的含量為指標,選用正交設計表進行實驗(表2)。

表2 不同考察因素的純化方法
根據表2,用1%的HCl和NaOH溶液,調節結晶溶劑的pH至所需值。選用2.2中純化的產物作為結晶的初始樣品。分別取2 g初始樣品加入相應的溶劑中,各組大豆皂苷溶液放入700 W超聲波儀中溶解40 min,隨后放入80 ℃水浴鍋中溶解2 min,靜置冷卻至室溫,通過布氏漏斗抽真空過濾,收集濾紙上的不溶物,最后真空抽濾機蒸干,收集蒸干后的固體,研磨成細粉。采用HPLC對大豆皂苷B組分的含量進行檢測。
3 結果與討論
3.1 沸水蒸干后產物的HPLC圖譜
A組分大豆皂苷標準品圖譜如圖1a;B組分大豆皂苷標準品圖譜如圖1b;廢水蒸干后產物的HPLC圖譜如圖1c。由圖1可知,A組分大豆皂苷標準品出峰時間為8.684 min,峰面積為407.481 40;B組分大豆皂苷標準品出峰時間為21.740 min,峰面積為552.607 79。沸水蒸干之后所得粉末取樣量為41.53 mg,其中A組分皂苷的出峰時間為8.506 min,計算得質量分數為3.62%;B組分皂苷的出峰時間約為21.3 min,計算得質量分數為0.67%。

圖1 廢水蒸干后產物的HPLC圖譜
3.2 分離純化產物的HPLC圖譜
圖2為1.1~1.8分離純化方法所得產物的HPLC圖譜。表3為1.1~1.8分離純化方法所得產物中大豆皂苷A組分和大豆皂苷B組分的含量。故綜合考慮,選擇的最佳大孔樹脂分離純化工藝為1.3,即調節廢水pH=5,選取D101樹脂進行吸附,最后用乙醇解脫吸附。

圖2 分離純化產物的HPLC圖譜

表3 不同分離純化方法中大豆皂苷B組分的含量
3.3 結晶純化產物的HPLC圖譜
圖3為2.1~2.6結晶純化方法所得產物的HPLC圖譜。表4為2.1~2.6結晶純化方法所得產物中大豆皂苷A和大豆皂苷B的含量。從結晶實驗數據可以看出,結晶純化工藝2.3為最佳的工藝路線,即2 g分離純化產物加入到24 mL,pH5的20%乙醇中進行結晶純化。

圖3 結晶純化產物的HPLC圖譜
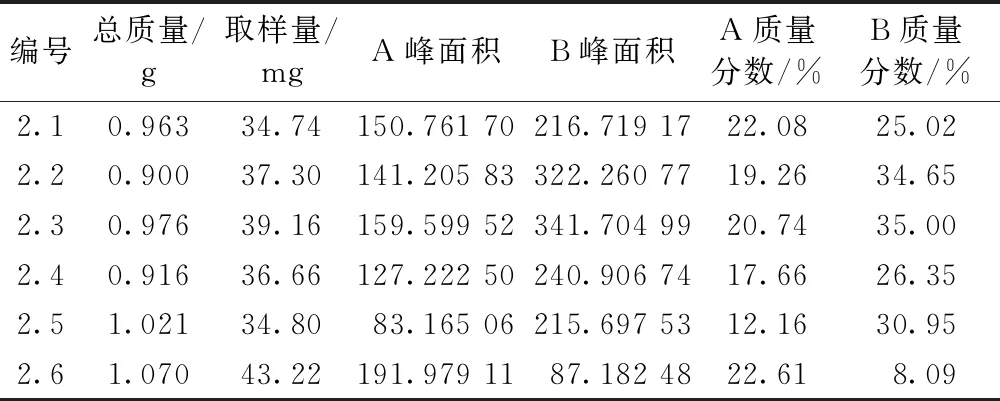
表4 不同結晶純化方法中大豆皂苷B組分的含量
采用大豆皂苷的分離純化技術及結構分析測定方法,可以得到較多較純的大豆皂苷,并應用于食品、化妝品和藥品等領域[10,11]。大豆皂苷可阻止由脂質過氧化引起的皮膚疾病, 減少皮膚病的發生。日本學者已經研究出含有大豆皂苷的化妝品,其實用效果已經得到證實[12]。大豆皂苷具有發泡性和乳化性,可在食品中作為添加劑。此外,從工業廢水中分離純化大豆皂苷還具有較大的經濟和環保價值。因此,對大豆皂苷B組分從工業廢水中分離純化的工藝進行深入研究,通過改進分離純化和結晶純化工藝以獲得高質量高純度的產物,具有重大的研究意義。
4 結論
研究了分離純化工藝參數對從生產大豆異黃酮的廢水中分離純化大豆皂苷B組分的影響,并在此基礎上,探索建立了一種簡單經濟且可適用于以廢水為原料生產大豆皂苷B組分的制備工藝。建立了大豆皂苷B組分的分離純化方法,采用大孔樹脂純化大豆皂苷 B 組分,選用D101型樹脂為層析柱的填充料,以水-乙醇體系進行洗脫,得到純度為18.96%的大豆皂苷 B 組分,此時主要雜質為大豆皂苷 A 組分。建立了大豆皂苷 B 的結晶純化方法,一些未知雜質和大豆皂苷 A 組分較易溶解于低濃度乙醇,通過利用低濃度的乙醇進行結晶以獲得純度更高的大豆皂苷 B 組分,純度可提高至35%。
本研究建立的大豆皂苷B組分的分離純化方法,雖然能夠提高大豆皂苷B組分的含量,但與預期的純度還有很大差距,還需要進一步的研究探索。

