響應面法優化藜麥糠中多酚超聲提取工藝及其抗氧化活性
趙 強 劉 樂 楊 潔 范建鳳 趙二勞
(忻州師范學院化學系,忻州 034000)
藜麥(ChenopodiumquinoaWilld.)又名藜谷、南美藜等,為藜科藜屬雙子葉植物,原產于南美洲安第斯山區[1]。藜麥具有豐富而獨特的營養成分,被譽為“超級谷物”“營養黃金”[2-4]。我國1987年開始引種,現已在山西、陜西、青海、四川和寧夏等地規模化種植[5],資源較為豐富。研究表明[6,7],藜麥中含有多酚,且藜麥糠中多酚含量更高。多酚是植物次生代謝產物,具有清除自由基抗氧化、抗腫瘤、抑菌、降血脂以及調節人體免疫力等多種功能活性[8-10],在食品、醫藥、保健品等領域應用前景廣闊。但目前,藜麥糠作為藜麥加工中的副產品,多用作飼料或廢棄,造成資源的極大浪費。因此,研究藜麥糠中多酚提取及其生物活性,開發藜麥糠多酚功能產品,對于提升藜麥綜合利用效益和經濟價值,提高藜麥科技附加值,促進藜麥產業的發展,具有重要的實際意義。
目前,已有一些有關藜麥多酚的研究報道,如盧宇等[8]、闕淼琳等[11]研究了藜麥種子多酚的乙醇浸泡提取工藝,多酚提取率為2.27 mg/g左右;趙寶堂等[12]、陳樹俊等[13]研究了藜麥種子多酚的超聲輔助提取工藝及其抗氧化活性,多酚提取率為3.33 mg/g以上;陸敏佳等[1]則研究了幾種藜麥葉片中多酚的提取工藝及其抗氧化活性,多酚提取率為3.815 mg/g以上。但有關藜麥糠中多酚的超聲輔助提取鮮見報道。基于超聲輔助在天然產物活性成分提取中具有提取時間短,成本較低,提取率高,不破壞有效成分活性的技術優勢[14-16],本文研究藜麥糠中多酚的超聲輔助提取,采用單因素實驗結合響應面分析的方法優化提取工藝,并以DPPH·和·OH清除率為指標評價其抗氧化活性,為藜麥糠多酚的深入研究和開發應用提供參考。
1 材料與方法
1.1 材料與儀器
藜麥糠:山西靜樂藜麥種植基地,粉碎過60目篩,石油醚浸泡脫脂24 h后,烘箱中60烘干,裝瓶保存備用。
1,1-二苯基-2-苦肼基(DPPH·)、福林酚試劑;沒食子酸、無水乙醇、2,6-二叔丁基對甲酚(BHT)、水楊酸、30%過氧化氫、硫酸亞鐵、碳酸鈉:分析純;實驗用水為二次去離子水。
KQ-400KDE型高功率數控超聲波清洗器,723型可見分光光度計,SHZ-2D循環水式真空泵,QE-200型藥材粉碎機。
1.2 方法
1.2.1 超聲輔助提取工藝
工藝流程:預處理后藜麥糠→加入溶劑→超聲輔助提取→抽濾→濾液定容→多酚提取液。
主要工藝參數:預處理后藜麥糠用量1.0 g,超聲輔助提取1次,提取液定容體積100 mL。
1.2.2 藜麥糠多酚超聲輔助提取單因素實驗1.2.2.1 提取溫度對藜麥糠中多酚提取率的影響
以50%乙醇為提取劑,料液比(g/mL)1∶35,超聲功率200 W,分別在溫度20、30、40、50、60、70 ℃條件下,超聲輔助提取30 min,研究溫度對藜麥糠中多酚提取率影響,確定最適提取溫度。
1.2.2.2 超聲功率對藜麥糠中多酚提取率的影響
以50%乙醇為提取劑,料液比(g/mL)1∶35,提取溫度30 ℃,分別在超聲功率160、200、240、280、320、360 W條件下,超聲輔助提取30 min,研究超聲功率對藜麥糠中多酚提取率影響,確定最適超聲功率。
1.2.2.3 提取時間對藜麥糠中多酚提取率的影響
以50%乙醇為提取劑,料液比(g/mL)1∶35,提取溫度30℃,超聲功率200 W,分別超聲輔助提取10、20、30、40、50、60 min,研究提取時間對藜麥糠中多酚提取率影響,確定最適提取時間。
1.2.2.4 料液比對藜麥糠中多酚提取率的影響
以50%乙醇為提取劑,提取溫度30 ℃,超聲功率200 W,分別在料液比(g/mL)1∶25、1∶35、1∶45、1∶55、1∶65和1∶75的條件下,超聲輔助提取30 min,研究料液比對藜麥糠中多酚提取率影響,確定最適料液比。
1.2.2.5 乙醇濃度對藜麥糠中多酚提取率的影響
分別以40%、50%、60%、70%、80%和90%乙醇為提取劑,在料液比(g/mL)1∶35,提取溫度30 ℃,超聲功率200 W條件下,超聲輔助提取30 min,研究乙醇濃度對藜麥糠中多酚提取率影響,確定最適乙醇濃度。
1.2.3 藜麥糠多酚超聲輔助提取的響應面優化實驗
根據單因素實驗結果,選取對藜麥糠多酚提取率影響較大的乙醇濃度(A)、提取時間(B)、超聲溫度(C)和料液比(D)4個因素,進行4因素3水平響應面實驗,優化藜麥糠多酚超聲輔助提取工藝。選定的因素及水平見表1。

表1 Box-Benhnken實驗因素與水平
1.2.4 藜麥糠中多酚提取率測定
參考文獻[17,18]方法,以沒食子酸為標準對照品,采用Folin-Ciocalteau法測定藜麥糠多酚提取率。
1.2.4.1 沒食子酸標準曲線的繪制
精密吸取濃度為13.0 μg/mL的沒食子酸標準液0.0、1.0、2.0、3.0、4.0、5.0、6.0、7.0 mL,分別置于10 mL比色管中,都加入10%碳酸鈉溶液1.5 mL和福林酚試劑 1 mL,搖勻,去離子水定容至刻度,40 ℃水浴中避光反應40 min后,冷卻至室溫,在選定的最大波長765 nm處測定其吸光度。以沒食子酸對照品濃度為橫坐標,吸光度值為縱坐標繪制標準曲線。
1.2.4.2 藜麥糠中多酚提取率測定
精密移取適當稀釋后的藜麥糠提取液1.0 mL,按1.2.4.1的沒食子酸標準曲線方法測定其吸光度。按公式計算多酚提取率。

式中:C為提取液中多酚濃度/μg /mL;V為稀釋后藜麥糠多酚提取液總體積mL;m為藜麥用量/mg。
1.2.5 藜麥糠多酚對·OH的清除率
實驗參考文獻[19,20]的方法,采用水楊酸法測定藜麥糠多酚和BHT對·OH的清除率并計算其IC50。IC50指對·OH的清除率達到50%時,所需藜麥糠多酚或BHT溶液濃度,IC50值越小,對·OH清除率越大,抗氧化活性越強。
清除率=[1-(Ai-Aj)/A0]×100%
式中:Ai為·OH溶液與加入一定量藜麥糠多酚提取液或BHT溶液體系的吸光度;Aj為僅藜麥糠多酚提取液或BHT溶液體系的吸光度;A0為僅·OH溶液體系的吸光度。
1.2.6 藜麥糠中多酚對DPPH·清除率的測定
實驗參考文獻[7,21]的方法,測定藜麥糠多酚和BHT對DPPH·的清除率并計算其IC50。
清除率=[1-(A1-A2)/A0]×100%
式中:A1為DPPH·溶液與加入一定量藜麥糠多酚提取液或BHT溶液體系的吸光度;A2為僅藜麥糠多酚提取液或BHT溶液體系的吸光度;A0為DPPH·溶液體系的吸光度。
1.3 數據處理
數據均為3次測定的平均值,作圖用Excel,顯著性用SPSS分析(P<0.05,差異顯著;P<0.01,差異極顯著),Box-Behnken進行響應面分析。
2 結果與分析
2.1 沒食子酸標準曲線
沒食子酸標準曲線如圖1。沒食子酸回歸方程:A=0.081 5C+0.010 6,R2=0.999 2,沒食子酸在0.0~9.1 μg /mL濃度范圍內與其吸光度成良好線性關系。
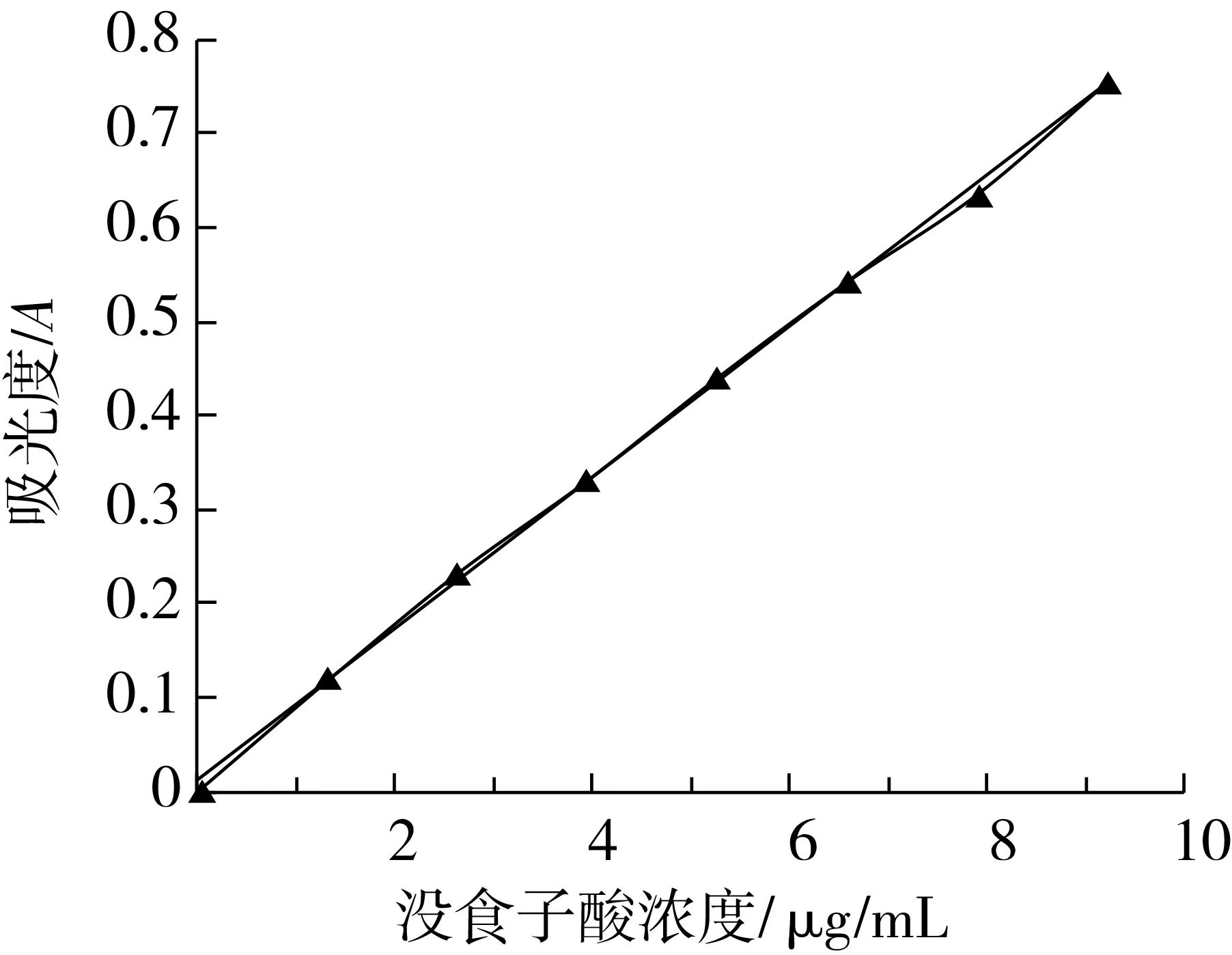
圖1 沒食子酸標準曲線
2.2 單因素實驗結果與分析
提取溫度、超聲功率、提取時間、料液比和乙醇濃度對藜麥糠多酚提取率影響如圖1。
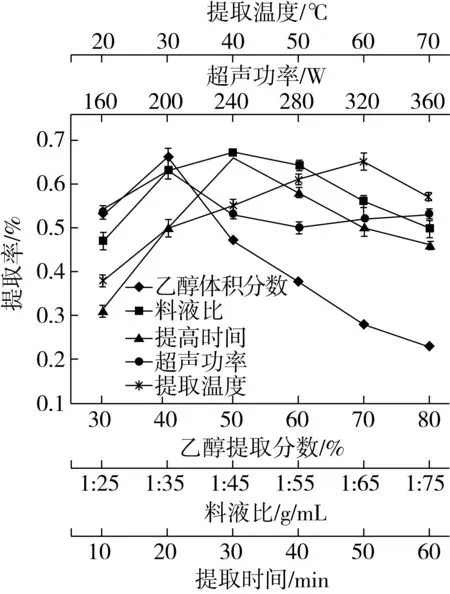
圖2 不同因素對藜麥糠多酚提取率的影響
2.2.1 提取溫度對藜麥糠多酚提取率的影響
由圖1可知,隨提取溫度的升高,藜麥糠中多酚提取率增加,在60 ℃時達到最大,為0.65%。60 ℃后提取率下降。這是由于溫度升高,分子運動加快,有利于多酚溶出;但溫度過高,使乙醇揮發,且可能會破壞已提取出的多酚結構[17],導致藜麥糠多酚提取率降低。因此,選擇60 ℃為最佳提取溫度。
2.2.2 超聲功率對藜麥糠多酚提取率的影響
由圖1可見,隨超聲功率的增大,藜麥糠多酚提取率先增后降,但整體變化不大。在超聲功率200 W時,多酚提取率最大,為0.63%。可能超聲功率過大會破壞藜麥多酚結構。因此選擇200 W為最佳超聲功率。
2.2.3 提取時間對藜麥糠多酚提取率的影響
從圖1可以發現,隨著提取時間的延長,藜麥糠多酚提取率呈先增后降趨勢。在提取時間為30 min時,提取率達到最大,為0.66%。這是由于提取時間短,多酚提取不充分,當達到適宜提取時間后,再延長提取時間,多酚在超聲波作用下會降解,已提出多酚損失,導致多酚提取率下降。故選定30 min為最佳提取時間。
2.2.4 料液比對藜麥糠多酚提取率的影響
由圖1可知,隨料液比增加,藜麥糠多酚提取率先增后降,當料液比(g/mL)為1∶45時,多酚提取率達到峰值0.67%,以后隨料液比增加,多酚提取率降低。其原因可能是在料液比(g/mL)為1∶45時,對多酚類物質的溶解已基本飽和,再增加料液比,其它脂溶性成分增多,與多酚產生競爭[22,23],使多酚提取率下降。故選定1∶45為最佳料液比。
2.2.5 乙醇濃度對藜麥糠多酚提取率的影響
從圖1可知,隨乙醇濃度增加,藜麥糠多酚提取率先增后降,當乙醇濃度為50%時,多酚提取率達最大值0.66%,再繼續增加乙醇濃度,多酚提取率逐漸下降。其原因可能是乙醇濃度過高,使其它脂溶性物質浸出增多,減少了多酚類物質的溶出[24]。因此,選擇50%為最佳乙醇濃度。
2.3 響應面優化分析
2.3.1 響應面設計與結果
以多酚提取率為響應值,固定超聲功率為200 W,選取對藜麥糠中多酚提取率影響較大的乙醇濃度(A)、提取時間(B)、超聲溫度(C)和料液比(D)4個因素,設計進行4因素3水平響應面實驗,優化藜麥糠中多酚超聲輔助提取工藝。響應面設計及結果如表2。

表2 響應面實驗設計及結果
2.3.2 響應面回歸模型與方差分析
通過Design Expert 8.0.6 軟件對表2數據進行擬合,得到藜麥糠多酚超聲輔助提取工藝模型的四元二次回歸方程:提取率Y=0.80-0.025A+0.010B+0.014C-0.028D-0.010AB+0.010AC-(1.000E-002)AD+0.040BC+0.025BD-0.017CD-0.021A2-0.071B2-0.055C2-0.080D2,由模型中因素一次項系數不難發現,影響藜麥糠多酚提取率的因素大小順序為:D(料液比)>A(乙醇濃度)>C(溫度)>B(提取時間)。多酚回歸模型的方差分析結果如表3。
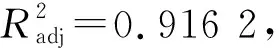

表3 回歸模型方差分析
2.3.3 工藝條件驗證實驗
為檢驗工藝的可靠性,考慮實際可操作性,將理論最優工藝條件修正為:乙醇濃度44%,提取時間31 min,溫度61 ℃,料液比(g/mL) 1∶43,超聲功率200 W。3次實驗藜麥糠中多酚提取率分別為0.79%、0.79%和0.80%,平均為0.79%,與理論預測值相對誤差為1.25%,進一步表明所建模型的穩定可靠,可用于實際操作。
2.4 藜麥糠多酚抗氧化活性
2.4.1 藜麥糠多酚對·OH的清除率
藜麥糠多酚和BHT對·OH的清除率結果如圖2。在實驗濃度范圍內,藜麥糠多酚與BHT對·OH的清除率都隨濃度的增加而增大,具有明顯量效關系。求得藜麥糠多酚與BHT的IC50分別為13.52、20.12 μg/mL,顯見,藜麥糠多酚清除·OH 的能力強于BHT,表明藜麥糠多酚具有強的抗氧化活性。

圖3 藜麥糠多酚與BHT對·OH的清除率
2.4.2 藜麥糠多酚對DPPH·的清除率
藜麥糠多酚和BHT對DPPH·的清除率結果如圖3。在實驗濃度范圍內,藜麥糠多酚與BHT對DPPH·的清除率都隨濃度的增加而增大,具有明顯量效關系。求得藜麥糠多酚與BHT的IC50分別為2.48、17.33 μg/mL,顯見,藜麥糠多酚清除DPPH·的能力遠強于BHT,也表明藜麥糠多酚具有強的抗氧化活性。

圖4 藜麥糠多酚與BHT對DPPH·的清除率
3 結論
以藜麥糠中多酚提取率為指標,通過單因素實驗結合響應面分析優化了藜麥糠中多酚超聲輔助提取工藝,確定的最佳工藝條件:乙醇濃度44%,提取時間31 min,溫度61 ℃,料液比(g/mL)1∶43,超聲功率200 W。該工藝條件下,藜麥糠中多酚提取率為0.79%,與模型理論預測值0.80%的相對誤差為1.25%,表明響應面優化的藜麥糠多酚提取工藝穩定可行。抗氧化活性研究發現,藜麥糠多酚對·OH和DPPH·的IC50分別為13.52、2.48 μg/mL,藜麥多酚具有強的抗氧化活性。本研究為藜麥糠中多酚的提取及其抗氧化活性的深入研究提供了一定的參考,若要達到藜麥糠多酚的產業化生產,還需開展藜麥多酚純化及其體內抗氧化活性的研究。

