一個鎘配位聚合物對Fe3+的識別
任創偉,丁瑞龍,劉保彤,彭艷芬
(池州學院 材料與環境工程學院 微納粉體與先進能源材料安徽普通高校重點實驗室,安徽 池州 247000)
多年來,如何快速有效地識別和檢測出影響食品安全的物質如三聚氰胺、羅丹明B等,以及一些重金屬離子Hg2+,Pb2+等成為亟待解決的問題。以有機化合物作為熒光探針識別金屬離子或無機陰離子的研究由來已久[1]。例如,三嗪類大環可以與一些陰離子(F-)或金屬離子(Cu2+)絡合從而對其進行選擇性識別,還可以對一些有機小分子進行識別。Volker課題組[2]合成了一類大環化合物,并通過核磁滴定的方法證明了此類化合物對F-離子有很好的識別作用。2008年Koide等人[3]設計合成了一種Hg2+熒光傳感器,研究發現在水中,該受體分子對Hg2+有著熒光識別效果。
近二十年來,配位聚合物(coordination polymers,CPs)或者金屬有機框架化合物(metal organic frameworks,MOFs)的設計、合成和性質性能的研究一直是廣大化學工作者的一個重要研究領域,這是因為配位聚合物不僅具奇秒的拓撲結構,更是因為它具有獨特的性質性能,如:磁性、熒光、離子交換和催化[4]等。由于離子在環境和生物系統中的廣泛存在,定向合成具有離子識別功能的MOFs材料也成為配位化學研究者關注焦點[5],而且CPs或MOFs在分子或離子的識別與檢測方面也展現出其獨特的魅力。例如,2013年,吉林大學的施展課題組[6]合成了一系列鑭系金屬有機框架,其中金屬銪配合物對Zn2+有明顯的熒光增強現象,而對Fe3+有明顯的熒光猝滅現象。同年,福建物構所的曹榮課題組[7]合成了一個新的多孔MOF薄膜。該薄膜能把甲醇和吡啶從其他溶劑中快速的識別出來。2015年Amitava Das課題組[8]合成錸配合物fac-[Re(CO)3Cl(L)] (L = 4-([2,2-二吡啶]-4-yl)苯),該配合物能識別出F-。
綜上所述,本文以一個鎘配位聚合物作為熒光探針,對14種常見的金屬離子進行檢測,結果發現,該鎘配位聚合物能選擇性識別Fe3+。
1 實驗部分
1.1 試劑與儀器
Fe(NO3)3、KNO3、Al(NO3)3、Co(NO3)2、Ni(NO3)2、Pb(NO3)2、Mg(NO3)2、Ba(NO3)2、Cd(NO3)2、Ca(NO3)2、Cu(NO3)2、Ni(NO3)2、Zn(NO3)2、Mg(NO3)2、甲醇、乙醇、丙酮、N,N-二甲基甲酰胺(DMF)均為分析純,使用前沒有進一步純化。配合物{[Cd(L1)(1,3-bdc)(H2O)2][Cd(1,3-bdc)(H2O)3]·2H2O} (1)。
KH-100DB型超聲儀、D/MAX-3C型粉末衍射儀、RF-5301PC型熒光光譜儀。
1.2 配合物1的合成和純度分析
參照文獻[9]合成配合物1,取少量配合物1在室溫下測其粉末衍射,并與配合物1的模擬的粉末衍射譜圖進行比對。
1.3 熒光光譜的測定
準確稱取5份3.0 mg 配合物1分別置于5 mL干潔試的劑瓶中,分別向其中加入3.00 mL的蒸餾水、甲醇、乙醇、丙酮和DMF。超聲1 h后靜置24 h,測其熒光光譜。
準確稱取50 mg配合物1置于50 mL容量瓶中,用DMF定容至刻度。超聲1 h后靜置,作為熒光探針。配合物1的DMF溶液的濃度為1 mg/mL。各種金屬鹽分別用蒸餾水配成0.02 mol/L。取200 uL的配合物1的DMF溶液于熒光樣品池中,用DMF稀釋至2 mL,再分別加入不同的金屬離子溶液,搖勻,測定其熒光發射光譜。
測試條件:室溫,樣品池為1 cm×1 cm×4.5 cm石英比色皿,激發狹縫寬度5 nm,發射狹縫寬度3 nm,最大激發波長為294 nm。
2 結果與討論
2.1 配合物1的粉末衍射圖和熒光分析
由圖1所示,配合物1的粉末衍射的實驗圖譜和模擬圖譜吻合很好,這表明參照文獻方法合成的1純度很高。
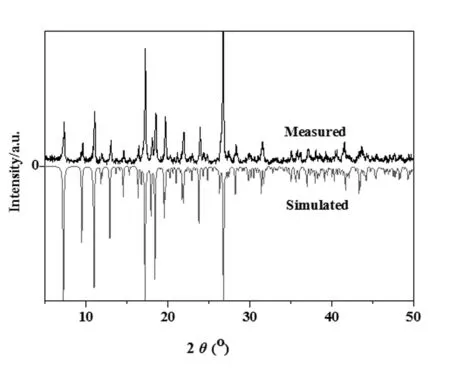
圖1 配合物1的粉末衍射圖
配合物1在五種溶劑(蒸餾水、丙酮、甲醇、乙醇和DMF)中的熒光光譜圖(圖2)顯示,在DMF溶劑中具有最強的熒光發射,λem,max= 358 nm,可能是因為配合物1在DMF中的溶解度最大,因此本實驗選擇以DMF作為熒光探針的稀釋劑。
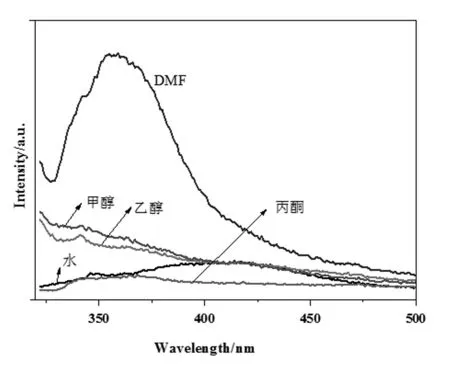
圖2 配合物1在不同溶劑中的熒光光譜圖
2.2 對14種金屬離子的識別
對14種金屬離子進行識別,圖3是所有金屬離子的加入量為均為0.18 μmol時(即[Mn+]=9.0×10-5mol/L)的配合物1的熒光光譜圖,其中加入Ag+、Zn2+、Pb2+、Ni2+、K+、Hg2+后配合物1的熒光基本沒有變化,加入Mg2+、Co2+、Cd2+、Ca2+、Ba2+和Al3+這六種金屬離子后配合物1的熒光強度降低不明顯。只有等量的Fe3+使配合物1的熒光強度明顯降低。
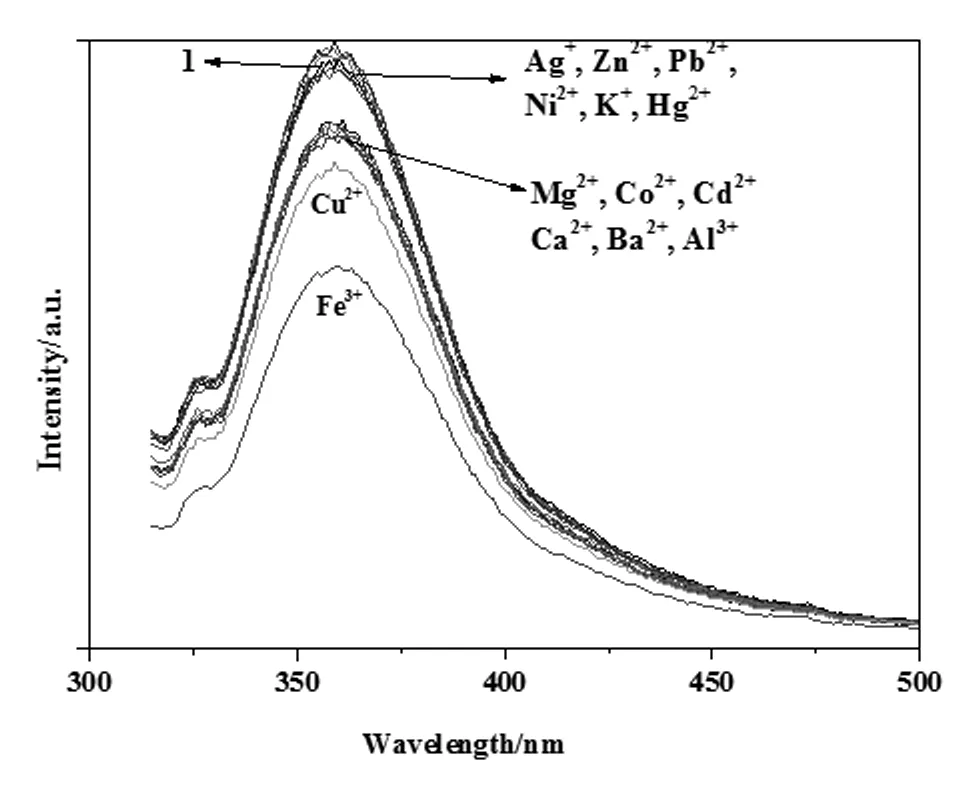
圖3 配合物1對不同金屬離子的選擇性
2.3 其他13種金屬離子對Fe3+的干擾檢測
如圖4所示,藍色柱表示Fe3+加入量為0.1 μmol時配合物1的熒光強度,綠色柱表示再加入1.0 μmol其他金屬離子后配合物1的熒光強度。其結果表明當其他金屬離子的濃度10倍于Fe3+時,只有Cu2+對其干擾最大,其他金屬離子的干擾不大。從圖1也可以看出除了Fe3+外,Cu2+對配合物1的熒光強度影響最大。
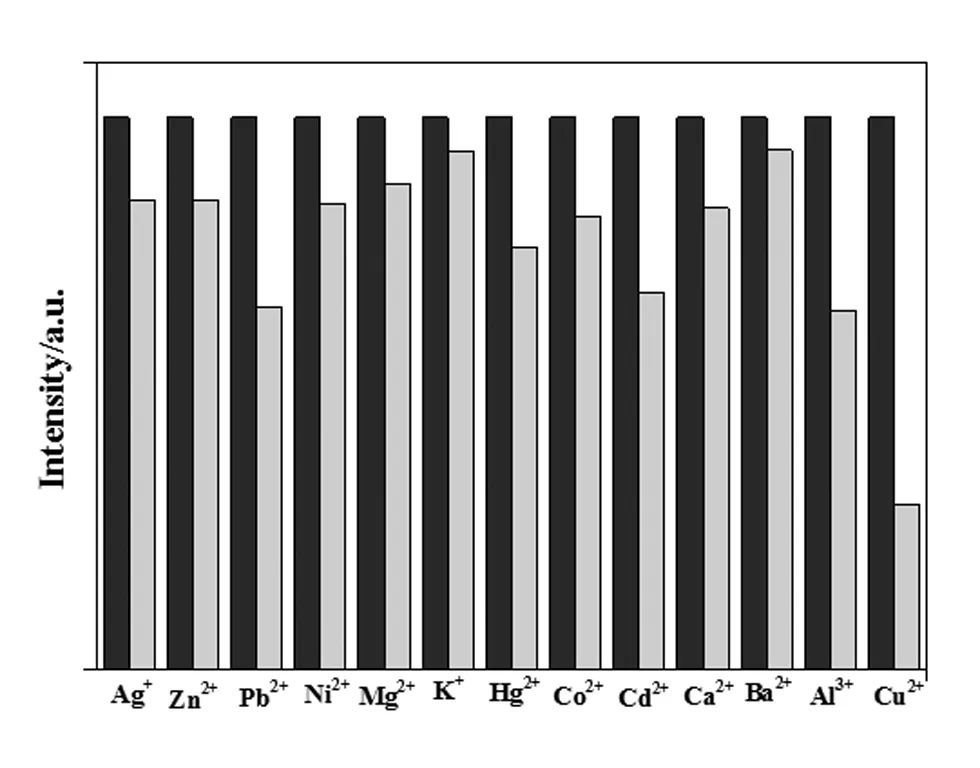
圖4 其他金屬離子和Fe3+共存時配合物1的熒光強度變化
2.4 配合物1的熒光強度與Fe3+濃度的線性關系
如圖5所示,隨著Fe3+的加入,配合物1在358 nm處的熒光強度在不斷下降,當Fe3+的加入量達到0.4 μmol時,配合物1的熒光幾乎猝滅了。當Fe3+的濃度在1.0×10-5~10×10-5mol/L范圍時,配合物1熒光強度與Fe3+濃度有較好的線性關系(圖6)。其線性方程為I = 523.37-30.80 c(Fe3+),R2= 0.9938。
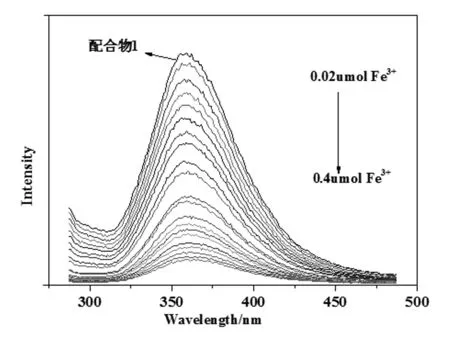
圖5 隨著Fe3+濃度增大,配合物1的熒光強度變化圖
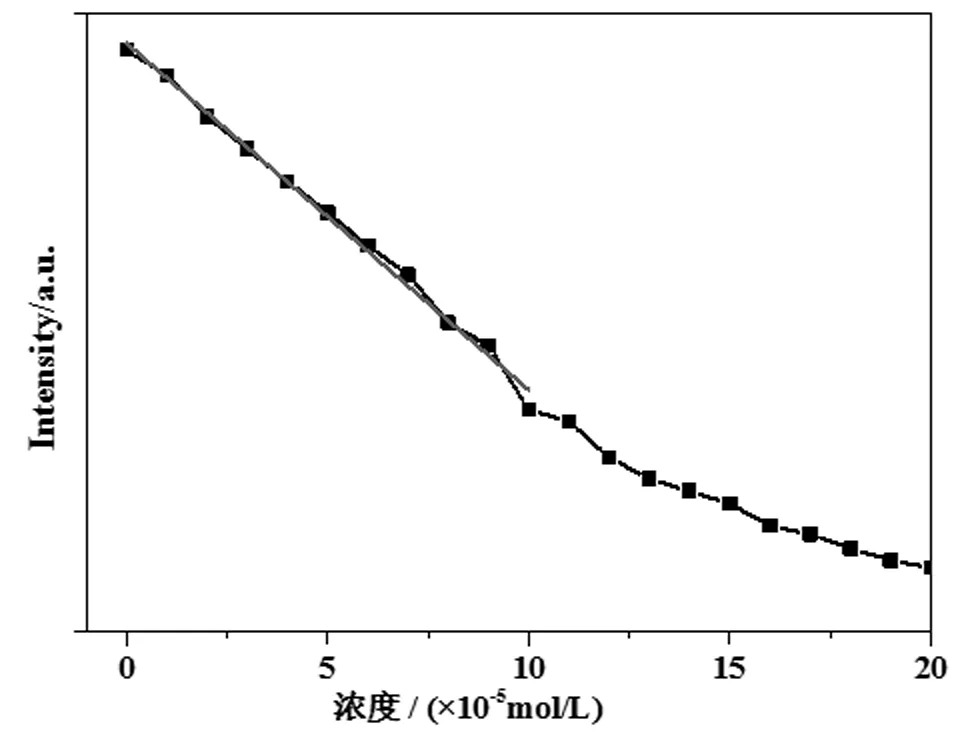
圖6 配合物1的熒光強度隨Fe3+濃度的線性關系
3 結論
以一個鎘配位聚合物1作為熒光探針,對14種金屬離子進行識別檢測,結果表明,Fe3+能顯著降低配合物1的熒光強度。配合物1的熒光強度與濃度在1.0×10-5~10.0×10-5mol/L范圍Fe3+有較好的線性關系,R2=0.9938。

