宣肺逐飲方對肺癌惡性胸腔積液模型小鼠胸膜粘連、ERK1/2通路及AQP4表達的影響
盧杉杉,錢自明,顏 輝,姚 飛,王 猛
肺癌是全球癌癥患者死亡的主要原因,肺癌患者中約15%在初次診斷時伴有惡性胸腔積液,30%~40%在病程后期出現惡性胸腔積液[1-2]。肺癌伴惡性胸腔積液患者預期壽命短,對該類患者臨床通常采用胸腔引流術,然后胸腔內注射如博來霉素、順鉑等化療藥物或其他免疫藥物治療,可使患者的胸膜粘連,胸膜腔消失,阻止惡性胸腔積液的復發[3-5];但此種方法具有顯著的血液學毒性和消化道不適癥狀,患者生活質量較差,且反復多次引流穿刺,容易引起多房型包裹性積液,30 d后復發率高[6]。包玉花[7]通過分析宣肺逐飲方組成藥物的藥理學發現,該飲方中的豬苓等可以通過下調腫瘤細胞免疫抑制來控制肺癌細胞,抑制腎小球重吸收,從而減少肺癌患者體內的胸腔積液量,增強機體免疫功能,并可緩解患者咳嗽、喘息等臨床癥狀,起到治療肺癌伴惡性胸腔積液的作用。目前對宣肺逐飲方作用的分子機制未見報道,本研究通過觀察宣肺逐飲方對肺癌惡性胸腔積液小鼠模型胸膜粘連、細胞外信號調節激酶(extracellular signal-regulated kinase, ERK)1/2通路及水通道蛋白(aquaporins, AQP)4表達的影響,旨在探討其對肺癌惡性胸腔積液的治療作用和分子機制。現報告如下。
1 材料與方法
1.1實驗動物 雄性C57BL/6小鼠50只,6~8周齡,體重20~25 g,由安徽醫科大學實驗動物中心提供,實驗動物生產許可證號:SCXK(皖)2018-0004,實驗動物使用許可證號:SYXK(皖)2018-0026,動物質量合格證號:2019-0097,并在無特定病原體的動物房中飼養。實驗方案經由安徽醫科大學動物保護委員會批準,符合美國國立衛生研究院(NIH)的實驗動物飼養和管理指南。
1.2藥品、試劑與儀器
1.2.1藥品:順鉑注射液(江蘇豪森藥業股份有限公司,批號181104);宣肺逐飲方(葶藶子30 g、豬苓30 g、龍葵25 g、半枝蓮25 g、防己15 g、澤蘭15 g、白術15 g、大棗15 g、薏苡仁10 g、茯苓10 g、黃芪10 g、桂枝6 g、炙甘草6 g)由本院中藥房提供。具體方法:在水中浸泡1 h,水煎30 min,煎煮2次,過濾后去渣,置于旋轉蒸發儀中濃縮,生藥終濃度分別為1.2、2.4 mg/ml,高壓滅菌后儲存備用。
1.2.2試劑:小鼠Lewis肺癌細胞(中國科學院細胞庫,批號:20181027);伊文思藍染料、磷酸鹽(PBS)緩沖液(北京索萊寶科技有限公司,批號:181117、180921);M-MLV反轉錄酶、SYBR Green PCR試劑盒[寶日醫生物技術(北京)有限公司,批號:MR0024K、MR1027M];TRIzol試劑、RIPA裂解液(碧云天生物技術研究所,批號:P1019R、P0013B);兔抗ERK1/2、AQP4多克隆抗體、兔抗β-actin多克隆抗體、生物素標記山羊抗兔IgG二抗均購自美國Sigma公司,批號:S8044、S8013、S8534、S9025;DAB顯色試劑盒(北京中杉生物技術有限公司,批號:181229)。
1.2.3儀器:SYD-K4080型全自動病理冰凍切片機(深圳市匯沃科技有限公司);AGT9601 PCR擴增儀(美國Thermo公司);EVOS M5000倒置顯微鏡(日本奧林巴斯公司);invitrogen凝膠成像儀、BIO-RAD垂直電泳儀、ABI Prism 7500型熒光定量PCR儀(美國UVP公司、BD公司、ABI公司);西門子SENSA-TION 16層螺旋CT機(德國Siemens公司)。
1.3方法
1.3.1小鼠Lewis肺癌細胞培養:將Lewis肺癌細胞放在含有10% PBS、青霉素100 U/ml、鏈霉素100 μg/ml的DMEM培養基,37℃、5% CO2條件下溫育,每隔1天將處于對數生長期的小鼠Lewis肺癌細胞進行傳代,以0.02% EDTA、0.25%胰蛋白酶消化對數生長期良好的細胞2 min,用Hank's平衡鹽溶液洗滌后將細胞重懸于DMEM培養基,配置成終濃度為5.0×106cell/ml細胞用于實驗。
1.3.2分組、造模及給藥方法:將50只小鼠隨機分為對照組、模型組、順鉑組和宣肺逐飲方低、高劑量組,每組10只。對照組無任何處理,其余4組小鼠用乙醚麻醉后,對右側胸壁的皮膚進行消毒處理,在胸骨柄右側行長約5 mm的縱行切口,在不損傷肋間肌的前提下,通過胸膜注射0.2 ml的Lewis肺癌細胞懸浮液,針刺深度3~5 mm,避免刺穿內臟胸膜或肺,注射后縫合切口。Lewis肺癌細胞注射后3 d,順鉑組給予順鉑注射液5 mg/kg(預實驗求出順鉑對肺癌惡性胸腔積液模型小鼠的半數致死濃度為10 mg/kg,以5 mg/kg 為有效劑量)腹腔注射。按照參考文獻[7]的方法,預實驗求出宣肺逐飲方對肺癌惡性胸腔積液模型小鼠的半數致死濃度為48 mg/kg,以24、12 mg/kg為高、低劑量,生藥終濃度分別為1.2、2.4 mg/ml,灌胃體積10 ml/kg,因此宣肺逐飲方低、高組分別給予灌胃宣肺逐飲方12、24 mg/kg,1/d。對照組和模型組給予生理鹽水10 ml/kg灌胃,1/d。在Lewis肺癌細胞注射后14 d,CT檢查示肺窗和縱隔出現均勻密度陰影;處死小鼠后觀察到大量的胸腔積液和分散在整個頂葉、胸膜及縱隔表面的轉移性結節時表明成功建立肺癌伴惡性胸腔積液模型。
1.4標本采集與檢測
1.4.1胸腔積液量:Lewis肺癌細胞注射14 d,斷頭處死小鼠,用注射器抽取胸腔積液,觀察積液外觀并記錄容積。
1.4.2胸膜粘連檢查:處死小鼠后,快速取右肺組織,用10%福爾馬林在PBS緩沖鹽水中固定24 h,隨后用自來水洗滌,在乙醇中脫水并包埋在石蠟中,切成約4 μm厚的切片,用HE染色光鏡下觀察組織結構和病變特點。
1.4.3ERK1/2和AQP4 mRNA表達水平:采用PCR進行,按照制造商的規程以TRIzol試劑提取總RNA,使用M-MLV反轉錄酶產生第一鏈cDNA;使用SYBR Green PCR試劑盒在ABI Prism 7500型熒光定量儀上進行qRT-PCR。引物序列如下:①ERK1/2:5'-GGAAAGAAAAGTTGAATC-3'(正向),5'-TTCCTGTGGGCGGATTAG-3'(反向)。②AQP4:5'-GGTAGTGTTGTACTGGGCCAAT-3'(正向),5'- CCTGGTGCCCGTTGG GTTGTGGAAAT(反向)。③β-肌動蛋白:5'- AATACCTCAGCCTCCAGCAGATG-3'(正向),5'-AGAGAAGTGGGGTGGCTTTT-3'(反向)。
1.4.4ERK1/2和AQP4蛋白表達水平:采用蛋白免疫印跡法(Western-Blot)檢測。將肺組織在含有1%苯甲基磺酰氟的RIPA裂解液中勻漿,勻漿后取上清液,通過聚丙烯酰胺凝膠電泳分離等量的蛋白質,轉移到聚偏二氟乙烯膜上,并在4℃下與ERK1/2一抗(1∶500)和AQP4一抗(1∶1500)孵育過夜,洗滌后,避光將膜與生物素標記二抗(1∶1000)一起溫育2 h;二抗孵育后顯色、曝光、顯影;并以β-actin 為內參計算相對光密度值(ROD)。
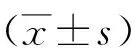
2 結果
2.1胸腔積液量比較 5組小鼠胸腔積液量分別為:對照組(1.85±0.31)ml、模型組(3.62±0.41)ml、順鉑組(2.27±0.35)ml、宣肺逐飲方低、高劑量組(2.98±0.35)ml、(2.30±0.41)ml。模型組胸腔積液量顯著多于對照組(P<0.05);與模型組相比,順鉑組和宣肺逐飲方高、低劑量組胸腔積液量顯著減少,且宣肺逐飲方低劑量組胸腔積液量多于順鉑組(P<0.05),宣肺逐飲方高劑量組胸腔積液量與順鉑組比較差異無統計學意義(P>0.05)。
2.2胸膜粘連情況比較 對照組小鼠胸膜結構正常。模型組小鼠胸膜粘連、增厚明顯,結締組織異常增生,臟層和壁層胸膜被覆的單層扁平間皮細胞轉為復層上皮細胞。宣肺逐飲方低劑量組小鼠仍可見明顯胸膜粘連、增厚,臟層和壁層胸膜的復層上皮細胞覆蓋較模型組略微減輕。順鉑組和宣肺逐飲方高劑量組小鼠胸膜粘連、增厚情況明顯輕于模型組,胸膜的單層扁平間皮細胞有少量轉化為單層立方上皮細胞。
2.3肺ERK1/2和AQP4 mRNA表達水平比較 與對照組比較,模型組肺ERK1/2和AQP4 mRNA表達水平增多(P<0.05);與模型組比較,順鉑組和宣肺逐飲方低、高劑量組肺ERK1/2和AQP4 mRNA表達水平顯著減少,但宣肺逐飲方低劑量組多于順鉑組和高劑量組(P<0.05)。宣肺逐飲方高劑量組肺ERK1/2和AQP4 mRNA表達水平與順鉑組比較差異無統計學意義(P>0.05)。見表1。
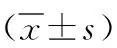
表1 5組小鼠肺組織ERK1/2和AQP4 mRNA表達水平比較
2.4肺ERK1/2和AQP4相對蛋白表達水平比較 與對照組比較,模型組肺ERK1/2和AQP4 相對蛋白表達水平增多(P<0.05);與模型組比較,順鉑組和宣肺逐飲方低、高劑量組肺ERK1/2和AQP4相對蛋白表達水平顯著減少;且宣肺逐飲方低劑量組肺ERK1/2和AQP4相對蛋白表達水平多于順鉑組和高劑量組(P<0.05)。宣肺逐飲方高劑量組肺ERK1/2和AQP4相對蛋白表達水平與順鉑組比較差異無統計學意義(P>0.05)。見表2、圖1。
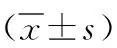
表2 5組小鼠肺ERK1/2和AQP4相對蛋白表達水平比較

圖1 5組小鼠肺ERK1/2、AQP4相對蛋白表達水平A.對照組;B.模型組;C.順鉑組;D.宣肺逐飲方低劑量組;E.宣肺逐飲方高劑量組;ERK為細胞外信號調節激酶,AQP4為水通道蛋白4
3 討論
25%~30%的肺癌患者因胸膜轉移而出現惡性胸腔積液,嚴重影響了其生活質量,使生存期縮短[8-10]。宣肺逐飲方具有發汗、利水、攻逐的功效并能兼顧健脾不傷正。現代藥理學研究認為,宣肺逐飲方可以在免疫調節、利尿、止咳平喘和控制肺癌細胞等方面發揮作用。研究表明,宣肺逐飲方可以通過劑量依賴性方式抑制G2/M細胞周期阻滯,從而抑制肺癌細胞A549的增殖。用宣肺消水方式處理肺癌伴惡性胸腔積液小鼠模型,可將小鼠血性的胸腔積液顏色轉換為淺黃色,表明宣肺消水具有抗血管生成的作用[11]。宣肺逐飲方中的葶藶子可以抑制實體瘤中的血管密度并破壞血管壁結構,通過抑制血管生成而對肺癌伴惡性胸腔積液患者發揮作用[12]。本研究將Lewis肺癌細胞注入C57BL/6小鼠的胸膜,建立肺癌惡性胸腔積液模型,在模型建立后的第14天進行胸部CT掃描發現模型組中存在胸腔積液,提示建模成功。本研究結果顯示,宣肺逐飲方低劑量組胸膜明顯粘連、增厚,臟層和壁層胸膜的復層上皮細胞覆蓋較模型組略微減輕;順鉑組和宣肺逐飲方高劑量組胸膜粘連、增厚情況明顯輕于模型組,胸膜的單層扁平間皮細胞有少量轉化為單層立方上皮細胞。這說明逐飲方可能是一種較為理想的姑息治療中藥。本研究結果同時顯示,與對照組比較,模型組胸腔積液量顯著增多;與模型組比較,順鉑組和宣肺逐飲方低、高劑量組胸腔積液量顯著減少;宣肺逐飲方低劑量組胸腔積液量多于順鉑組,但宣肺逐飲方高劑量組胸腔積液量與順鉑組比較差異無統計學意義。這與既往研究結果一致[10-13],說明宣肺逐飲方能顯著減少肺癌伴惡性胸腔積液小鼠模型胸腔積液量,且高劑量宣肺逐飲方療效與順鉑相近。
ERK1/2可促進腫瘤壞死因子-α(TNF-α)表達,而ERK1/2誘導的TNF-α激活可以上調血管內皮生長因子(VEGF)的表達。VEGF能夠促進腫瘤血管生成并增加血管通透性,從而導致肺癌伴惡性胸腔積液的發展[14-16]。AQP4是肺部主要的水通道蛋白,也是重要的抑癌因子,降低AQP4在壁層胸膜中的表達,可促進胸腔積液吸收,減少胸腔積液過度過濾,進而消除積液[17]。ERK1/2通路作為AQP4上游分子在星形膠質細胞上直接調控其表達,在腦出血模型和原代星形膠質細胞中證實通過ERK1/2通路可上調AQP4表達,影響腦水腫,抑制ERK1/2途徑的激活,降低AQP4蛋白表達,是改善機體水液代謝的重要策略。研究證實,順鉑可影響ERK1/2、AQP4的表達[18-21]。本實驗以順鉑為陽性對照,結果顯示,與對照組比較,模型組肺組織ERK1/2和AQP4 mRNA、ERK1/2和AQP4相對蛋白表達水平增多;與模型組比較,順鉑組和宣肺逐飲方低、高劑量組肺ERK1/2和AQP4 mRNA、ERK1/2和AQP4相對蛋白表達水平顯著減少;宣肺逐飲方低劑量組肺ERK1/2和AQP4 mRNA、ERK1/2和AQP4相對蛋白表達水平多于順鉑組,宣肺逐飲方高劑量組肺ERK1/2和AQP4 mRNA、ERK1/2和AQP4 相對蛋白表達水平與順鉑組相近。提示宣肺逐飲方可能通過抑制ERK1/2信號通路的激活,來下調AQP4表達,從而達到治療肺癌惡性胸腔積液的目的。
綜上所述,宣肺逐飲方能顯著減少肺癌惡性胸腔積液模型小鼠的積液量,改善小鼠胸膜的粘連,減少小鼠肺組織中ERK1/2和AQP4 mRNA、ERK1/2和AQP4相對蛋白表達水平。本研究為宣肺逐飲方臨床用于肺癌惡性胸腔積液的治療提供了實驗依據,其作用的分子機制可能與抑制ERK1/2途徑的激活,降低AQP4表達有關。

