基于αCaMKⅡ-CREB-BDNF 信號通路研究調心方對APP/PS1 雙轉基因AD 小鼠學習記憶和突觸可塑性的影響
王曉雯 ,錢 紅 ,沈春娟 ,李燕軍 ,袁海新 *,王 健
1 上海市第五康復醫院,上海 201699;2 上海中醫藥大學康復醫學院,上海201203
阿爾茨海默病(Alzheimer's disease,AD)是一種不可逆轉的中樞神經系統退行性疾病。 目前,全世界范圍內有超過5 000 萬AD 患者,到2050 年,預計將有 15 000 萬 AD 患者[1]。 AD 的主要發病人群為60 歲以上的老年人,其患病率隨人口老齡化日益增加。在我國60 歲以上人群的患病率為0.53%~5.67%,85 歲以上為 20%~50%[2]。 AD 的臨床特征是隱匿起病,早期主要出現近期記憶力減退,隨著病情的發展,視空間、計算力、語言、運動神經系統功能均可出現障礙,在后期甚至出現妄想、錯覺、焦慮、抑郁等精神癥狀,不僅對老年人的日常生活能力造成了嚴重的影響,也給照料者和社會帶來了沉重的負擔[3]。 目前有許多研究進行 AD 治療藥物研發,據不完全統計正在研發/已研發的藥物有200 多種,但其中99%藥物因中期結果無效或副作用不能耐受等原因導致失敗[4],僅有極少數藥物被批準用于治療AD,而這些藥物只能控制癥狀,并無法改變疾病的進程。 如多奈哌齊就是臨床上治療輕中度AD 的常用藥物[5],它是一種可逆性的乙酰膽堿酶抑制劑,能有效改善認知功能。
近年來,隨著中醫學對AD 防治的深入研究,發現中醫藥在AD 的防治方面有著明顯的優勢。 林水淼教授[6]結合多年臨床經驗提出輕中度AD 患者以心氣虛證為主,治療宜從心入手,研究發現調心方能有效改善氧化損傷型類AD 大鼠空間記憶能力和神經元鈣穩態[7]。本課題組前期研究發現,經過調心方治療后,APP/PS1 雙轉基因小鼠的學習獲取能力和空間記憶保持能力均明顯提高[8]。 但有關于其具體的作用機制還未明確。 APP/PS1 雙轉基因小鼠能夠模仿AD 的病理變化,常被用于AD 和神經退行性病變的神經生物學研究[9]。 αCaMKⅡ-CREBBDNF 信號通路是形成及維持空間學習記憶能力和長時程增強(long-term potentiation,LTP)的重要信號通路之一[10]。 本研究基于 αCaMKⅡ-CREB-BDNF 信號通路探討調心方改善AD 學習記憶和突觸可塑性的具體作用機制,選擇采用3 月齡APP/PS1雙轉基因小鼠為AD 病理模型,通過電生理技術誘導小鼠海馬CA1 區LTP,實時熒光定量聚合酶鏈反應 (real-time quantitative polymerase chain reaction,RT-qPCR)法檢測小鼠海馬區α 鈣/鈣調素依賴激Ⅱ(alpha calcium /calmodulin-dependent protein kinaseⅡ,αCaMKⅡ)、環磷酸腺苷反應元件結合蛋白(cyclic AMP response element binding protein,CREB)、腦源性神經營養因子(brain derived neurotrophic factor,BDNF)、突觸后致密物 95(postsynaptic density protein-95,PSD-95)mRNA 表達;采用 Western blot 法檢測 p-αCaMKⅡ、p-CREB、BDNF、PSD-95 蛋白表達。
1 實驗材料
1.1 實驗動物
選取 SPF 級 3 月齡 APP/PS1 雙轉基因雄性小鼠 54 只,體質量(25.22±1.71)g,按照隨機數字表法將APP/PS1 雄性小鼠分為模型組、多奈哌齊組、調心方組。另設同月齡同品系同月齡C57/BL6 雄性野生型小鼠 18 只為正常組,體質量(30.49±1.59)g。以上實驗動物均由南京大學模式動物研究所提供,品系編號為 D00268,許可證號:SCXK(蘇)2015-0001。 動物實驗在上海中醫藥大學動物實驗中心進行,實驗過程中動物飼養和操作嚴格遵循實驗動物倫理學準則。
1.2 主要儀器與試劑
超薄切片機(德國Leica 公司);全波長酶標儀、梯度PCR 儀(美國Thermo 公司);伯樂電泳儀、伯樂寬式水平電泳槽、轉印電泳槽(美國BIO RAD 公司);水浴鍋、隔水式恒溫培養箱(上海精密實驗設備公司);化學發光成像儀(上海天能公司)。 Trizol、隨機引物(美國 Invitrogen 公司);RIPA、PMSF、BCA試劑盒、PBS、SDS-PAGE 凝膠配制試劑盒、5Xloadingbuffer、SDS-PAGE 電泳液、Western 轉膜液(上海碧云天生物技術公司);BDNF 抗體、p-CREB(S133)抗體、p-αCaMKⅡ(T286)抗體、GAPDH 抗體、PSD95抗體(英國 Abcam 公司);αCaMKⅡ-α、CREB、辣根過氧化物酶標記山羊抗兔IgG(H+L)(美國CST 公司)。
1.3 主要藥物
調心方顆粒(江蘇江陰天江藥業有限公司),其成分主要包括黨參、石菖蒲、桂枝、甘草、白芍、龍骨、遠志等;鹽酸多奈哌齊(江蘇豪森藥業股份有限公司,生產批號:H20030472)。
2 實驗方法
2.1 干預方法
參照藥理試驗中動物與人體間的等效劑量換算標準進行折算,多奈哌齊組和調心方組均按照人的等效劑量(體質量:60 kg)折算出藥物劑量。 正常組和模型組給予等量生理鹽水 10 mL/(kg·d);多奈哌齊組給予鹽酸多奈哌齊灌胃,劑量為 0.05 mg/(kg·d);調心方組給予調心方顆粒灌胃,劑量為0.057 g/(kg·d)[11];4 組小鼠于 3 月齡時進行灌胃給藥處理,1 次 /d,連續灌胃 3 個月。
2.2 取材
2.2.1 腦片制備 4 組各隨機選取5 只小鼠,于小鼠腹腔注射20%的水合氯醛,待小鼠麻醉后,快速斷頭,取出腦組織移至95%O2+5%CO2混合氣飽和的人工腦脊液(artificial cerebrospinal fluid,ACSF)中,ACSF 溶液溫度為 0 ℃,放置 1 min。 去除前腦和小腦,用膠水將剩余腦組織塊粘在切片臺上。 用振動切片機冠狀切取海馬腦片,海馬腦片大小為400 μm,放入34 ℃的孵育槽中孵育0.5 h,然后放在(25±1) ℃持續通入 95%O2+5%CO2混合氣飽和的 ACSF溶液中2~8 h。
2.2.2 腦組織樣本制備 4 組各隨機選取7 只小鼠,將小鼠腹腔注射20%的水合氯醛,待小鼠麻醉后,快速斷頭,取出腦組織移置-20 ℃的冰盒上,迅速剝離左右兩側海馬置于EP 管中,儲存于-80 ℃冰箱內,以待RT-qPCR 和Western blot 檢測備用。
2.3 指標檢測
2.3.1 離體海馬CA1 區LTP 誘導 待腦片孵育結束后,在顯微鏡下將腦片移進記錄槽中,使用32~34 ℃的 95%O2+5%CO2混合氣飽和的 ACSF 溶液持續灌流,速度為3 mL/min,在海馬CA1 區記錄興奮性突觸后電位。 具體步驟如下:①確定海馬CA1區:顯微鏡下確定海馬的CA1 區。②準備刺激電極、記錄電極:選擇1 個單級鎢絲的微電極刺激作為刺激電極,尖端直徑1~2 μm,尖端暴露長度為15~40 μm;記錄電極為玻璃管記錄電極,ACSF 溶液充滿玻璃管,電阻1~5 MΩ,將其放在CA1 區的同一層。③ 刺激海馬CA1 區:將刺激電極放在海馬CA1區 stratum radium 層,刺激 Shaffer collateral 纖維,以0.033 Hz 頻率,100 μs 波寬,每隔 30 s 給 1 個刺激,刺激強度為0.1~0.7 mA。 ④ 記錄場興奮性突觸后電位:每給1 個刺激記錄1 個場興奮性突觸后電位(field excitatory postsynaptic potential,fEPSP),以 30%fEPSP 最大刺激強度為基線,記錄30 min;在前30 min 基礎 fEPSP 曲線保持穩定后,LTP 應用100 Hz 高頻刺激(high frequency stimulation,HFS)誘導1 s,LTP 誘發成功后持續記錄 60 min,選擇其中的第50~60 min 的fEPSP 平均斜率觀察LTP 水平。LTP 是在強直剌激下誘發的突觸傳遞功能長時間增強現象,反映了突觸傳遞效能的持久變化[12]。⑤繪制刺激強度-反應曲線:以刺激強度為橫坐標,fEPSP斜率為縱坐標,繪制刺激強度-反應曲線(input-output curve,I/O),I/O 曲線能夠反映神經環路的基本突觸傳遞特性。 ⑥觀察短時程突觸可塑性:在海馬Schaffer 側枝CA1 區的突觸通路上,從20~250 ms 雙脈沖刺激間隔的雙脈沖易化(paired pulse facilitation,PPF)即短時程的突觸可塑性。 在 30%fEPSP 最大刺激強度的刺激下,一般會產生前后2 個突觸后興奮電位,后1 個fEPSP 斜率/前1 個fEPSP斜率就是PPF 值。 它可通過觀察突觸后的反應來推測突觸前神經遞質的釋放情況。 以上數據采用Clampfit 軟件進行分析。
2.3.2 海馬 CA1 區 αCaMKⅡ、CREB、BDNF 和 PSD-95mRNA 含量檢測 采用RT-qPCR 法檢測海馬αCaMKⅡ、CREB、BDNF 和 PSD-95mRNA 的含量。4 組小鼠各隨機選取4 個海馬組織,采用Trizol 法提取總 RNA, 使用酶標儀檢測總RNA 的濃度和純度,光密度(optical density,OD)比值可以判斷RNA純度,OD260/OD280在 1.8~2.0 之間,表示 RNA 純度較好。 RNA 純度測定后,利用 cDNA 合成試劑盒將2 μg RNA 逆轉錄為 cDNA。PCR 擴增條件:95 ℃預變性 2 min,需執行 1 個循環。 先 95 ℃變性 5 s,后60 ℃退火10 s,需執行45 個循環。循環結束后緩慢升溫,生成各基因的熔解曲線。 采用GAPDH 作為內參基因,利用熒光定量 PCR 儀對目的基因αCaMKⅡ、BDNF、CREB、PSD-95 進行定量檢測。 使用 PCR系統軟件,觀察熔解和擴增曲線,記錄各組目的基因的 Ct 值,相對定量采用 2-△△Ct法。 引物由 NCBI Primer-blast 設計,序列參照Gene Bank 數據庫中的基因序列,由蘇州金唯智公司合成。 序列為:①BDNF:上游 5’-GGTATCCAAAGGCCAACTGA-3’;下游 5’-CTTATGAATCGCCAGCCAAT-3’。 ② CREB:上游 5’-CAGACAACCAGCAGAGTGGA-3’,下游5’-GGGCTAATGTGGCAATCTGT-3’。 ③ GADPH:上游 5’-AGGTCGGTGTGAACGGATTTG-3’,下游5’-TGTAGACCATGTAGTTGAGGTCA-3’。 ④ PSD-95:上游 5’-CTATGAGACGGTGACGCAGA-3’,下游5’-CGGGAGGAGACAAAGTGGTA-3’。⑤αCaMKⅡ:上游 5’-CAGCCACTGTATCCAGCAGA-3’,下游5’-GAGGCCAGCAACAGATTCTC-3’。
2.3.3 海馬 CA1 區 p-αCaMKⅡ、p-CREB、BDNF和PSD-95 蛋白含量檢測 采用Western blot 法檢測海馬 p-αCaMKⅡ、p-CREB、BDNF 和 PSD-95 的蛋白含量。 4 組隨機選取3 個在-80 ℃冰箱中儲存的海馬組織,按蛋白提取試劑盒上操作要求提取蛋白,使用BCA 法測定各組蛋白濃度。 繪制標準曲線,計算出4 組樣本的蛋白濃度,使用RIPA 裂解液將各組蛋白定容至等體積,濃度為1 μg/μL,在100 ℃水浴鍋中煮沸10 min,置于-20 ℃冰箱中備用。 經過SDS-PAGE 凝膠配制、凝膠電泳、轉膜、蛋白印跡后,進行圖像分析。 所有條帶均采用Al-Phaview SA 軟件進行處理分析。
2.4 統計學分析
采用SPSS 21.0 統計軟件進行數據分析。 計量資料用()表示,數據符合正態分布且方差齊時,多組間比較采用單因素方差分析,兩兩比較采用LSD-t 檢驗;方差不齊用Wilcoxon 秩和檢驗。 重復測量數據用重復測量方差分析。 P<0.05 為差異有統計學意義。
3 結 果
3.1 4 組小鼠海馬 CA1 區 LTP 比較
見圖1。
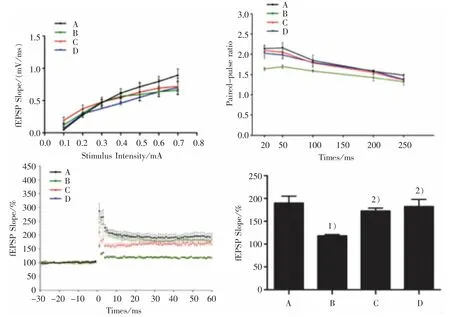
圖 1 4 組海馬 CA1 區 LTP 圖Figure 1 LTP figure of hippocampal CA1 in four groups
3.2 4 組小鼠海馬區 αCaMKⅡ、CREB、BDNF 和PSD-95 mRNA 表達比較
見表 1、圖 2。
表 1 4 組海馬 αCaMKⅡ、CREB、BDNF、PSD-95 mRNA 表達比較()Table 1 Comparison of αCaMKⅡ, CREB, BDNF, PSD-95 mRNA expression in the hippocampus in four groups ()
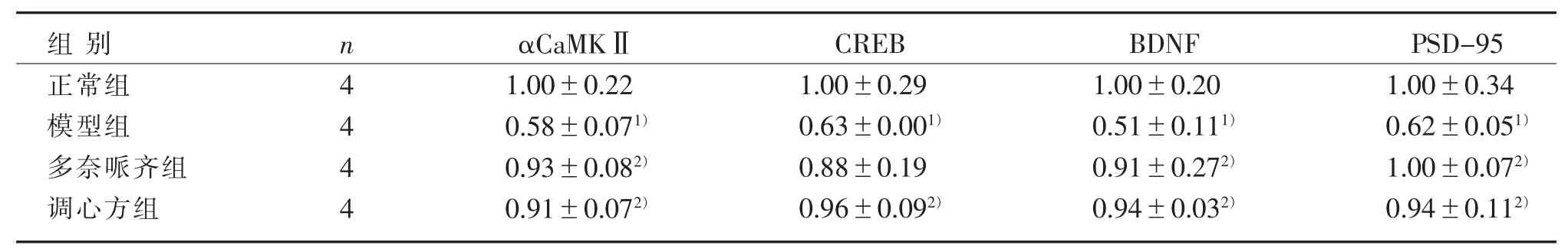
表 1 4 組海馬 αCaMKⅡ、CREB、BDNF、PSD-95 mRNA 表達比較()Table 1 Comparison of αCaMKⅡ, CREB, BDNF, PSD-95 mRNA expression in the hippocampus in four groups ()
注:與正常組比較,1) P<0.05;與模型組比較,2) P<0.05。Note: Compared with the normal group, 1) P<0.05; Compared with the model group, 2) P<0.05.
PSD-95 1.00±0.34 0.62±0.051)1.00±0.072)0.94±0.112)組別正常組模型組多奈哌齊組調心方組n 4 4 4 4 αCaMKⅡ1.00±0.22 0.58±0.071)0.93±0.082)0.91±0.072)CREB 1.00±0.29 0.63±0.001)0.88±0.19 0.96±0.092)BDNF 1.00±0.20 0.51±0.111)0.91±0.272)0.94±0.032)
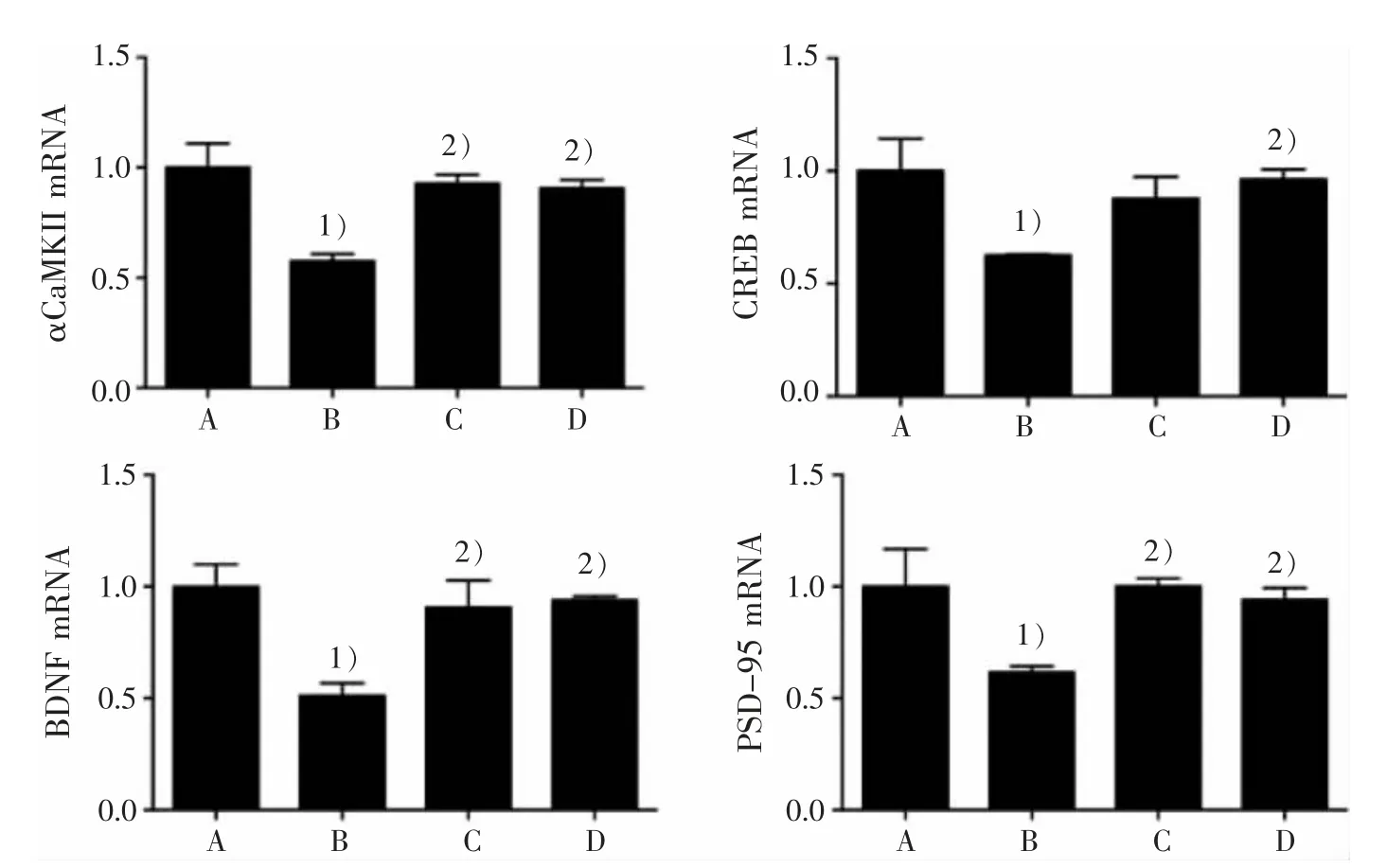
圖 2 4 組小鼠海馬區 αCaMKⅡ、CREB、BDNF 和 PSD-95 mRNA 表達比較Figure 2 Comparison of αCaMKⅡ,CREB,BDNF and PSD-95 mRNA expression in the hippocampus in four groups
3.3 4 組小鼠 海馬 區 p-αCaMK Ⅱ、p-CREB、BDNF和PSD-95 的蛋白表達比較
見表 2、圖 3、圖 4。
表 2 4 組海馬區 p-αCaMKⅡ、p-CREB、BDNF 和 PSD-95 蛋白表達比較()Table 2 Comparison of p-αCaMKⅡ, p-CREB, BDNF and PSD-95 protein expression in the hippocampus in four groups ()
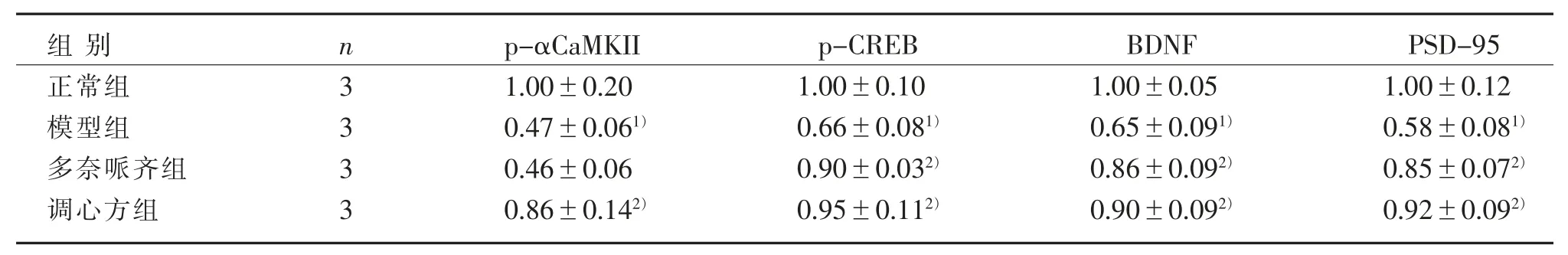
表 2 4 組海馬區 p-αCaMKⅡ、p-CREB、BDNF 和 PSD-95 蛋白表達比較()Table 2 Comparison of p-αCaMKⅡ, p-CREB, BDNF and PSD-95 protein expression in the hippocampus in four groups ()
注:與正常組比較,1) P<0.05;與模型組比較,2) P<0.05。Note: Compared with the normal group, 1) P<0.05; Compared with the model group, 2) P<0.05.
PSD-95 1.00±0.12 0.58±0.081)0.85±0.072)0.92±0.092)組別正常組模型組多奈哌齊組調心方組n 3 3 3 3 p-αCaMKII 1.00±0.20 0.47±0.061)0.46±0.06 0.86±0.142)p-CREB 1.00±0.10 0.66±0.081)0.90±0.032)0.95±0.112)BDNF 1.00±0.05 0.65±0.091)0.86±0.092)0.90±0.092)
4 討 論
中醫學將AD 歸于“呆病”“郁證”“癲證”等范疇,對于AD 不同階段的病機、治則、治法尚未達成共識。AD 主要臨床表現為認知功能障礙,有研究發現AD 的基本病機為:心氣虛衰,氣不生神,為本虛;痰滯瘀阻,蒙蔽神竅為標實。 根據“緩則治其本”“治病必求于本”的原則,從“心”入手,調心氣可以治療AD。 調心方中黨參功擅補心氣,安神增智為君;桂枝溫通血脈,振奮心陽為臣;石菖蒲安神益智,開竅為佐;遠志通竅豁痰,增智為使。 諸藥配伍具有益心氣化痰開竅之功效[13]。 有臨床研究顯示,調心方能夠改善輕、中、重度AD 患者的認知功能和日常生活能力,通過提高后扣帶回與腦功能區的連接,從而達到改善腦功能的作用[14]。 有基礎研究發現,調心方可以抑制神經細胞凋亡、乙酰膽堿的水解、膠質細胞激活、Tau 蛋白的過度磷酸化、Aβ 寡聚體的生成,減輕神經炎癥反應、抗氧化應激等多個靶點和途徑,從而達到改善AD 發生、發展的作用。 但有關于調心方是如何改善AD 患者學習記憶能力的具體作用機制還不夠明確,因此本研究嘗試基于αCaMKⅡ-CREB-BDNF 信號通路探討調心方對APP/PS1 雙轉基因AD 小鼠學習記憶和突觸可塑性的影響,以期為探討調心方改善AD 患者學習記憶能力的具體作用機制提供依據。
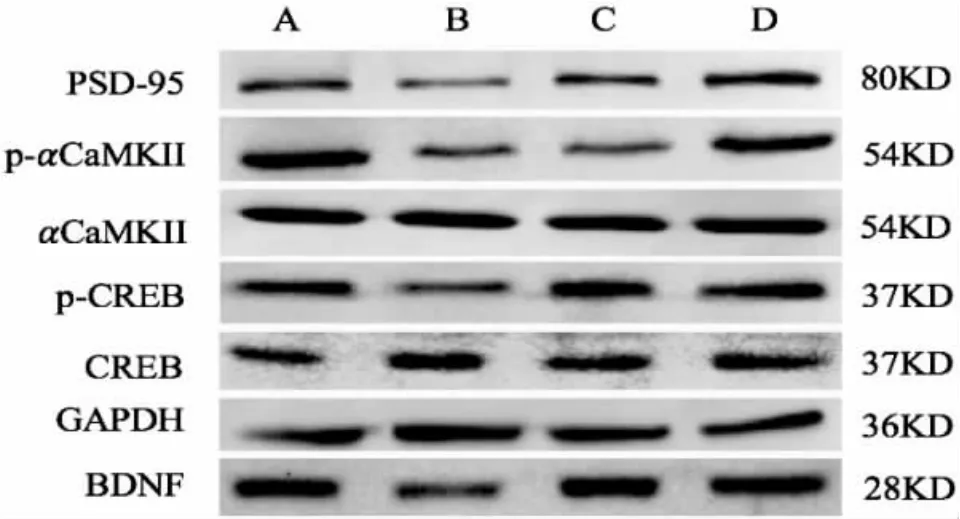
圖 3 4 組海馬區 p-αCaMKⅡ,p-CREB,BDNF 和PSD-95 的蛋白條帶顯影Figure 3 Protein band development on p-αCaMKⅡ, p-CREB, BDNF and PSD-95 protein expression of the hippocampus in four groups
4.1 調心方能夠改善APP/PS1 雙轉基因AD 小鼠海馬突觸可塑性
LTP、PPF、I/O 是突觸功能可塑性的 3 個重要電生理指標。本研究結果顯示,4 組分組效應和刺激強度效應均無明顯區別;分組和刺激時間因素無明顯的交互作用;在0.1~0.7 mA 刺激強度下,4 組小鼠海馬 I/O 曲線斜率無明顯區別;在 50、100、200、250 ms的不同刺激間隔下,4 組PPF 易化無明顯區別。 這說明APP/PS1 小鼠海馬LTP 的損傷與基本突觸傳遞和突觸前神經遞質釋放無關,APP/PS1 雙轉基因小鼠的基本突觸傳遞效能無發生障礙,這提示6 月齡的APP/PS1 小鼠海馬LTP 的損傷與基本突觸傳遞和突觸前神經遞質釋放無關。 第50~60 min 的海馬fEPSP 斜率組間比較結果顯示,與正常組比較,模型組小鼠fEPSP 斜率明顯降低,提示模型組小鼠海馬LTP 受損。 與模型組比較,調心方組fEPSP 斜率均明顯提高。這說明調心方可改善APP/PS1雙轉基因AD 小鼠LTP 的抑制,改善其突觸傳遞效能,從而提高突觸可塑性,改善學習記憶能力。 這與ROLLAND 等[15]發現突觸可塑性與神經系統的發育、損傷、修復及學習記憶等密切相關的研究結果一致。
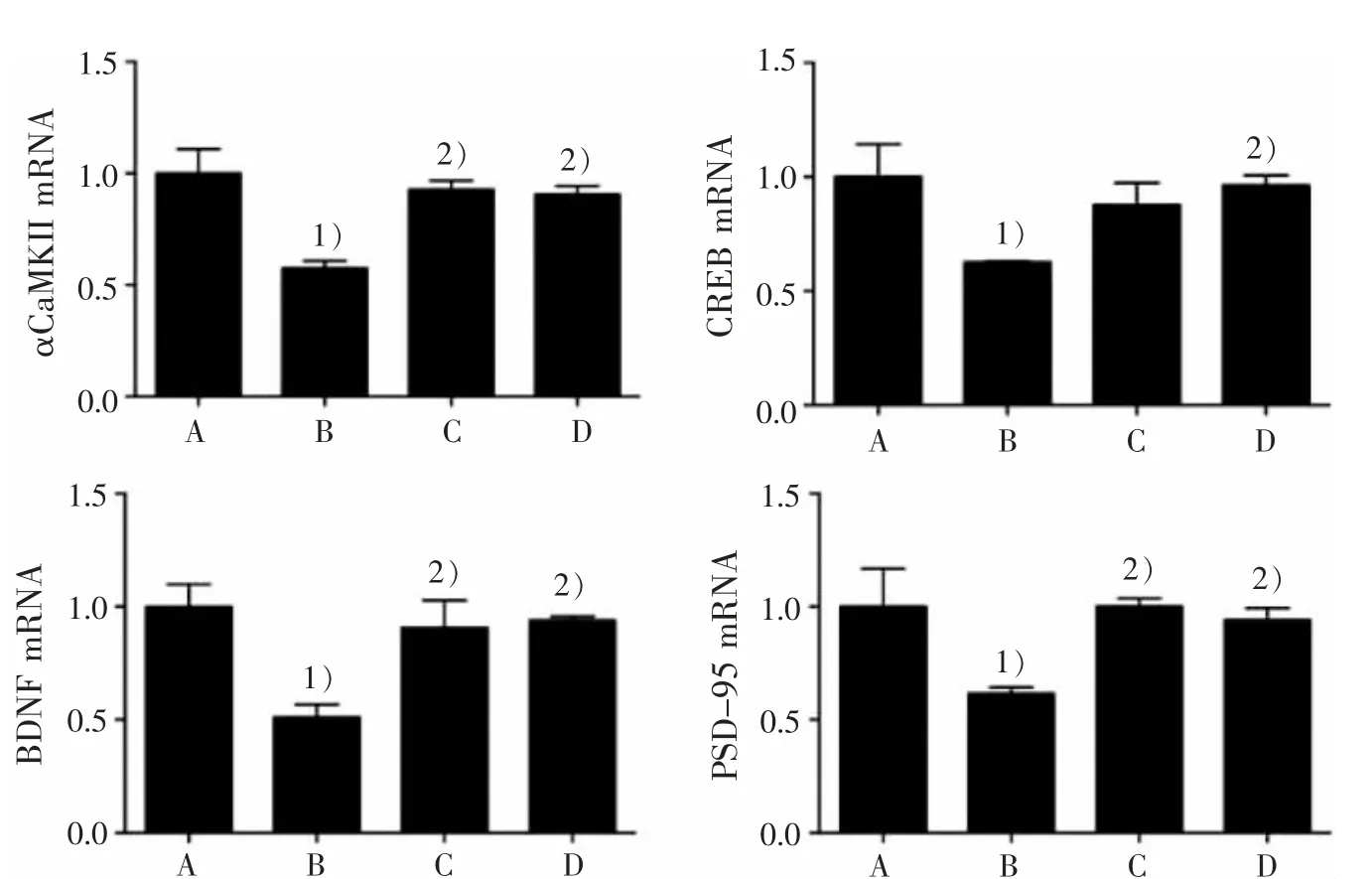
圖 4 4 組海馬區 p-αCaMKII,p-CREB,BDNF 和 PSD-95 的蛋白表達比較Figure 4 Comparison of p-αCaMKⅡ, p-CREB, BDNF and PSD-95 protein expression of the hippocampus in four groups
此外,本研究還發現,與正常組比較,6 月齡的APP/PS1 雙轉基因 AD 小鼠海馬 PSD-95 蛋白和mRNA 表達明顯降低;與模型組比較,調心方組小鼠海馬區的PSD-95 mRNA 和蛋白表達明顯提高。這說明APP/PS1 雙轉基因AD 小鼠腦內有突觸可塑性受損的現象,LTP 受到抑制;經過調心方治療后PSD-95 的蛋白活性和基因表達明顯提高,LTP 抑制得到改善,突觸可塑性提高,從而改善學習和記憶能力。 突觸后致密物在突觸可塑性中具有重要作用,PSD-95 蛋白通過與突觸后致密區多種蛋白分子的相互作用,起到了調節突觸可塑性的功能,它在LTP 的形成及維持過程、突觸可塑性、學習記憶等方面具有關鍵性的作用[16]。APP /PS1 雙轉基因 AD小鼠海馬PSD-95 蛋白活性明顯降低,PSD-95 異常表達會導致LTP 受到抑制,進而誘發突觸可塑性發生改變,使AD 小鼠出現依賴海馬的學習記憶功能的缺陷,這與魏鵬[17]的研究結果一致。
4.2 調心方能夠調節APP/PS1 雙轉基因AD 小鼠海馬αCaMKⅡ-CREB-BDNF 信號通路水平
αCaMKⅡ通過Thr286 位點自身磷酸化成為活化狀態,它的激活是其突觸功能調節及學習記憶的結構基礎[18],是 LTP 形成的重要介質,對實現信息的儲存具有重要作用。 Ca2+進入細胞內與CaM 結合形成Ca2+-CaM,能夠活化CaMKI,磷酸化后的αCaMKⅡ可以直接活化 CREB[19]。 CREB 是 LTP 產生的重要調節因子,CREB 缺失會導致LTP 出現明顯損傷[20],它位于 133 位點的絲氨酸殘基(Ser133)的磷酸化對多種與學習記憶相關的基因轉錄起著重要作用。BDNF 是CREB 的經典下游靶基因,其基因啟動子區域含有CRE 序列,CREB 可與CRE 序列結合,引起 BDNF 的轉錄增加[21],BDNF 是 LTP 和突觸傳遞重要的調節器之一,在突觸可塑性、長時記憶的形成等方面起到重要作用。
本研究結果顯示,與正常組比較,模型組海馬p-αCaMKⅡ、p-CREB、BDNF 蛋白水平和 αCaMKⅡ、CREB 和BDNF mRNA 明顯降低,這與模型組PSD-95 表達、LTP 受到抑制的結果相互印證;與模型組比較,調心方組海馬 p-αCaMKⅡ、p-CREB、BDNF蛋白水平和 αCaMKⅡ、CREB 和 BDNF mRNA 表達明顯提高。 這提示,調心方組能有效改善APP/PS1雙轉基因AD 小鼠海馬αCaMKⅡ-CREB-BDNF 信號通路水平。 調心方可能通過激活αCaMKⅡ,上調了αCaMKⅡ的磷酸化蛋白水平及αCaMKⅡmRNA表達,進而激活其下游的CREB,使得CREB 磷酸化水平及CREB mRNA 表達增加,促進其下游BDNF的基因轉錄和蛋白合成,提高 BDNF mRNA 和BDNF 蛋白表達;BDNF 表達增加可在αCaMKⅡ的翻譯過程中上調PSD-95 磷酸化水平,引起TrkB 對BDNF 的敏感性增加,從而激活 CREB-BDNF 信號通路,使突觸可塑性發生改變,提高LTP,從而改善突觸可塑性及學習記憶能力。 這與ESCOBAR 等[22-23]等研究結果一致。
5 小 結
調心方能夠改善APP/PS1 雙轉基因AD 小鼠海馬CA1 區 LTP、提高PSD-95 mRNA 和蛋白的表達,從而改善APP/PS1 雙轉基因AD 小鼠學習記憶功能和突觸可塑性,其作用機制可能與其上調海馬αCaMKⅡ-CREB-BDNF 信號通路水平有關。

