超聲對小麥蛋白水解物美拉德反應進程的影響
(湖北大學知行學院,湖北武漢 430011)
小麥是西方飲食中常見的谷物,是蛋白質的重要來源。近年來,小麥蛋白水解后生成的一些功能性多肽,如色氨酸、酪氨酸等,具有良好的抗氧化性、抑菌性、乳化性等功能特性[1-2]。但小麥蛋白水解相關產物存在一些問題,產物的抗氧化能力遠遠低于合成抗氧化劑的抗氧化能力。因此,需要尋求一種有效安全的方法提高蛋白質的功能特性。大量研究發現,美拉德反應產物如類黑素、中間物質、還原酮,具有良好的抗氧化效果。然而,KIM等認為美拉德反應易受到內部因素(如pH值、溫度、時間等)以及外部環境因素(如微波、超聲等)的影響[3]。環境因素對美拉德反應進程中產物形成的影響已經引起廣泛的關注。
現階段,關于超聲的研究已經引起廣泛的關注,超聲波可以改善各種食品的化學、物理和功能特性。超聲被定義為頻率大于20 kHz的一種安全且環保的高頻聲波。超聲波目前被認為是研究和評估這些生物分子行為的有用工具,其中超聲技術可以改善蛋白質功能性。值得注意的是,超聲波在改善美拉德反應產物功能性質方面有許多報道。STANIC等研究發現,超聲作用對蛋白質與不同種類多糖的美拉德反應產物具有一定的促進作用[4],能增強產物的抗氧化作用,但目前的研究主要集中在超聲作用對于蛋白質美拉德反應過程的影響,而關于超聲對蛋白質水解物美拉德反應的研究還未見報道。本文以小麥蛋白水解物為原料,研究超聲對小麥蛋白水解物美拉德反應進程影響,測定美拉德反應褐變程度、中間產物變化、接枝度、產物熒光強度、內源性熒光強度以及紫外吸收光譜等指標,以期為開發食品中天然抗氧化劑提供研究基礎。
1 材料與方法
1.1 材料與試劑
小麥蛋白(蛋白質含量≥75%):廣州千勝精細化工有限公司;葡萄糖:安徽生物科技有限公司;堿性蛋白酶(100 000 U/g~200 000 U/g):美國 Sigma公司;甲醇、硼砂、β-巰基乙醇、鄰苯二甲醛、8-苯胺-1-萘磺酸(均為分析純):上海穎心實驗室設備有限公司。
1.2 儀器與設備
JD500-2型電子天平:上海五久自動化設備有限公司;GL-21M型冷凍離心機:上海赫田科學儀器有限公司;UT-1800型紫外可見光分光光度計:北京華旭世紀科技有限公司;DK-8B型電熱恒溫水浴鍋:上海浦予工業科技有限公司;JY-92-ⅡN型超聲波細胞粉碎機:寧波新芝生物科技股份有限公司;JB-2型恒溫磁力攪拌器:常州榮華儀器制造有限公司。
1.3 試驗方法
1.3.1 小麥蛋白水解物的制備
稱量一定質量的小麥蛋白粉,配制成60 mg/mL的小麥蛋白溶液,磁力攪拌4 h。加入堿性蛋白酶(酶與底物濃度質量比為1∶50),45℃水浴水解2 h,緩慢加入1 mol/L的NaOH溶液保持pH值約為8.0。然后于95℃水中加熱10 min,冰浴冷卻使其達到25℃,最后用1 mol/L的HCl調pH值至7.0。將得到的水解物進行冷凍干燥得到凍干粉,使用雙縮脲方法測定蛋白水解物的含量,以便后期試驗使用。
1.3.2 小麥蛋白水解物的美拉德反應產物
將小麥蛋白水解物配制成30 mg/mL的溶液,與30 mg/mL葡萄糖溶液按照1∶1的質量比進行混合,磁力攪拌使其完全溶解,調節混合溶液的pH值至8.0,于95℃水浴鍋加熱180 min,超聲功率為300 W,時間為 0、20、40、60、80 min,冷卻至 25℃。
1.3.3 中間產物以及褐變程度分析
將樣品調至蛋白質濃度為2mg/mL,分別在294 nm和420 nm處測量其吸光值。
1.3.4 接枝度測定
參照KIM等的方法并略作改動[5]。將樣品用去離子水稀釋至蛋白濃度為2 mg/mL,取200 μL樣品于10 mL離心管中,加入4 mL的鄰苯二甲醛(o-phthaldialdehyde,OPA)溶液,充分混勻,于35℃水浴加熱2min,冷卻至25℃,340 nm處測其吸光值。
1.3.5 表面疏水性測定
將樣品稀釋成蛋白質濃度分別為1.00、0.75、0.5、0.25 mg/mL,將2 mL樣品與10 μL的8-苯胺-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS)溶液混勻,在370 nm激發波長下測定其熒光強度。
1.3.6 熒光光譜分析
參照LI等的方法并略作調整[6]。將樣品稀釋成蛋白濃度為1 mg/mL。反應產物的激發波長為347 nm,掃描范圍為370 nm~550 nm;內源性熒光光譜的激發波長為280 nm,掃描范圍為300 nm~400 nm,狹縫寬度為5 nm。
1.3.7 紫外光譜分析
將樣品稀釋至蛋白質濃度為1 mg/mL。紫外掃描光譜范圍200 nm~350 nm。
1.4 統計分析
每個試驗重復進行3次。數據統計分析采用Statistix 8.1(分析軟件St Paul,MN)軟件包中Linear Models程序進行,差異顯著性(P<0.05)分析使用Tukey HSD程序,采用Sigmaplot 12.0軟件作圖。
2 結果與分析
2.1 褐變程度變化
超聲時間對小麥蛋白水解物的美拉德反應褐變程度、中間產物以及接枝度的影響見表1。

表1 超聲時間對小麥蛋白水解物的美拉德反應褐變程度、中間產物以及接枝度的影響Table 1 Effects of ultrasonic time on browning degree,intermediate product and graft degree of wheat proteolytic protein in Maillard reaction
小麥蛋白水解物和多糖加熱條件下發生美拉德反應,但美拉德反應過程經常出現褐變,這可能是由于美拉德反應的高級階段形成一種棕色的物質,稱為類黑精。根據這些物質在420 nm的吸光值來確定其褐變程度。由表1可知,隨著超聲時間的增加,褐變程度呈現先逐漸升高后逐漸降低的趨勢(P<0.05)。當超聲時間為40 min時,褐變程度最大。表明超聲作用破壞多肽的三級以及四級結構,從而產生更多的游離氨基酸。李曉東等研究發現類黑精含有短鏈氨基酸序列,具有良好的抗氧化效果[7]。隨著超聲時間的繼續延長,可能超聲作用造成蛋白水解物的結構過度伸展,使得多肽的活性降低,因此不利于美拉德反應的進行。
2.2 中間產物和接枝度變化
美拉德反應過程中,糖類物質會裂解產生一些無色的酮類及醛類小分子,我們可以根據294 nm下的吸光值判斷其中間產物的多少。由表1可知,隨著超聲時間的增加,294 nm處的吸光值出現先升高后下降的趨勢(P<0.05)。隨著超聲時間的增加,多肽結構完全被打開,內部固有的氨基基團被暴露。美拉德反應過程中游離氨基的數量通過計算可以得到接枝度,因此接枝度可以用來反映美拉德反應的程度。由表1可以看到,隨著超聲時間的延長,接枝度顯著增加,超聲時間為40 min時,接枝度達到最大值,為16.8%(P<0.05)。BYCKOW等研究發現超聲作用可能導致小麥蛋白水解物內部更多的親水性氨基酸游離出來,同時超聲可以引起局部相對平移運動可能使得反應基團相互靠近,因此導致蛋白質水解物的氨基與多糖的糖基共價交聯,增加美拉德反應速度[8]。超聲時間過長導致小分子肽的聚集,并且此結果與褐變程度以及中間產物結果一致。
2.3 表面疏水性分析
超聲時間對小麥蛋白水解物的美拉德反應表面疏水性的影響如圖1所示。

圖1 超聲時間對小麥蛋白水解物的美拉德反應表面疏水性的影響Fig.1 Effect of ultrasonic time on the surface hydrophobicity of wheat protein hydrolysates in Maillard reaction
經過超聲處理后,樣品的表面疏水性增加,這與前面內源性熒光光譜的結果一致。隨著超聲時間的增加,由于超聲具有一定的空穴作用,暴露更多的疏水性氨基酸殘基,因而導致表面疏水性的增加。但是超聲時間過長導致蛋白質分子電荷重新分布,內部的氨基酸殘基發生聚集折疊現象導致疏水性氨基酸無法暴露出來,隱藏在分子內部。
2.4 熒光光譜分析
超聲時間對小麥蛋白水解物的美拉德反應產物熒光光譜的影響如圖2所示。
由圖2(A)可知,超聲前期,美拉德反應產物的熒光強度呈現逐漸增加趨勢,超聲時間為40 min時,熒光強度達到最大值。這可能是由于多肽表面部分氨基酸殘基暴露,并且在美拉德反應過程中移向更加親水的微環境。然而,當超聲時間超過40 min,熒光強度呈現降低的趨勢,這歸因于與多肽結合的多糖鏈的屏蔽效應。此外,最大的熒光發射波長處于420 nm~440 nm范圍內,這與美拉德發光熒光體的特征波長一致。
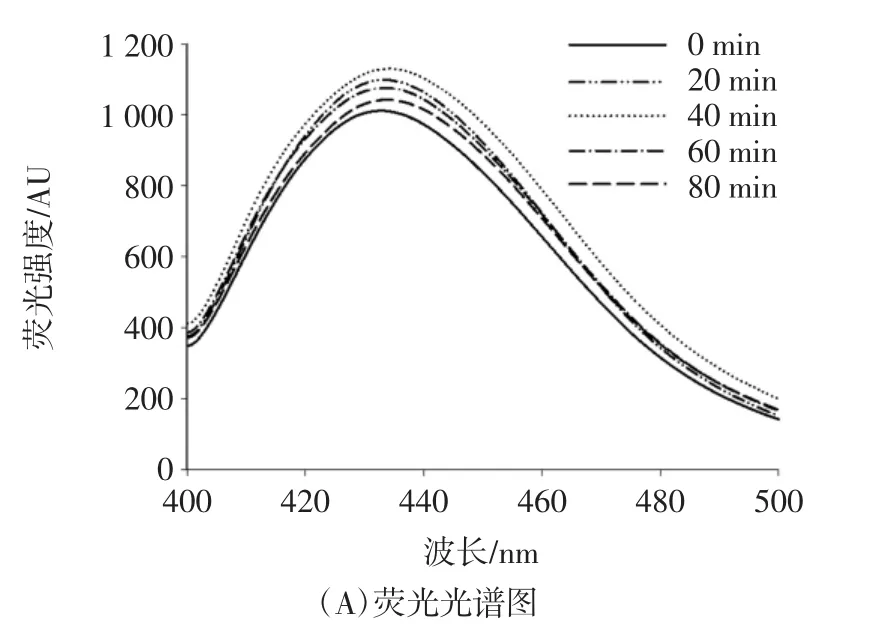
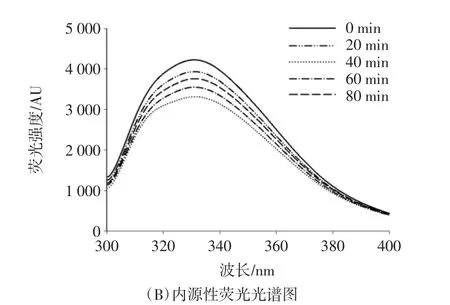
圖2 超聲時間對小麥蛋白水解物的美拉德反應產物熒光光譜的影響Fig.2 Effect of ultrasonic time on fluorescence spectra of Maillard reaction products of wheat proteolytic products
內源性熒光光譜可以用來反映芳香族氨基酸(主要是色氨酸和酪氨酸)熒光強度的變化,從而間接反映蛋白質三級結構的變化,進而反映美拉德反應進行的程度。由圖2(B)可知,與為超聲的樣品相比,超聲顯著降低了內源性熒光光譜的強度。隨著時間的增加,熒光光譜逐漸升高,在40 min時達到最大值,然后逐漸降低。說明超聲時間導致蛋白水解物的構象發生一定的變化,芳香族氨基酸暴露在更加親水的環境中,特征吸收峰改變,引起熒光淬滅。然而,過度的超聲時間處理導致多肽發生去折疊現象,導致熒光強度增加。
2.5 紫外吸收光譜分析
超聲時間對小麥蛋白水解物的美拉德反應紫外光譜的影響如圖3所示。

圖3 超聲時間對小麥蛋白水解物的美拉德反應紫外光譜的影響Fig.3 Effect of ultrasonic time on ultraviolet absorption spectrum of Maillard reaction of wheat protein hydrolysate
隨著超聲時間的增加,紫外吸收值先呈現逐漸增加的趨勢,表明席夫堿的生成量逐漸增加。超聲波使得一些氨基酸殘基如芳香族氨基酸的空間結構發生改變,暴露更多的發光基團,導致紫外吸光值的增加。YU等研究發現,一些氨基酸如精氨酸與葡萄糖美拉德反應產物的吸收峰有兩個,分別是265 nm和215 nm[9]。這與我們的研究結果不一致,可能有蛋白水解物有關。
3 結論
超聲處理可以改善小麥蛋白水解物美拉德反應的進程,其產物均高于非超聲對照組。超聲40 min時,美拉德反應的褐變程度、中間產物以及接枝度均具有最大值,但是隨著超聲時間的進一步增加,由于蛋白質聚集導致其美拉德反應速率降低,產物生成量降低。另外,熒光光譜、紫外光譜以及表面疏水性也充分證明其多肽結構的變化,從而影響美拉德反應的進行。因此,控制超聲時間在40 min內,可提高美拉德反應的速率,進而提高其功能特性。

