棉花黃萎病菌VdHP1的克隆及功能分析
孫琦,何芳,邵勝楠,劉政,黃家風
棉花黃萎病菌的克隆及功能分析
孫琦,何芳,邵勝楠,劉政,黃家風
(石河子大學農學院/新疆綠洲農業病蟲害治理與植保資源利用重點實驗室,新疆石河子 832003)
【】明確棉花黃萎病菌(大麗輪枝菌)中一個新基因()的功能,為解析棉花黃萎病菌的致病機制以及棉花黃萎病的防治提供依據。以大麗輪枝菌野生型菌株V592的基因組DNA和cDNA為模板,對全長進行克隆并測序;利用逆轉錄實時熒光定量PCR(RT-qPCR)分別對棉花根系誘導不同時間的表達量及V592菌株不同組織中的表達量進行測定;構建針對的敲除載體、互補載體和過表達載體,通過農桿菌介導的遺傳轉化篩選基因敲除突變體、互補菌株和過表達菌株;以野生型菌株V592為對照,對基因敲除突變體及互補菌株的菌落及菌絲形態進行觀察,并對微菌核量、產孢量及致病力進行測定;通過RT-qPCR測定其他致病力相關的基因在基因敲除突變體及過表達體菌株中的表達情況。全長為862 bp,預測編碼蛋白含268個氨基酸,與GenBank中已注釋的基因沒有任何的序列相似性。野生型菌株V592受棉花根系誘導6—12 h時表達水平顯著上調,表明在大麗輪枝菌侵染早期發揮作用。在分生孢子中的表達量顯著高于在菌絲和微菌核中的表達量,表明在大麗輪枝菌不同組織中的表達具有差異性。與野生型菌株V592相比,基因敲除突變體產孢量和產孢梗顯著減少,菌絲分支呈螺旋狀,對棉花的致病力明顯下降。與侵染釘形成相關基因(、、)、分泌蛋白釋放相關基因()及分生孢子產生相關基因(、、、、、、)在基因敲除體中的相對表達量顯著下調,在過表達菌株中上調;而與黑色素合成相關基因(、、、)在基因敲除突變體中則顯著上調,在過表達菌株中下調。與大麗輪枝菌分生孢子和產孢梗的產生有關,參與大麗輪枝菌致病;對與侵染釘形成、分泌蛋白釋放及分生孢子產生相關基因的表達具有正調控作用,對黑色素合成相關基因的表達具有負調控作用。
棉花黃萎病;大麗輪枝菌;;產孢;致病力;轉錄表達
0 引言
【研究意義】棉花黃萎病(cotton verticillium wilt)是威脅我國棉花生產的一種重要土傳病害,由大麗輪枝菌()引起[1]。目前有關該病原菌致病機制的解析尚不全面,加之其特殊的存活方式,黑色微菌核可在土壤中存活多年,使得依賴傳統方法進行防治難以奏效[2]。因此,通過基因功能鑒定找到調控大麗輪枝菌致病機制的關鍵因子,對全面解析大麗輪枝菌致病機制,以及利用靶基因進行棉花抗病育種和探索新型防治方法具有重要的理論價值。【前人研究進展】近年來有關大麗輪枝菌致病相關基因及致病機制的研究取得了較大進展,大致分成4種情況:第1類基因編碼效應子蛋白,通過干擾或阻止植物免疫過程參與致病,如編碼的聚多糖脫乙酰酶,通過對真菌細胞壁組分幾丁質寡糖進行脫乙酰作用,阻止幾丁質寡糖觸發免疫信號傳遞,進而抑制寄主的免疫反應[3];編碼的分泌蛋白直接作用于調節植物免疫的轉錄因子以阻止植物的免疫反應[4];此類效應子蛋白還有VdNLP1、VdNLP2[5-6]和VdCUT11[7]。第2類基因通過形成侵入結構或分泌結構參與致病,如和編碼的蛋白復合體定位于附著枝細胞膜,通過促進胞質內活性氧和鈣離子的積累激活VdCrz1轉錄因子及鈣離子信號途徑,從而調控附著枝分化形成侵染釘,/基因敲除導致附著枝不能形成侵染釘,進而使大麗輪枝菌喪失致病力[8];VdSep5蛋白在侵染釘與其侵入寄主后的侵染性菌絲之間形成一種環狀結構,即在大麗輪枝菌與寄主互作界面形成菌絲頸環用于分泌蛋白的釋放和輸出[9]。第3類基因編碼轉錄因子,這類基因通常不僅影響致病力,也參與大麗輪枝菌的產孢、微菌核(或黑色素)形成,如轉錄因子基因和敲除后分別影響大麗輪枝菌的穿透能力和在寄主體內的定殖,并導致大麗輪枝菌產孢量下降、微菌核減少,進一步研究發現,SOM1和VTA3共同調控與產孢、微菌核形成及毒力相關基因的表達[10];Vdpf轉錄因子通過cAMP依賴信號途徑和G蛋白信號途徑調控大麗輪枝菌黑色素形成、并且還通過調控與產孢及毒力相關基因的表達影響大麗輪枝菌的致病力和產孢量[11];此類轉錄因子還有VdSge1、VdCmr1、VdHapX等[12-14]。第4類基因通過信號途徑參與大麗輪枝菌致病,同時也參與分生孢子、微菌核或黑色素的形成過程,如MAPK信號途徑中編碼的跨膜蛋白與Vst50-Vst7-Vst11蛋白模塊共同調控大麗輪枝菌黑色素形成和穿透能力,黑色素含量與大麗輪枝菌的穿透能力密切相關[15];此外,該信號途徑中的、、分別敲除均導致大麗輪枝菌致病力下降并伴隨產孢量下降和微菌核減少[16-18];又如和分別通過cAMP依賴信號途徑和G蛋白信號途徑對大麗輪枝菌的致病力、產孢量和微菌核形成產生影響[19-20]。綜上所述,參與大麗輪枝菌致病的基因很多,致病機制復雜,各基因參與的途徑之間相互作用,共同決定了大麗輪枝菌對寄主的致病作用。【本研究切入點】筆者課題組從前期已構建的大麗輪枝菌T-DNA插入突變體庫中篩選到一株致病力顯著下降的突變菌株,通過鑒定發現,被插入突變的基因是VDAG_07100基因,其預測編碼蛋白(hypothetical protein)沒有功能注釋,因此將其命名為。除了影響大麗輪枝菌的致病力外,其他生物學功能尚不明確。【擬解決的關鍵問題】從大麗輪枝菌強致病力菌株V592中克隆,并對在棉花根誘導條件下的轉錄表達及不同組織中的轉錄表達進行分析;通過獲得的敲除突變體菌株、互補菌株和過表達菌株,研究該基因對大麗輪枝菌生長發育、致病力及對其他致病相關基因的影響,明確的生物學功能。
1 材料與方法
試驗于2018年6月至2019年8月在新疆石河子大學新疆綠洲農業病蟲害治理與植保資源利用重點實驗室完成。
1.1 材料
1.1.1 菌株和質粒 大麗輪枝菌V592菌株由本實驗室分離、鑒定并保存。p克隆載體購自TaKaRa公司。敲除載體p和過表達載體p由中國科學院微生物研究所郭惠珊研究員惠贈。互補載體p由本實驗室構建并保存。
1.1.2 植物材料 棉花品種為感病品種軍棉1號。
1.2 VdHP1的克隆與測序
參考宋雯等[21]的方法,利用真菌DNA提取試劑盒(BioFlux)及Trizol(QIAGEN)法分別提取V592菌株的DNA和RNA;用反轉錄試劑盒(TaKaRa)將RNA反轉錄成cDNA。根據大麗輪枝菌VdLs.17菌株的VDAG_07100基因序列(NCBI),設計引物full-F(5′-ATGCGTTTCTTCGCCTTTTT-3′)和full-R(5′-TAGTCCATTCTGATCCATGT-3′),分別以V592的DNA和cDNA為模板擴增的全長和CDS序列并測序。
1.3 VdHP1在大麗輪枝菌中的表達
1.3.1 棉花根誘導條件下的表達 挑選粒大飽滿的軍棉1號種子,剝去種皮后置于0.1%的升汞溶液中消毒處理30 min,用清水漂洗3遍,放入裝有40 mL MS培養基的三角瓶中,暗培養7 d。待根長至5—10 cm時剪取2 g棉花根段,添加至100 mL Czapek-Dox液體培養基中;再將PDA上培養7 d的V592菌株,取10個直徑1 cm的菌餅加入,分別在26℃、200 r/min培養2、4、6、8、10、12、24和48 h;分別以未加棉花根系在同樣條件下培養的V592菌株為陰性對照;剔除棉花根段,參照方法1.2,提取各菌株的總RNA并反轉錄成cDNA;按照SYBR(Life Technologies)試劑盒說明添加樣品,通過qPCR反應分析受棉花根系誘導后的表達特征。qPCR反應在7500實時PCR系統(Life Technologies)中完成,以作為內參基因對目標基因的轉錄水平進行標準化,每種菌株設3次生物學重復,每個反應設3次重復,根據2-ΔΔCt方法進行數據處理,再利用SPSS 17.0軟件進行統計分析。
1.3.2在大麗輪枝菌不同組織中的表達 參考王春巧等[22]的方法,分別收集V592菌株的菌絲體、分生孢子和微菌核,提取各組織的總RNA并反轉錄成cDNA,利用上述qPCR方法分析在不同組織中的表達情況。
1.4 載體構建及真菌轉化
構建針對的敲除載體,先用引物up-F和up-R從V592菌株的基因組中擴增基因上游780 bp片段,再用引物down-F和down-R從V592基因組DNA中擴增基因下游782 bp片段。將獲得的2個目標片段與Ⅰ線性化的敲除載體通過多片段重組酶(Vazyme)進行重組構建敲除載體p,再將其通過ATMT方法轉化V592菌株的分生孢子。將獲得的轉化子參考Wang等[23]的PCR方法進行初步篩選。再分別用的特異引物U和L,及的特異引物full-F和full-R對轉化子進行再次篩選。為了獲得互補菌株,用引物EC-F和EC-R從V592菌株的基因組DNA中擴增基因編碼區全長,將其插入到I/H I線性化的互補載體中,通過ATMT轉化基因敲除突變體,對轉化子用抗生素G418和PCR方法進行篩選。為了獲得基因過表達菌株,用引物對OE-F和OE-R從V592菌株中擴增基因編碼區全長,插入到I/I線性化的p載體中。然后通過ATMT方法將該載體轉化V592菌株。最后,用引物-qPCR-F和-qPCR-R通過RT-qPCR對目標基因在野生型菌株、敲除突變體菌株、互補菌株和過表達菌株中的轉錄表達進行確定。載體構建所用引物見表1。

表1 載體構建所用引物
1.5 VdHP1基因敲除突變體生物學性狀的測定
基因敲除突變體的菌落形態、產孢量及微菌核產量參考宋雯等[21]的方法進行測定;菌絲的顯微觀察:將真菌在PDA平板上劃線,再將滅菌的蓋玻片斜插到劃好的線上,26℃暗培養3 d,取出蓋玻片在顯微鏡下觀察菌絲生長情況。玻璃紙穿透試驗:參考Zhao等[8]的方法將滅菌玻璃紙平鋪在MM基本培養基上,用牙簽挑取菌絲接種至玻璃紙中央,分別培養3、4、5、6和7 d揭去玻璃紙,繼續培養7 d觀察真菌穿透玻璃紙后的菌落形成情況。每個菌株設3個重復。
1.6 致病力測定
將棉苗在MS液體培養基中培養至4—5片真葉展開時[21],參照Gao等[24]的無傷浸根接種法用濃度為1×107cfu/mL的孢子懸浮液進行接種,每個菌株接種3個營養缽,每個營養缽12棵棉苗。參考Zhang等[25]的方法進行病情指數統計。
1.7 利用qPCR測定感病植株中真菌生物量
對接種28 d的棉花分別提取根、莖、葉的總DNA,通過qPCR測定其中大麗輪枝菌的生物量。qPCR所用引物ITS-F和ITS-R基于核糖體RNA的ITS1和ITS2區設計[25]。每個反應設3個重復。qPCR反應及數據處理與同1.3.1。
1.8 其他致病相關基因在VdHP1基因敲除突變體中的表達量測定
通過RT-qPCR對大麗輪枝菌其他致病相關基因在野生型菌株V592、敲除突變體和互補菌株中的轉錄水平進行測定。被檢測的致病相關基因及其引物見表2,每個反應設3個重復。RT-qPCR反應及數據處理同1.3.1。
2 結果
2.1 VdHP1克隆
分別以大麗輪枝菌野生型菌株V592的基因組DNA和cDNA為模板,通過克隆測序得到全長為862 bp,預測編碼蛋白的cDNA為807 bp,序列分析顯示,該基因由2個外顯子和1個內含子組成,編碼268個氨基酸。的預測編碼蛋白與大麗輪枝菌VdLs.17同源基因編碼的氨基酸序列相似性為98.95%,與非苜蓿輪枝菌()的D7B24_004502基因編碼的氨基酸序列相似性為94.90%,與苜蓿輪枝菌(.)的VDBG_05451基因編碼的氨基酸序列相似性為94.48%,而與其他真菌沒有任何氨基酸序列相似性;在GenBank中進行檢索,與已注釋的基因沒有任何序列相似性。上述結果表明是輪枝菌屬所特有的基因。
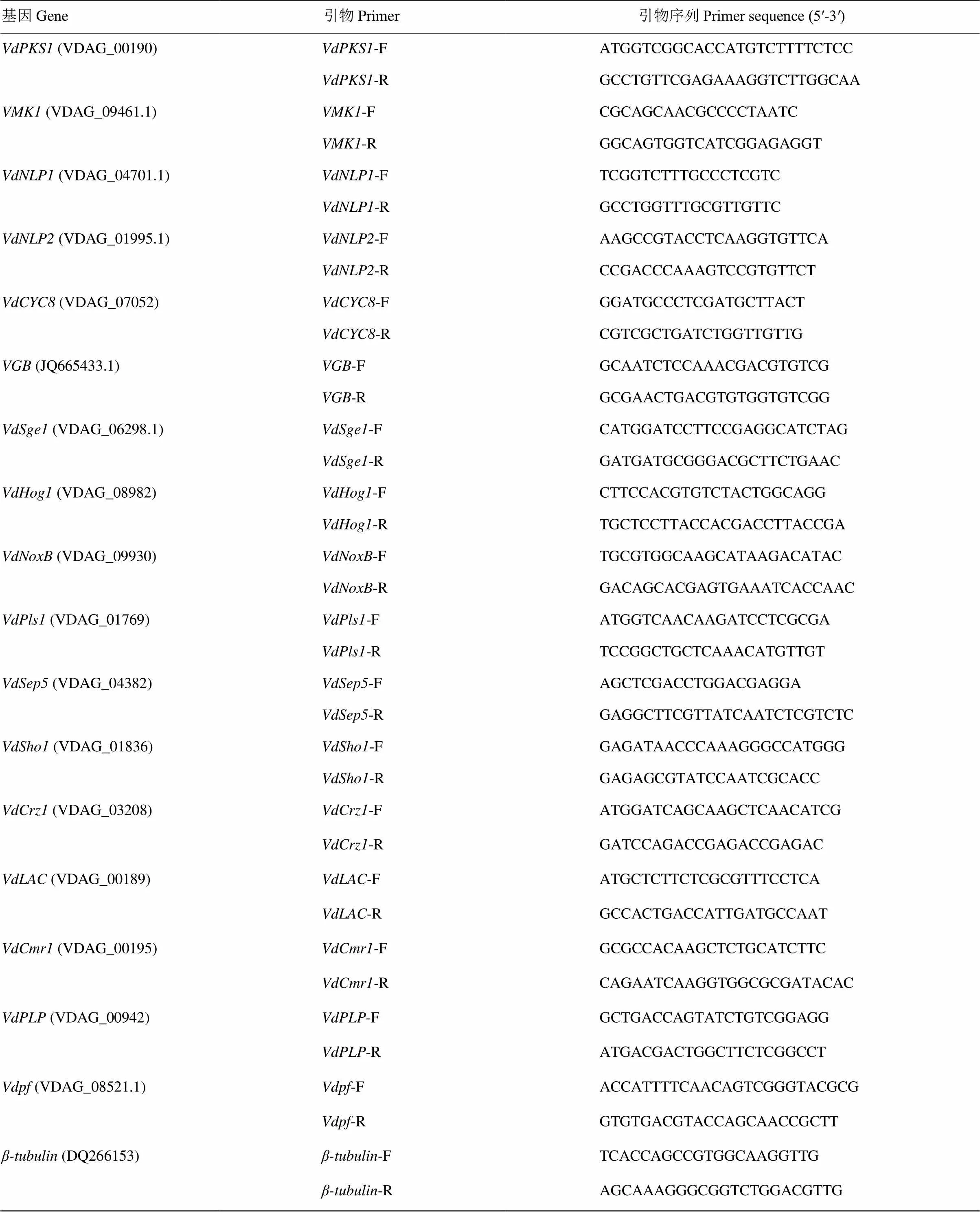
表2 被檢測的致病相關基因及其引物
2.2 VdHP1在大麗輪枝菌中的表達分析
通過RT-qPCR測定受棉花根系誘導后的表達特征,結果顯示V592菌株受棉花根系誘導培養6 h后的表達水平呈現劇烈上調,10 h達到最大值,12 h后轉錄表達水平顯著下降(圖1-A),表明可能在大麗輪枝菌侵染早期發揮作用。
對在大麗輪枝菌不同組織中的轉錄表達水平進行測定,結果發現在分生孢子中的表達量最高,分別是菌絲和微菌核中的14倍和28倍(圖1-B),表明在大麗輪枝菌中的表達具有組織差異性。
2.3 VdHP1基因敲除突變體和互補菌株的篩選
以野生型菌株V592為對照,將PCR初步篩選獲得的2個敲除突變體和互補菌株用2對特異引物進行再次確認,結果如圖2-B所示,用的特異引物只能從2個敲除突變體(和)中擴增出457 bp的基因片段,用的特異引物只能從V592菌株和2個互補菌株(和)中擴增出862 bp全長。上述結果表明在基因組水平上,敲除突變體中已被成功取代,互補菌株中得到回補。再對敲除突變體和互補菌株中的的轉錄表達進行測定,結果如圖2-C所示,在2個敲除突變體和中幾乎不表達,而在互補菌株和中的表達恢復至野生型菌株水平,因此從轉錄水平再次表明,在和中被成功敲除,在互補菌株和中得到互補。
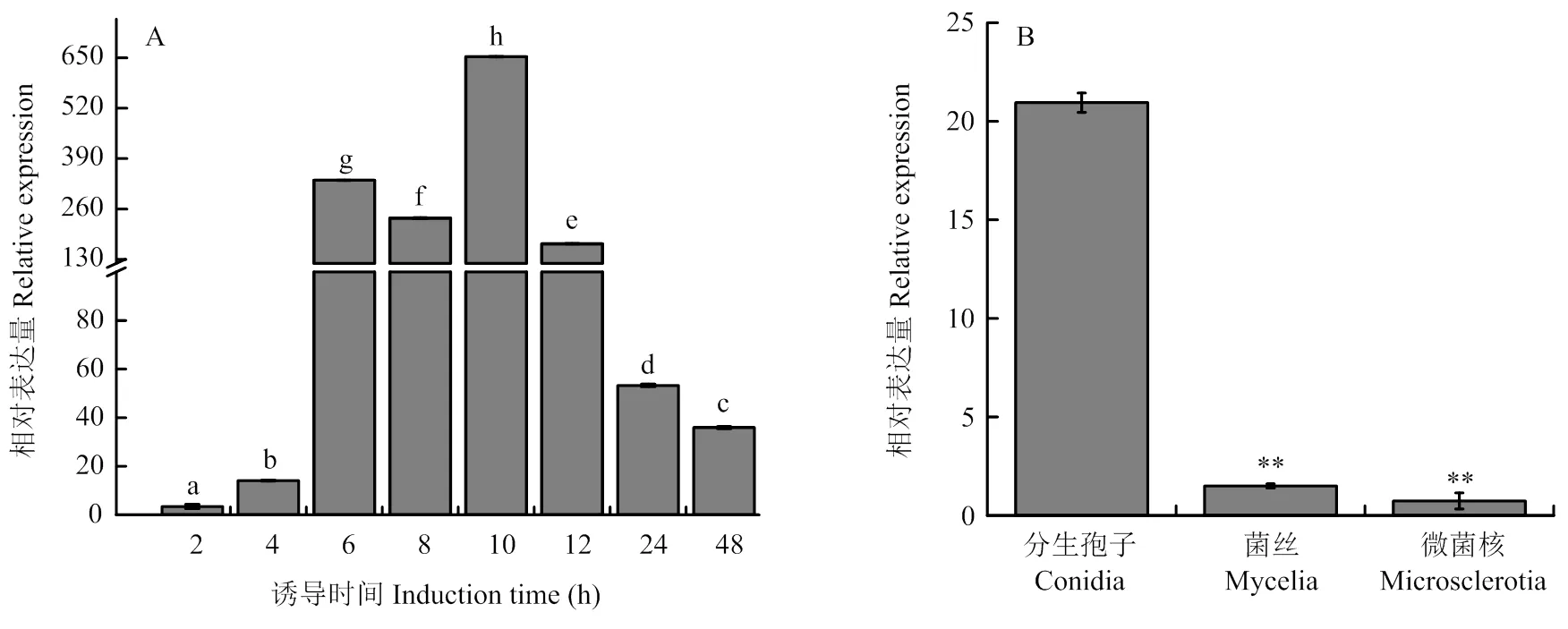
A:V592菌株被棉花根系誘導后VdHP1的轉錄表達VdHP1 transcriptional expression in V592 strain induced by cotton roots;B:VdHP1在V592菌株不同組織中的轉錄表達VdHP1 transcriptional expression in different tissues of V592 strain
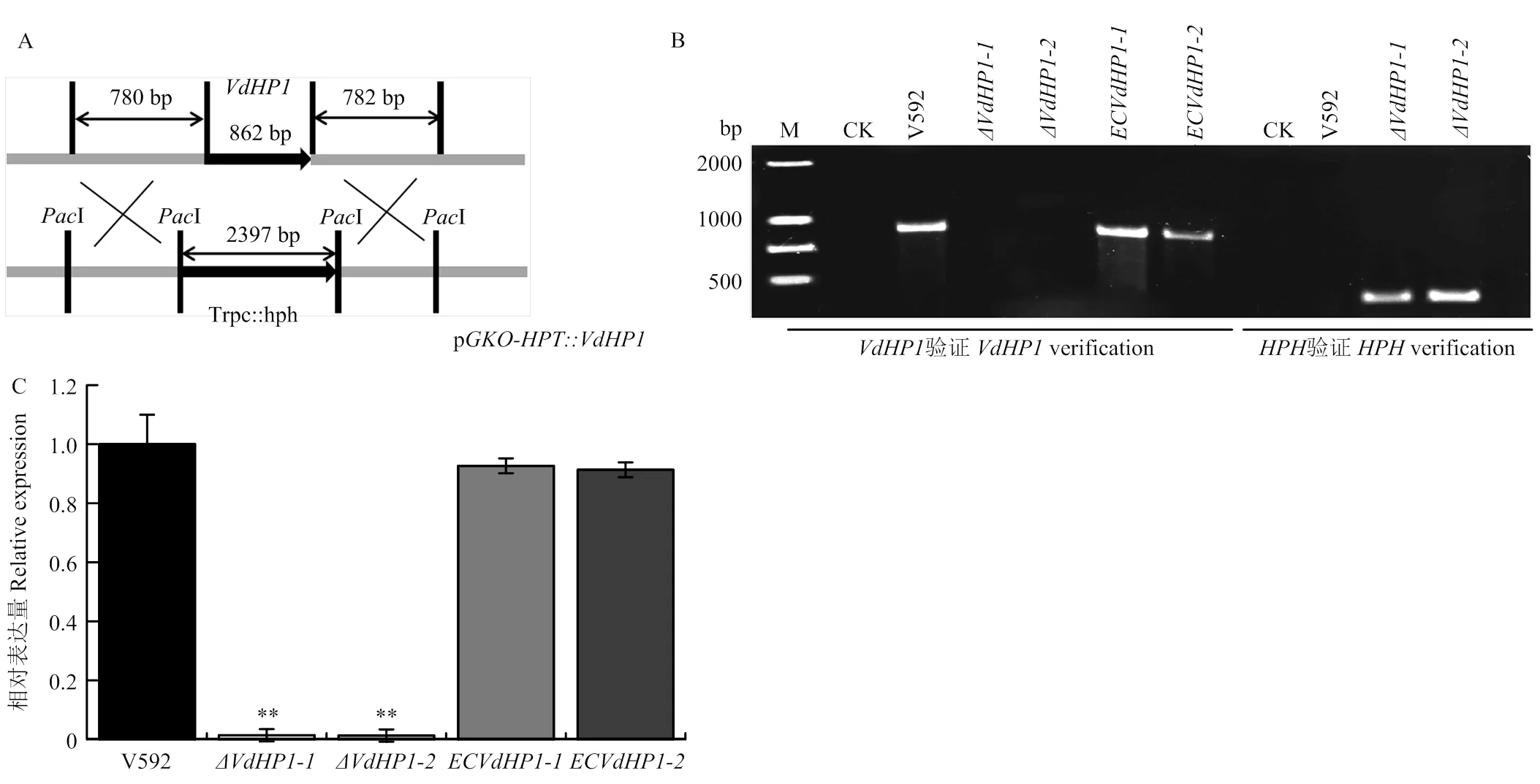
A:VdHP1基因敲除載體構建圖Strategy diagram of VdHP1 knockout vector construction;B:利用特異引物對目標基因VdHP1進行PCR檢測Specific primers were used to detect VdHP1 by PCR;C:利用RT-qPCR對VdHP1的轉錄水平進行確定Confirmation of transcriptional expression of VdHP1 by RT-qPCR analysis
2.4 VdHP1基因敲除突變體表型特征的觀察
在PDA培養基上,基因敲除突變體與V592菌株和互補菌株一樣形成典型的菌核型菌落,菌落生長速度也無明顯差異(圖3-A),說明基因敲除不影響大麗輪枝菌的菌落生長。將等量分生孢子接種在營養缺乏的培養基上誘導微菌核的形成,接種14 d后,2個基因敲除突變體的微菌核干重和濕重與V592菌株和2個互補菌株相比也無明顯差異(圖3-B),表明不參與大麗輪枝菌微菌核的形成。
2.5 VdHP1基因敲除突變體產孢量的測定
與V592菌株相比,2個敲除突變體和的產孢量明顯減少(圖4),在接種第7 天時,和的產孢量分別是V592產孢量的46.62%和45.00%;而2個互補菌株和的產孢量恢復至野生型菌株的水平,表明參與大麗輪枝菌分生孢子的產生。
2.6 VdHP1基因敲除突變體菌絲形態觀察
顯微觀察結果顯示,與野生型菌株V592相比,2個基因敲除突變體分支菌絲呈現螺旋狀,產孢梗減少;而互補菌株和的菌絲體形態和分生孢子梗恢復至野生型水平(圖5)。表明與大麗輪枝菌菌絲形態及產孢梗的形成有關,突變體產孢量的減少可能與產孢梗減少有關。

圖5 顯微鏡下菌絲的形態特征
2.7 VdHP1基因敲除突變體致病力測定
為了明確對大麗輪枝菌致病力的影響,以野生型菌株V592為對照,測定了基因敲除體對棉花的致病力。結果如圖6所示,接種10 d時所有植株開始出現萎蔫癥狀,隨著病情發展,基因敲除突變體導致的病害癥狀與對照相比明顯減輕。接種28 d時,V592菌株引起感病植株葉片萎蔫、焦枯及脫落,病情指數達到95.4,而敲除突變體和所致病害的病情指數則分別為44.3和43.2;互補菌株和對棉花的致病力明顯得到恢復,病情指數分別為92.2和91.1(圖6-A、6-B)。接種30 d時,對感病植株進行剖桿觀察,V592菌株及2個互補菌株均導致棉桿維管束明顯變褐,而接種2個敲除突變體的棉花,其維管束基本不變色(圖6-C)。表明基因敲除影響大麗輪枝菌對棉花的致病力。
為了明確是否影響大麗輪枝菌在寄主體內的定殖能力,通過qPCR對棉花中的真菌生物量進行了測定,結果如圖6-D顯示,基因敲除突變體在根組織中的生物量顯著高于V592菌株和2個互補菌株,而在莖組織中的生物量又顯著低于V592和互補菌株,表明基因敲除導致大麗輪枝菌在棉花莖中的擴展受阻。
為了進一步明確致病力下降是否與菌株的穿透能力下降有關,以V592為對照,對基因敲除突變體和互補菌株進行了玻璃紙穿透試驗,結果如圖6-F所示,V592菌株和2個互補菌株均可在接種第3天時穿透玻璃紙在MM培養基上生長,而基因敲除突變體則在接種第5天時才能穿透玻璃紙。RT-qPCR結果顯示,與野生型V592菌株和互補菌株相比,在基因敲除突變體中,與大麗輪枝菌侵染釘形成相關的2個基因和以及與分泌結構菌絲頸環形成相關基因的表達量均明顯下降(圖6-E)。表明基因敲除導致大麗輪枝菌穿透延遲并且影響侵染釘及菌絲頸環形成相關基因的表達。
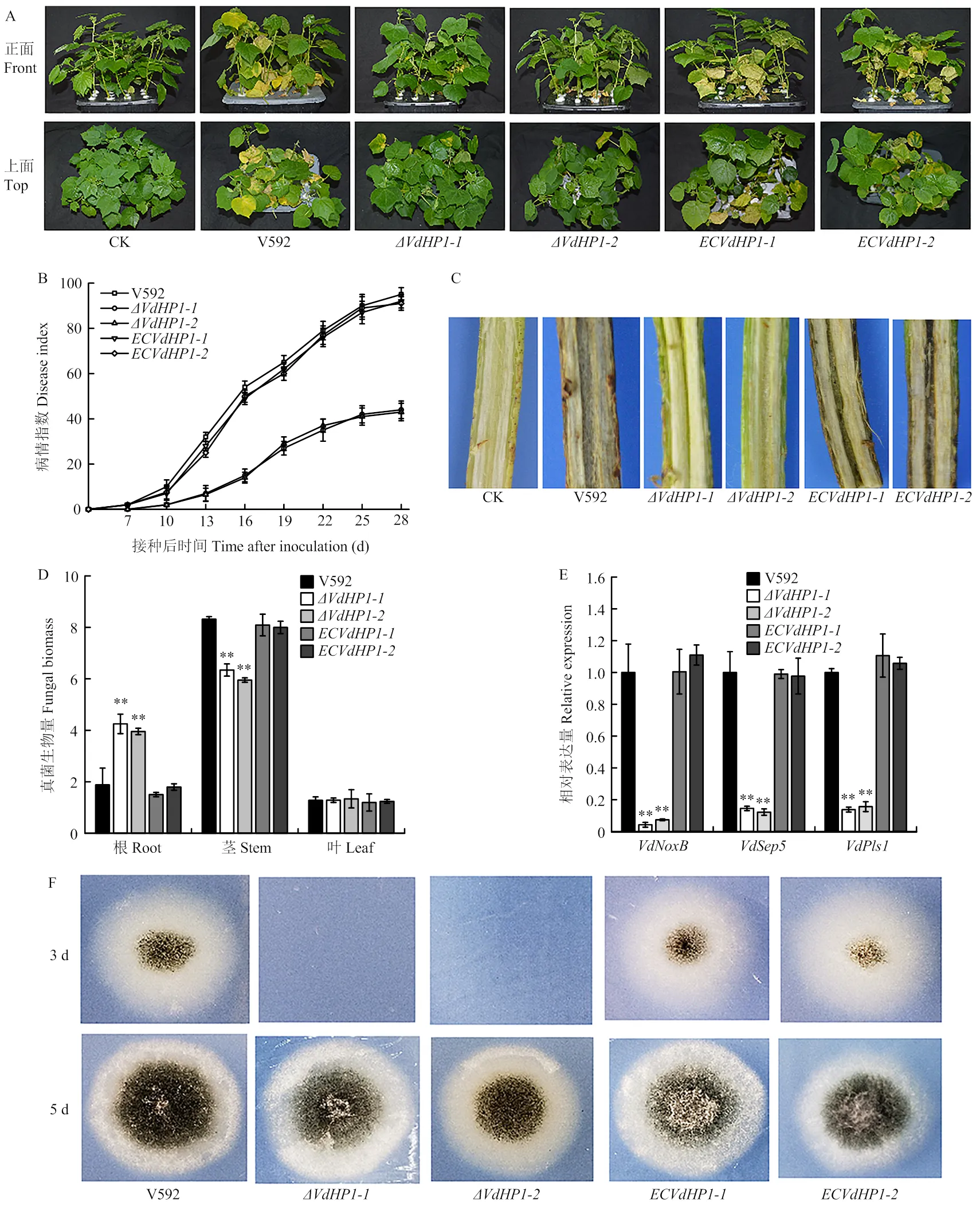
A:感病棉花的癥狀,照片拍攝于接種后20 d The symptoms of diseased cotton plants, the photograph were taken at 20?days post inoculation;B:棉花發病后的病情指數Disease index of cotton plants;C:感病棉花維管束變褐現象Vascular discoloration of diseased cotton plants;D:棉花根、莖、葉中的真菌生物量Relative quantification of fungal biomass in roots, stems and leaves of cotton plants;E:與侵染釘形成和分泌蛋白釋放相關基因在VdHP1基因敲除突變體中的相對表達量The transcriptional expression of genes involved in penetration peg formation and delivery of secretory protein in VdHP1 gene knockout mutants;F:玻璃紙穿透試驗Cellophane penetration test of VdHP1 gene knockout mutants
2.8 致病相關基因在VdHP1基因敲除突變體中的表達
為了明確表達對其他致病相關基因的影響,首先構建了基因過表達載體,獲得過表達菌株(和),RT-qPCR測定結果顯示,在過表達菌株中的表達量顯著高于野生型菌株V592中的表達量(圖7-A)。與野生型菌株V592相比,與黑色素合成相關的基因、、和在基因敲除體中的相對表達量均顯著上調,在過表達菌株中除外均顯著下調(圖7-B);與之相反,與侵染釘形成有關的基因、、和分泌蛋白釋放有關的基因在基因敲除體中的相對表達量均顯著下調,在過表達菌株中和表達量顯著上調(圖7-C);同樣,與分生孢子產生有關的基因、、、、、和在基因敲除突變體中的相對表達量顯著下調,、、、、表達量在過表達菌株中顯著上調,和的表達則不受表達量影響(圖7-D)。上述結果表明,對與侵染釘形成、分泌蛋白釋放及分生孢子產生有關基因的表達具有正調控作用,對黑色素合成有關基因的表達具有負調控作用。
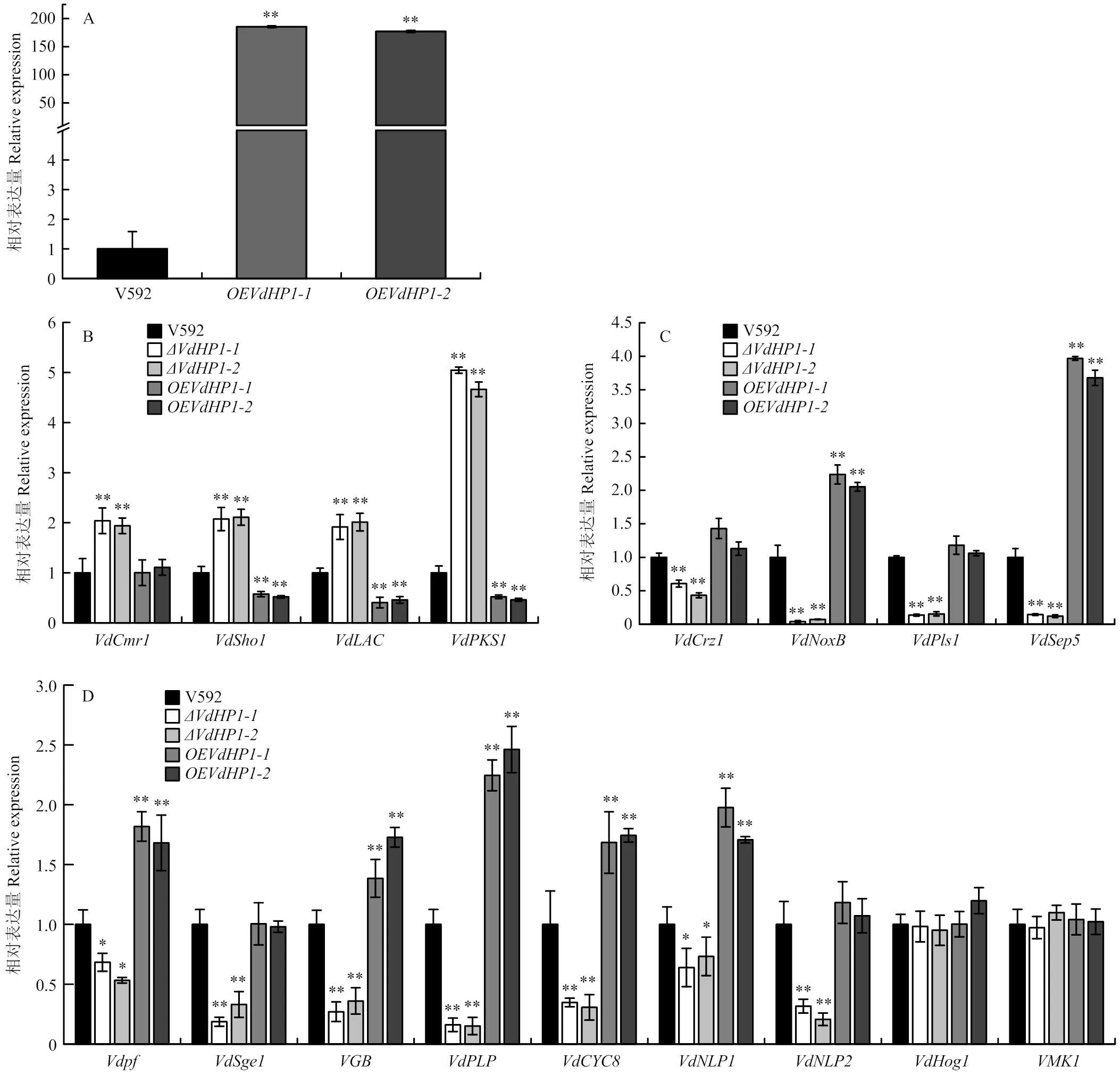
A:VdHP1過表達菌株中的轉錄水平驗證Transcriptional expression of VdHP1 in V592 strain and overexpressed strains;B:大麗輪枝菌中黑色素合成相關基因的轉錄表達Transcriptional expression of genes involved in melanin synthesis;C:大麗輪枝菌中與穿透及分泌蛋白釋放相關基因的轉錄表達Transcriptional expression of genes involved in penetration peg and delivery of secretory protein;D:大麗輪枝菌中產孢相關基因的轉錄表達Transcriptional expression of genes involved in conidial production
3 討論
本研究從大麗輪枝菌中克隆到的與GenBank中已有功能注釋的基因沒有任何序列相似性,并且只與輪枝菌屬中的同源基因具有很高的序列相似性,表明該基因是輪枝菌屬特有的基因。Klosterman等通過亞細胞定位和信號肽預測輪枝菌屬中大麗輪枝菌(VdLs.17菌株)和黑白輪枝菌()(VaMs.102菌株)分別編碼780個和759個分泌蛋白,其中574個基因在2個種間保守[26]。由于許多真菌典型的效應子蛋白是氨基酸數目<400,半胱氨酸數>4的小蛋白[27-29],據此輪枝菌屬中246個未被注釋的基因編碼的蛋白為這類典型的效應子蛋白[26]。而本研究克隆到的,通過亞細胞定位和信號肽預測編碼的蛋白也是分泌蛋白,包含268個氨基酸,但是其半胱氨酸只有2個,因此VdHP1蛋白可能是輪枝菌屬中一種非典型效應子蛋白。
在分生孢子中的表達量是微菌核中的28倍、菌絲的14倍,當從大麗輪枝菌中敲除,因其不能在分生孢子和菌絲中表達,導致敲除突變體產孢梗和產孢量明顯減少,菌絲形態也發生改變,表明參與大麗輪枝菌的產孢過程。已有研究表明,大麗輪枝菌的產孢過程是多基因參與的過程,如[11]、[12]、[19]、[20]、[30]、[16]、[31]、[32]、[6]和[6]等基因敲除均導致大麗輪枝菌產孢量下降。本研究發現,正調控其中一些與產孢相關基因、、、、、、的表達,其中,[11]、[12]和[32]是參與調控產孢過程的轉錄因子,是G蛋白信號途徑的關鍵基因[20]。基因敲除導致產孢量下降可能與這些產孢相關基因表達量下降有關,同時也表明可能通過與其他基因或信號途徑互作參與分生孢子的形成過程。
敲除突變體在棉花根、莖中的生物量測定結果表明,基因敲除導致大麗輪枝菌在棉花莖中的擴展受阻;與之一致的結果是,基因敲除體穿透玻璃紙的能力下降,并且與附著枝侵染釘形成相關的基因、、在基因敲除體中的表達量顯著下調[8],表明基因敲除導致附著枝形成侵染釘的能力下降,從而導致大麗輪枝菌穿透寄主細胞壁和在寄主體內的擴展能力下降。大麗輪枝菌發揮致病作用的途徑之一就是通過分泌各類效應子蛋白與寄主互作,干擾或阻止植物免疫。是大麗輪枝菌侵染釘與寄主界面形成菌絲頸環結構所必需的基因,其作用是釋放分泌蛋白[9];在基因敲除體中的表達量顯著下調,表明基因敲除突變體致病力下降可能與其分泌效應子能力下降有關。此外,[11]、[12]、[20]、[30]、[32]、[6]、[6]不僅是產孢相關基因,也是致病相關基因,它們在基因敲除突變體中的表達量顯著下調也可能是導致致病力下降的因素之一。
雖然有些致病相關基因的功能鑒定表明,其產孢過程與其微菌核形成過程相互偶聯,如[11]、[20]和[32]均與分生孢子產生和微菌核的形成有關。本研究結果顯示,不參與大麗輪枝菌微菌核形成,表明參與的產孢和致病過程不與微菌核形成途徑偶聯。已有研究表明,黑色素含量與大麗輪枝菌的致病力密切相關,[13]、[15]、[25]、[33]基因敲除均導致大麗輪枝菌致病力顯著下降,其中,和是真菌DHN黑色素合成途徑起始和結束的2個關鍵基因[13];VdCmr1蛋白是調控黑色素合成途徑的轉錄因子[13];編碼的跨膜蛋白通過MAPK級聯信號途徑調控大麗輪枝菌黑色素的合成和穿透寄主的能力[15]。本研究發現,對黑色素合成相關基因、、、的表達具有負調控作用,但是與這4個基因所涉及的調控網絡是如何相互作用的還有待深入研究。
4 結論
從大麗輪枝菌中克隆到的是輪枝菌屬特有的新基因。基因敲除導致大麗輪枝菌產孢量和產孢梗減少、菌絲形態發生改變、對寄主的致病力下降,表明與大麗輪枝菌分生孢子和產孢梗的產生有關,參與大麗輪枝菌致病。其他致病相關基因在敲除突變體中的轉錄分析結果表明,對與侵染釘形成、分泌蛋白釋放及分生孢子產生相關基因的表達具有正調控作用,對黑色素合成相關基因的表達具有負調控作用。
[1] 朱荷琴, 李志芳, 馮自力, 馮鴻杰, 魏鋒, 趙麗紅, 師勇強, 劉世超, 周京龍. 我國棉花黃萎病研究十年回顧及展望. 棉花學報, 2017, 29(增刊): 37-50.
ZHU H Q, LI Z F, FENG Z L, FENG H J, WEI F, ZHAO L H, SHI Y Q, LIU S C, ZHOU J L. Overview of cotton verticillium wilt research over the past decade in china and its prospect in future., 2017, 29(Suppl.): 37-50. (in Chinese)
[2] KAWCHUK L M, HACHEY J, LYNCH D R, KULCSAR F,van Rooijen G, Waterer D R, Robertson A, Kokko E, Byers R, Howard R G, FISHER R, PRUFER D. Tomatodisease resistance genes encode cell surface-like receptors., 2001, 98(11): 6511-6515.
[3] GAO F, ZHANG B S, ZHAO J H, HUANG J F, JIA P S, WANG S, ZHANG J, ZHOU J M, GUO H S. Deacetylation of chitin oligomers increases virulence in soil-borne fungal pathogens., 2019, 5(11): 1167-1176.
[4] QIN J, WANG K, SUN L, XING H, WANG S, LI L, CHEN S, GUO H S, ZHANG J. The plant-specific transcription factors CBP60g and SARD1 are targeted by asecretory protein VdSCP41 to modulate immunity., 2018, 7: DOI: 10.7554/eLife.34902.
[5] ZHOU B J, JIA P S, GAO F, GUO H S. Molecular characterization and functional analysis of a necrosis- and ethylene-inducing, protein-encoding gene family from., 2012, 25(7): 964-975.
[6] SANTHANAM P, VAN ESSE H P, ALBERT I, FAINO L, NURNBERGER T, THOMMA B P. Evidence for functional diversification within a fungal NEP1-like protein family., 2013, 26(3): 278-286.
[7] GUI Y J, ZHANG W Q, ZHANG D D, ZHOU L, SHORT D P G, WANG J, MA X F, LI T G, KONG Z Q, WANG B L, WANG D, LI N Y, SUBBARAO K V, CHEN J Y, DAI X F. Aextracellular cutinase modulates plant immune responses., 2018, 31(2): 260-273.
[8] ZHAO Y L, ZHOU T T, GUO H S. Hyphopodium-specific VdNoxB/VdPls1-dependent ROS-Ca2+signaling is required for plant infection by., 2016, 12(7): e1005793.
[9] ZHOU T T, ZHAO Y L, GUO H S. Secretory proteins are delivered to the septin-organized penetration interface during root infection by., 2017, 13(3): e1006275.
[10] BUI T T, HARTING R, BRAUS-STROMEYER S A, TRAN V T, LEONARD M, HOFER A, ABELMANN A, BAKTI F, VALERIUS O, SCHLUTER R, STANLEY C E, AMBROSIO A, BRAUS G H.transcription factors Som1 and Vta3 control microsclerotia formation and sequential steps of plant root penetration and colonisation to induce disease., 2019, 221(4): 2138-2159.
[11] LUO X, MAO H, WEI Y, CAI J, XIE C, SUI A, YANG X, DONG J. The fungal-specific transcription factorinfluences conidia production, melanized microsclerotia formation and pathogenicity in., 2016, 17(9): 1364-1381.
[12] SANTHANAM P, THOMMA B P H J.Sge1 differentially regulates expression of candidate effector genes., 2013, 26(2): 249-256.
[13] WANG Y, HU X, FANG Y, ANCHIETA A, GOLDMAN P H, HERNANDEZ G, KLOSTERMAN S J. Transcription factor VdCmr1 is required for pigment production, protection from UV irradiation, and regulates expression of melanin biosynthetic genes in., 2018, 164(4): 685-696.
[14] WANG Y, DENG C, TIAN L, XIONG D, TIAN C, KLOSTERMAN S J. The transcription factor VdHapX controls iron homeostasis and is crucial for virulence in the vascular pathogen., 2018, 3(5): e00400-18.
[15] LI J J, ZHOU L, YIN C M, ZHANG D D, KLOSTERMAN S J, WANG B L, SONG J, WANG D, HU X P, SUBBARAO K V, CHEN J Y, DAI X F. TheSho1-MAPK pathway regulates melanin biosynthesis and is required for cotton infection., 2019, 21(12): 4852-4874.
[16] RAUYAREE P, OSPINA-GIRALDO M D, KANG S, BHAT R G, SUBBARAO K V, GRANT S J, DOBINSON K F. Mutations in, a mitogen-activated protein kinase gene, affect microsclerotia formation and pathogenicity in., 2005, 48(2): 109-116.
[17] TIAN L, XU J, ZHOU L, GUO W. VdMsb regulates virulence and microsclerotia production in the fungal plant pathogen., 2014, 550(2): 238-244.
[18] TIAN L, YU J, WANG Y, TIAN C. The C2H2transcription factor VdMsn2 controls hyphal growth, microsclerotia formation, and virulence of., 2017, 121(12): 1001-1010.
[19] TZIMA A, PAPLOMATAS E J, RAUYAREE P, KANG S. Roles of the catalytic subunit of cAMP-dependent protein kinase A in virulence and development of the soilborne plant pathogen., 2010, 47(5): 406-415.
[20] TZIMA A K, PAPLOMATAS E J, TSITSIGIANNIS D I, KANG S. The G proteinsubunit controls virulence and multiple growth- and development-related traits in., 2012, 49(4): 271-283.
[21] 宋雯, 王春巧, 俞燕, 高峰, 黃家風. 棉花黃萎病菌鳥氨酸脫羧酶抗酶蛋白基因的功能分析. 棉花學報, 2019, 31(2): 101-113.
SONG W, WANG C Q, YU Y, GAO F, HUANG J F. Functional analysis of an ornithine decarboxylase antizyme geneinisolated from cotton., 2019, 31(2): 101-113. (in Chinese)
[22] 王春巧, 陳志榮, 宋雯, 何芳, 黃家風. 一個編碼富含絲氨酸蛋白的基因影響大麗輪枝菌的微菌核形成、產孢及致病力. 植物病理學報, 2019, 49(5): 650-659.
WANG C Q, CHEN Z R, SONG W, HE F, HUANG J F. A serine-rich protein identified inaffects microsclerotial formation, conidiation and pathogenicity., 2019, 49(5): 650-659. (in Chinese)
[23] WANG S, XING H, HUA C, GUO H S, ZHANG J. An improved single-step cloning strategy simplifies the-mediated transformation (ATMT)-based gene-disruption method for., 2016, 106(6): 645-652.
[24] GAO F, ZHOU B J, LI G Y, JIA P S, LI H, ZHAO Y L, ZHAO P, XIA G X, GUO H S. A glutamic acid-rich protein identified infrom an insertional mutagenesis affects microsclerotial formation and pathogenicity., 2010, 5(12): e15319.
[25] ZHANG T, ZHANG B, HUA C, MENG P, WANG S, CHEN Z, DU Y, GAO F, HUANG J.is required for melanin formation and virulence in a cotton wilt pathogen., 2017, 60(8): 868-879.
[26] KLOSTERMAN S J, SUBBARAO K V, KANG S, VERONESE P, GOLD S E, THOMMA B P, CHEN Z, HENRISSAT B, LEE Y H, PARK J,. Comparative genomics yields insights into niche adaptation of plant vascular wilt pathogens., 2011, 7(7): e1002137.
[27] BOLTON M D, VAN ESSE H P, VOSSEN J H, DE JONGE R, STERGIOPOULOS I, STULEMEIJER I J, VAN DEN BERG G C, BORRAS-HIDALGO O, DEKKER H L, DE KOSTER C G, DE WIT P J, JOOSTEN M H, THOMMA B P. The novellysin motif effector Ecp6 is a virulence factor with orthologues in other fungal species., 2008, 69(1): 119-136.
[28] VAN ESSE H P, VAN’T KLOOSTER J W, BOLTON M D, YADETA K A, VAN BAARLEN P, BOEREN S, VERVOORT J, DE WIT P J, THOMMA B P. Thevirulence protein Avr2 inhibits host proteases required for basal defense., 2008, 20(7): 1948-1963.
[29] VAN ESSE H P, BOLTON M D, STERGIOPOULOS I, DE WIT P J, THOMMA B P. The chitin-bindingeffector protein Avr4 is a virulence factor., 2007, 20(9): 1092-1101.
[30] QI X, LI X, GUO H, GUO N, CHENG H. VdPLP, a patatin-like phospholipase in, is involved in cell wall integrity and required for pathogenicity., 2018, 9(3): 162.
[31] WANG Y, TIAN L, XIONG D, KLOSTERMAN S J, XIAO S, TIAN C. The mitogen-activated protein kinase gene,, regulates osmotic stress response, microsclerotia formation and virulence in., 2016, 88: 13-23.
[32] LI Z F, LIU Y J, FENG Z L, FENG H J, KLOSTERMAN S J, ZHOU F F, ZHAO L H, SHI Y Q, ZHU H Q., encoding CYC8 glucose repression mediator protein, is required for microsclerotia formation and full virulence in., 2015, 10(12): e0144020.
[33] 曹亞松, 王春生, 李海源, 徐小鴻, 商文靜, 楊家榮, 胡小平. 大麗輪枝菌基因克隆與功能分析. 西北農業學報, 2018, 27(2): 275-282.
CAO Y S, WANG C S, LI H Y, XU X H, SHANG W J, YANG J R, HU X P. Cloning and functional analysis ofin., 2018, 27(2): 275-282. (in Chinese)
Cloning and Functional Analysis offrom cotton
SUN Qi, HE Fang, SHAO ShengNan, LIU Zheng, HUANG JiaFeng
(College of Agriculture/Key Laboratory of Oasis Agricultural Pest Management and Plant Protection Resources Utilization, Xinjiang Uygur Autonomous Region, Shihezi University, Shihezi 832003, Xinjiang)
【】The objective of this study is to determine the function of a novel gene () incausing cotton verticillium wilt, and to provide a basis for analyzing the pathogenic mechanism ofand the prevention and treatment of cottonverticillium wilt.【】The full length ofwas cloned and sequenced fromwild-type strain V592 genomic DNA and cDNA. The relative expression ofmeasured by reverse transcription quantitative real-time PCR (RT-qPCR).gene knockout vector, complementary vector and overexpressed vector were constructed to producegene knockout strains, complementary strains and overexpressed strains by-mediated transformation, respectively. Taking wild-type strain V592 as the control, colony growth on PDA and hypha morphology were observed, microsclerotia production, conidial production and pathogenicity to cotton ofgene knockout mutants and complementary strains were measured. The relative expression of other genes involved in pathogenicity inknockout mutants and overexpressed strains was measured by RT-qPCR.【】The full length ofwas determined to be 862 bp and deduced protein contained 268 amino acids, which shared no significant sequence similarity to any known annotated gene in GenBank. The transcriptional expression ofwas significantly up-regulated when V592 strain induced by cotton roots for 6-12 h, indicating thatplays a role at the early stage of the infection. The transcriptional expression ofis differentially expressed in different tissues ofCompared with wild-type strain V592,gene knockout mutants showed significantly decreased conidia and conidiophores, branching hyphae were spirally shaped, and the pathogenicity to cotton was significantly decreased.The relative expression of genes involved in penetration peg formation (,,), delivery of secretory protein () and conidial production (,,,,,,) was significantly down-regulated inknockout mutants, but was up-regulated in the overexpressed strains; whereas, the relative expression of genes involved in melanin synthesis (,,,) was significantly up-regulated inknockout mutants, and was down-regulated in the overexpressed strains. 【】is participated in the production of conidia and conidiophores, and is involved in pathogenicity in.positively regulates the transcriptional expression of genes involved in penetration peg formation, delivery of secretory protein and conidial production, and negatively regulates the transcriptional expression of genes involved in melanin synthesis.
cottonverticillium wilt;;; conidiation; pathogenicity; transcriptional expression

10.3864/j.issn.0578-1752.2020.14.011
2020-01-10;
2020-02-21
國家自然科學基金(31760497,31560494)
孫琦,E-mail:784594752@qq.com。通信作者劉政,E-mail:lzh8200@126.com。通信作者黃家風,E-mail:jiafeng_huang@163.com
(責任編輯 岳梅)

