一氧化氮合成酶抑制劑對宰后成熟過程中牦牛肉品質的影響
李雪茹,師希雄,王建忠,張攀高,田鑄,韓玲
一氧化氮合成酶抑制劑對宰后成熟過程中牦牛肉品質的影響
李雪茹,師希雄,王建忠,張攀高,田鑄,韓玲
(甘肅農業大學食品科學與工程學院,蘭州 730070)
【目的】研究一氧化氮對宰后牦牛肉品質的影響,為牦牛肉品質改善提供理論依據。【方法】以3—5歲去勢甘南牦牛肉為材料,取其背最長肌,剔除筋膜、脂肪等,切成大小均勻的薄片(8 cm×8 cm),用20 G針均勻穿刺,分別采用去離子水(對照組)和1、10、100 mmol·L-1一氧化氮合成酶(NOS)抑制劑(N-硝基-L-精氨酸甲酯鹽酸鹽)在4℃條件下1﹕1(V/m)浸泡肉樣1 d,然后在4℃條件下成熟,測定成熟期間(0、1、3、5和7 d)NOS活性與一氧化氮含量、肌原纖維小片化指數(MFI)、總巰基含量、羰基含量、pH、色度等指標。【結果】NOS抑制劑處理后的牦牛背最長肌NOS活性和一氧化氮含量顯著降低,成熟第7天時,處理組的NOS活性分別比對照組低30.9%、43.6%、74.7%,一氧化氮含量分別比對照組低4.7%、12.5%、21.5%。處理后的牦牛肉pH顯著降低,第7天時,處理組分別比對照組低0.8%、5.7%、15.2%,其中10和100 mmol·L-1NOS抑制劑處理組顯著低于對照組。處理顯著降低了牦牛肉羰基含量,成熟第7天時,處理組分別比對照組低4.1%、19.0%、22.2%。此外,處理組MFI顯著上升,成熟第7天時,處理組分別比對照組低31.1%、23.3%、9.6%。處理組牦牛肉總巰基含量顯著上升,第7天時,對照組比NOS抑制劑處理組分別低3.2%、3.7%、2.7%。成熟過程中,NOS抑制劑處理使肉色*值顯著降低,肉色*值顯著升高,第7天時,處理組的肉色*值分別比對照組低7.1%、40.2%、30.7%,肉色*值分別比對照組高1.1%、2.0%、1.1%。【結論】一氧化氮促進宰后牦牛肉蛋白質氧化,抑制牦牛肉嫩化,使肉色*值降低,*值升高,對宰后牦牛肉的品質產生負面影響,而NOS抑制劑能降低肌肉中NOS活性。
牦牛肉;宰后成熟;一氧化氮;一氧化氮抑制劑;肉品質
0 引言
【研究意義】牦牛原產亞洲中部山地,主要分布于青海、西藏、四川、甘肅等海拔3 000 m以上的高寒地區[1]。甘肅省有著豐富的草地資源,擁有牦牛100多萬頭,其中,甘南州約有牦牛80萬頭,占甘肅省牦牛總數的80%,占世界牦牛總數的5%[2]。甘南牦牛肉具有營養豐富,肉質鮮美、低脂、高蛋白、礦物質含量豐富的特點,是消費者青睞的天然綠色食品,具有良好的加工特性,是一種優質的肉類資源[3],但是其肌纖維較粗,嫩度較低,口感較差[4]。因此,改善肉品質是牦牛產業亟待解決的問題。【前人研究進展】宰后成熟是改善肉品質的重要方法,然而,肉的宰后成熟機理尚未明確,宰后成熟過程中活性氮類物質會大量聚集于肌肉細胞中,包括由一氧化氮合成酶催化精氨酸向瓜氨酸代謝產生的一氧化氮(NO),NO在調節肌肉收縮、能量代謝和蛋白降解中發揮著重要作用[5-6]。目前認為鈣蛋白酶系統是宰后成熟過程中蛋白質降解起關鍵作用的酶系統[7]。由于鈣蛋白酶是半胱氨酸酶,其大亞基活性位點易受到NO攻擊而失活,從而影響肉品質[8]。細胞內的一氧化氮合成酶(NOS)濃度和活性因肌肉類型[9]和動物種類[10]而異,宰前注射NOS抑制劑能夠顯著提高羊背最長肌的嫩度,但其滴水損失和肉色不受影響[11]。ZHANG等[12]發現宰后雞肉NOS抑制劑組比對照組和NO增強劑組顯示出更高的*值和更低的*值。李玉品[13]發現NO促進劑可使豬背最長肌的羰基含量上升,游離巰基含量下降,說明NO促進劑加快了蛋白質的氧化。內源性NO參與減少蛋白質的降解和增加蛋白質的合成并誘導骨骼肌纖維肥大,對肉嫩化有抑制作用[14]。COTTRELL等[15]用NOS抑制劑和NO增強劑對宰后牛背最長肌處理,發現NO增強劑組肌原纖維小片化指數(MFI)顯著低于對照組和NOS抑制劑組。另外,研究發現向肌細胞培養基中添加L-NAME因子能夠增強蛋白水解作用[16]。同時,也有報道表明,NO釋放劑可顯著提高牛肉的嫩度,NOS抑制劑降低牛肉嫩度[17]。【本研究切入點】目前,已有關于NO對宰后雞肉、牛羊肉品質影響的報道,但是,研究結論不一致,而且,NO如何影響宰后牦牛肉品質還有待研究。【擬解決的關鍵問題】試驗以甘南牦牛背最長肌為試驗材料,NOS抑制劑處理后,測定牦牛肉宰后成熟期間NOS活性與NO含量,并分析MFI、巰基含量、羰基含量以及pH、色度等指標的變化,研究NOS抑制劑對宰后牦牛肉品質的影響,為宰后牦牛肉品質改善提供理論依據。
1 材料與方法
試驗于2018年10月至2019年4月在甘肅農業大學食品營養研究實驗室進行。
1.1 材料
1.1.1 試驗材料 本研究試驗材料于2018年10月采自甘肅安多清真綠色食品有限公司,生理成熟度相似的3—5歲去勢甘南牦牛,參考國內外對動物福利的相關要求,屠宰方式嚴格按照GB/T 19477—2018《畜禽屠宰操作規程牛》進行操作,宰前保證牦牛的健康狀況良好,宰后熱應激波動幅度較小,跟腱吊掛,從胴體上取下整條背最長肌作為試驗材料。
1.1.2 試劑與儀器 L-NAME(美國Sigma公司)、鹽酸胍(天津市科密歐化學試劑有限公司)、DNPH(天津市光復精細化工研究所)、DTNB(北京拜爾迪生物公司)、NOS檢測試劑盒(南京建成生物工程研究所)、NO檢測試劑盒(南京建成生物工程研究所)等。
XHF-D高速分散器(寧波新芝生物科技股份有限公司)、TGL-16M高速臺式冷凍離心機(長沙湘怡離心機儀器有限公司)、T6新世紀紫外可見分光光度計(北京普析通用儀器有限責任公司)、XMTD-8222電熱恒溫鼓風干燥箱(上海精宏實驗設備有限公司)、PHB-4型便攜式酸度計(南京科環分析儀器有限公司)、KQ-500E型超聲清洗器(昆山市超聲儀器有限公司)、HHS型電熱恒溫水浴鍋(上海博迅實業有限公司醫療設備廠)。
1.2 試驗方法
1.2.1 樣品處理 甘南牦牛背最長肌,剔去筋膜、脂肪等,切成大小均勻的薄片(8 cm×8 cm),均勻地用20 G針穿刺,分別用去離子水和1、10和100 mmol?L-1的NOS抑制劑溶液與肉樣進行1﹕1(v/m)浸泡,在4℃下浸泡1 d后,用濾紙輕輕按壓吸干肉塊表面水分后于4℃成熟,在不同成熟時間點(0、1、3、5和7 d)分別取樣,現場測定其pH和色度變化,其余樣品置于-80℃條件下儲存,用于測定NO含量、NOS活性、MFI、巰基含量、羰基含量。
1.2.2 NOS活性及一氧化氮含量測定 按照NOS及NO試劑盒使用說明進行測定。
1.2.3 pH測定 用便攜式pH計對對照組和不同濃度NOS抑制劑溶液處理的牦牛肉進行測定。將探頭插入到肉樣中,使pH計電極與肉樣組織充分接觸,待pH計讀數穩定后記錄。每份肉樣平行測定3次,取平均值作為該肉樣的pH[18]。
1.2.4 色度測定 采用CR-10色差儀進行測定。用蒸餾水沖洗肉樣上的血漬并用干凈濾紙吸干表面殘留水分進行*值、*值、*值測定,每塊肉樣選取3處測定,取平均值[19]。
1.2.5 肌原纖維小片化指數的測定 取2 g肉樣,加入20 mL的MFI緩沖液(100 mmol?L-1的KCl、20 mmol?L-1Na3PO4、1 mmol?L-1EDTA、1 mmol?L-1MgCl2、1 mmol?L-1NaN3,pH 7.1),將肉樣冰浴勻漿。得到肌原纖維蛋白懸濁液,1 000×離心15 min,棄去上清液,再次加入20 mL緩沖液使沉淀重新處于懸濁態,1 000×離心15 min,棄去上清液。再用10 mL緩沖液使沉淀重新處于懸濁態,將懸濁液通過200目尼龍篩網過濾,取10 mL緩沖液幫助過濾,用雙縮脲法測定所得懸濁液中蛋白含量。用緩沖液調節懸浮液中蛋白濃度為0.5 mg?mL-1,再用分光光度計測定(540 nm處)吸光值,將所得結果(吸光值)乘以200即為MFI[20]。
1.2.6 羰基含量測定 參考李銀等[21]和Oliver等[22]的方法,略作修改。
稱取1 g肉樣,加10倍體積(v/w)標準鹽溶液(20 mmol?L-1磷酸鉀緩沖液、0.1 mol?L-1KCl、2 mmol?L-1MgCl2、2 mmol?L-1EGTA,pH 6.8),13 000 r/min勻漿10 s,4℃離心10 min(1 000×),棄上清,沉淀用8倍體積(v/w)標準鹽溶液溶解后,4℃離心10 min(1 000×)棄上清,重復兩次。沉淀用8倍體積(v/w)含1% Triton X-100的標準鹽溶液(20 mmol?L-1磷酸鉀緩沖液、0.1 mol?L-1KCl、2 mmol?L-1MgCl2、2 mmol?L-1EGTA、1% Triton X-100,pH 6.8)溶解,4℃離心10 min(1 000×)棄上清,重復兩次。沉淀用8倍體積(v/w)100 mmol?L-KCl溶液溶解,4℃離心10 min(1 000×)棄上清,重復兩次。沉淀中加4 mL 100 mmol?L-1KCl溶液溶解,用雙縮脲法測定蛋白含量,用牛血清白蛋白做標準曲線。
(2)羰基含量測定
①用100 mmol?L-1KCl溶液將肌原纖維蛋白濃度調整為5 mg?mL-1,分別取0.5 mL肌原纖維蛋白溶液分裝至2個10 mL塑料離心管,其中一份加2 mL 2 mol?L-1HCl溶液(對照),另一份加2 mL含0.2%DNPH的2 mol?L-1HCl溶液,室溫下避光反應1 h(每10 min旋渦振蕩一次)。
②分別添加2 mL 20%三氯乙酸沉淀蛋白,10 000 r/min離心5 min,棄上清液。
③沉淀用2 mL乙酸乙酯﹕乙醇(1﹕1)清洗,重復3次。
④待沉淀中試劑揮發完后,分別加3 mL 6 mol?L-1鹽酸胍(含20 mmol?L-1磷酸鉀,pH 6.5)溶液后置于37℃條件下水浴保溫30 min溶解沉淀,再將反應液10 000 r/min離心5 min除去不溶物質,在370 nm處測定上清液吸光度,比色皿厚度1 cm。使用分子吸光系數22 000 M-1·cm-1計算羰基含量。
1.2.7 巰基含量的測定 按照LIU等[23]的方法進行測定。
1.3 數據處理
所有試驗均重復3次,所有數據均采用Microsoft Office Excel 2013進行處理,計算平均值和標準誤(±SE)并作圖,并用SPSS 22.0進行Duncan’s多重差異顯著性分析(<0.05)。
2 結果
2.1 宰后牦牛肉NOS及NO含量變化
2.1.1 NOS含量變化 由圖1可以看出,宰后牦牛肉成熟過程中,對照組與處理組的NOS活性均逐漸下降,但處理組的NOS活性顯著低于對照組,第7天時,各NOS抑制劑處理組分別比對照組低30.9%、43.6%、74.7%(<0.05)。可見,采用NOS抑制劑對宰后牦牛肉進行處理后,降低了NOS活性。
2.1.2 NO含量變化 宰后牦牛肉成熟過程中,對照組和處理組的一氧化氮含量均逐漸下降,且處理組的一氧化氮含量均顯著低于對照組。宰后當天,各處理組分別比對照組低19.8%、41.35%、44.2%(<0.05),第7天時,各處理組分別比對照組低4.7%、12.5%、21.5%(<0.05)。可見,NOS抑制劑降低了宰后牦牛肉的NO含量(圖2)。
2.2 NOS抑制劑處理對宰后牦牛肉pH的影響
由圖3可見,宰后牦牛肉成熟過程中,對照組與處理組的pH基本呈現先下降后上升趨勢,且處理組的pH低于對照組。第3天時,各處理組pH分別比對照組低4.2%、9.1%、10.9%(<0.05);第7天時,各處理組分別比對照組低0.8%、5.7%、15.2%,其中,1 mmol?L-1NOS抑制劑處理組與對照組相比無顯著差異,10及100 mmol?L-1NOS抑制劑處理組與對照組相比差異顯著(<0.05)。可見,NOS抑制劑能顯著降低宰后牦牛肉的pH。
2.3 NOS抑制劑處理對宰后牦牛肉色度的影響
由表1可知,宰后牦牛肉成熟過程中,NOS抑制劑處理組和對照組牦牛肉的*值均先上升后下降。第1天時,各處理組均顯著高于對照組,分別比對照組高3.9%、6.4%、8.3%(<0.05);第7天時,分別比對照組高1.1%、2.0%、1.1%(<0.05)。處理組和對照組牦牛肉的*值均逐漸下降,且各處理組顯著低于對照組(<0.05),第7天時,分別比對照組低7.1%、40.2%、30.7%。處理組和對照組牦牛肉的*值呈顯著上升趨勢(<0.05),第7天時,各處理組與對照組相比差異不顯著(>0.05)。總之,采用NOS抑制劑對宰后牦牛肉進行處理后,*值顯著升高,*值顯著下降,*值無顯著性變化。
2.4 NOS抑制劑處理對宰后牦牛肉MFI的影響
宰后牦牛肉成熟過程中對照組與NOS抑制劑處理組MFI均呈現顯著上升趨勢,且各NOS抑制劑處理組顯著高于對照組,第7天時,各處理組分別比對照組高31.1%、23.3%、9.6%(<0.05)(圖4)。結果表明,采用NOS抑制劑對宰后牦牛肉進行處理,促進了肌原纖維蛋白的降解。
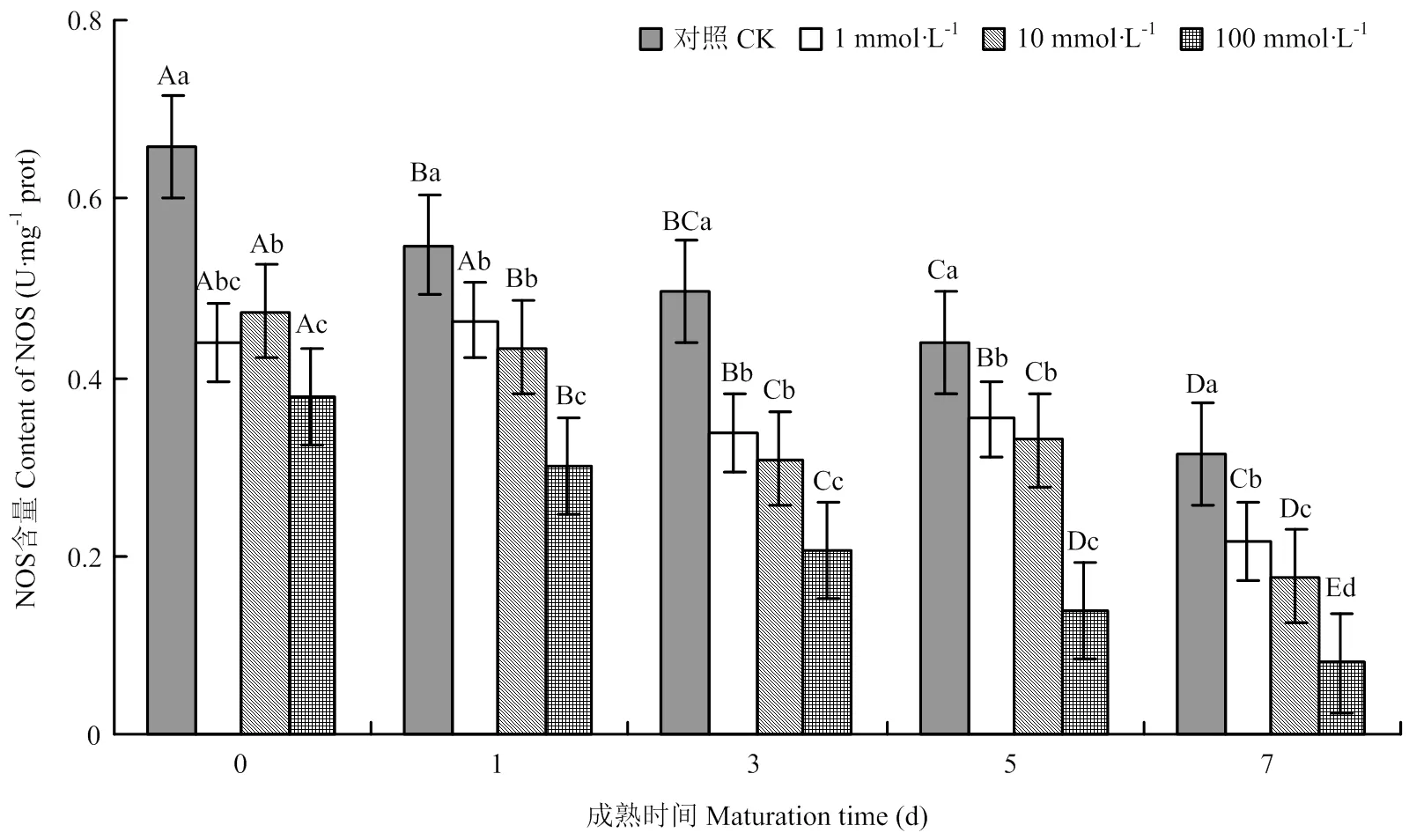
不同大寫字母表示同一處理組在不同成熟時間差異顯著(P<0.05),不同小寫字母表示在同一時間不同處理組之間差異顯著(P<0.05)。下同
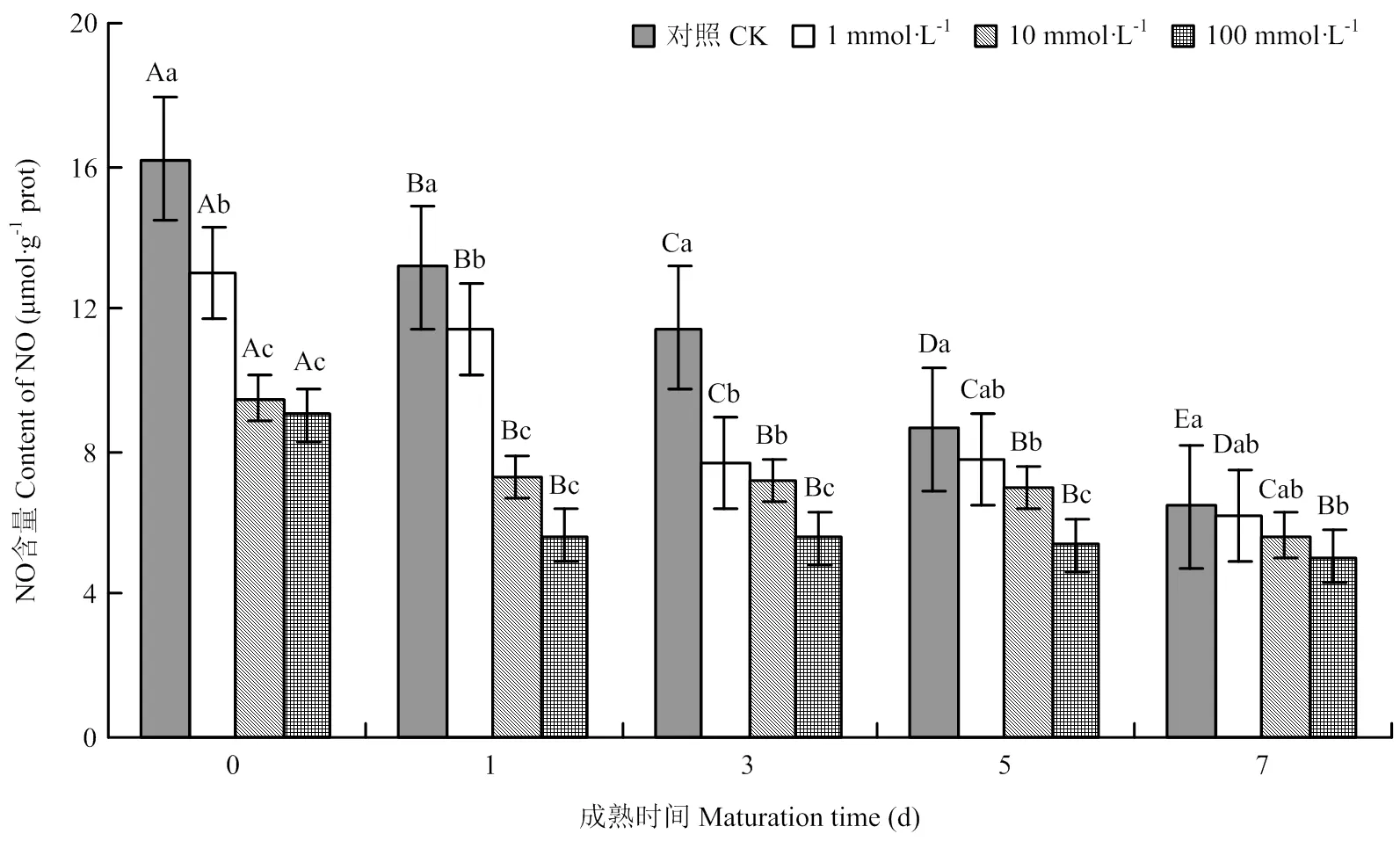
圖2 不同濃度NOS抑制劑處理對牦牛肉中NO含量的影響
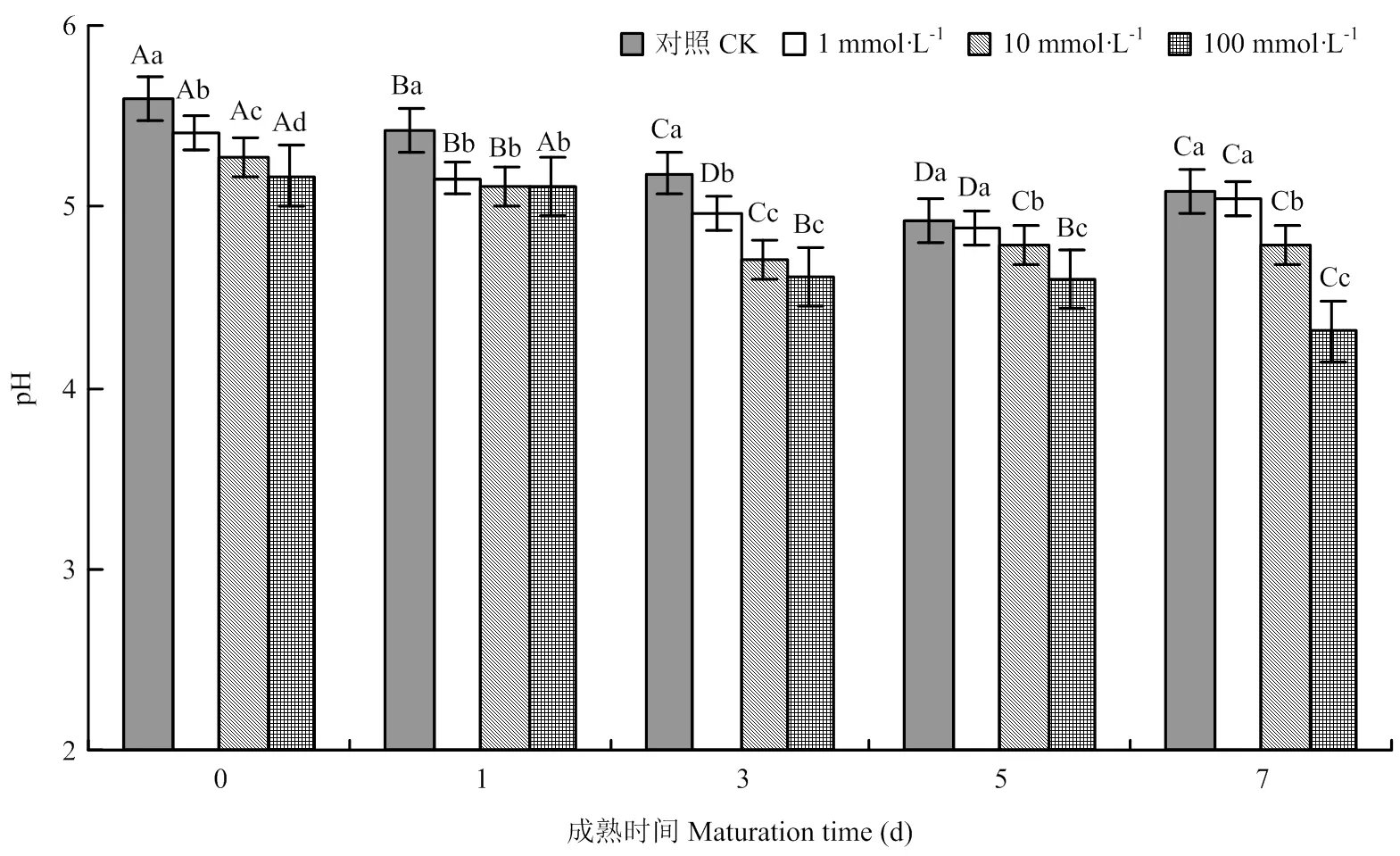
圖3 不同濃度NOS抑制劑處理對牦牛肉pH的影響
2.5 NOS抑制劑處理對宰后牦牛肉羰基含量的影響
由圖5可以看出,宰后牦牛肉成熟過程中,NOS抑制劑處理組與對照組羰基含量均呈顯著性上升趨勢(<0.05),且NOS抑制劑處理組顯著低于對照組(0 d時各組均無顯著性差異),第7天時,各處理組分別比對照組低4.1%、19.0%、22.2%(<0.05)。結果表明,宰后牦牛肉成熟過程中NOS抑制劑可以抑制蛋白質氧化,導致羰基含量下降。
2.6 NOS抑制劑處理對宰后牦牛肉總巰基含量的影響
由圖6可見,宰后牦牛肉成熟過程中,對照組與各NOS抑制劑處理組的總巰基含量呈顯著下降趨勢(<0.05),且對照組顯著低于NOS抑制劑處理組,第7天時,對照組比各NOS抑制劑處理組分別低3.2%、3.7%、2.7%(<0.05)。由此可見NOS抑制劑能抑制NO對細胞內的巰基進行修飾,導致總巰基含量的增加。

表1 不同濃度NOS抑制劑處理對牦牛肉色度的影響
不同大寫字母表示同一處理組在不同成熟時間差異顯著(<0.05),不同小寫字母表示在同一時間不同處理組之間差異顯著(<0.05)。下同
Different uppercase letters indicate significant differences at different maturation times of the same treatment group (<0.05), while different lowercase letters indicate significant differences between different treatment groups at the same time (<0.05). The same as below

圖4 不同濃度NOS抑制劑處理對牦牛肉MFI的影響
3 討論
肌肉細胞中NOS催化精氨酸向瓜氨酸代謝產生一氧化氮,而動物宰后肌細胞在缺血缺氧環境下會激活NOS產生一氧化氮,這可以保護細胞免受不利環境影響[5-6,24]。本試驗采用NOS抑制劑對宰后牦牛肉進行處理,顯著降低了宰后牦牛肉NOS活性和NO的表達量。這與Cottrell等[25]研究發現宰前注射NOS抑制劑,宰后羊羔肉成熟過程中的NO表達量減少相一致。

圖5 不同濃度NOS抑制劑處理對牦牛肉羰基含量的影響

圖6 不同濃度NOS抑制劑處理對牦牛肉總巰基含量的影響
動物宰后肌細胞中形成缺血缺氧環境,肌糖原由原來的有氧分解轉化為無氧酵解,產生大量乳酸,并且ATP分解產生磷酸根等離子,導致pH下降[26],而宰后pH的下降速率和極限pH對肉品質如嫩度、保水性和肉色均有重要的影響[27]。本試驗發現,采用NOS抑制劑處理后牦牛肉的pH顯著降低,這可能是NO在肌肉轉化為肉中起作用,影響肌肉蛋白水解和糖酵解,NOS抑制處理后肌肉乳酸合成增加,pH降低[11]。NO可通過抑制鳥苷酸環化酶影響環磷酸鳥苷的形成和cGMP依賴性蛋白激酶活性參與骨骼肌糖原代謝[28-29]。本研究結果與COTTRELL等[11]報道NOS抑制劑顯著降低羔羊胸肉及腰大肌的極限pH相似。
肉色影響肉及肉制品的商業價值。主要是由肉中的肌紅蛋白和血紅蛋白所決定。本試驗發現NOS抑制劑處理牦牛肉后,*值增大,*值降低。pH在肉類顏色中起著關鍵作用[12],低pH的肉顏色較淺,而pH較高使肉色加深[30]。本研究發現NOS抑制劑對肉色變化有重要影響,該結果與MOLLER等[31]研究結果一致,NO與肌紅蛋白發生反應,在肉制品中產生粉紅色,NOS抑制劑處理組中的*值較低可能與NO含量較少有關。COTTRELL等[11]發現宰前注射NOS抑制劑,肉色不受L-NAME的影響,本試驗與上述結果不同,原因可能是物種的差異,肌纖維類型的組成和肌肉NO水平不同造成。
MFI反映了成熟過程中肌原纖維蛋白的降解情況。宰后肌原纖維蛋白降解與肌纖維小片化是成熟嫩化的重要標志[32]。本試驗發現,用NOS抑制劑對宰后牦牛肉進行處理,MFI增大,與NO抑制肌原纖維蛋白的降解有關。該結果與KOH等[14]發現內源性NO參與減少蛋白質的降解和增加蛋白質的合成,并誘導骨骼肌纖維肥大,對肉嫩化有抑制作用的結果一致。
氧化被認為是影響肉品質的一個重要因素[33],巰基氧化是蛋白質氧化的最初反應之一[34]。本試驗發現,用NOS抑制劑對宰后牦牛肉處理,羰基含量顯著降低,總巰基含量顯著升高。這可能是因為NO加速肌肉中蛋白質氧化,肌肉中羰基含量上升;游離巰基被氧化為二硫鍵,游離巰基含量會降低,總巰基含量也降低。這與李玉品[13]發現NO能夠促進蛋白質氧化,使羰基含量上升;NOS抑制劑組游離巰基含量高于對照組的結果一致。隨著氧化劑濃度的增加,巰基含量降低[35]。肌原纖維蛋白氧化后,降低了其游離巰基含量[36]。此外,高水平的NO和NO衍生物可以降低宰后肌肉的抗氧化能力,從而導致冷藏期間肉中蛋白質的高水平氧化[13,37-38]。
4 結論
采用不同濃度NOS抑制劑溶液處理牦牛背最長肌,抑制了肌肉中NOS活性,減少NO的表達量,導致宰后牦牛肉成熟過程中pH、肉色*值及羰基含量顯著降低;肉色*值、MFI和總巰基含量顯著上升。NO促進宰后牦牛肉成熟過程中蛋白質氧化,抑制肌原纖維蛋白的降解,降低宰后牦牛肉的嫩度,使肉色L值降低,*值升高,對宰后牦牛肉的品質產生負面影響。
[1] 謝秀梅. 青海牦牛業可持續發展的新思路. 青海畜牧獸醫雜志, 2015, 45(6): 43.
XIE X M. New idea of sustainable development of yak industry in Qinghai ., 2015, 45(6): 43. (in Chinese)
[2] 孫志昶, 馮曉琴, 韓玲, 趙會平, 余群力. 牦牛肉宰后成熟嫩化與細胞凋亡酶活力變化研究. 農業機械學報, 2014, 45(1): 191-196, 202.
SONG Z C, FENG X Q, HAN L, ZHAO H P, YU Q L. Tendernes and apoptotic activity of Yak meat during postmortem aging., 2014, 45(1):191-196, 202. (in Chinese)
[3] 李鵬, 余群力. 甘南黑牦牛肉品質分析. 甘肅農業大學學報, 2006, 41(6): 114-117.
LI P, YU Q L. Meat quality of Gannan black yak.,2006, 42(6): 114-117. (in Chinese)
[4] 韓玲. 冷卻牦牛分割肉酶嫩化技術研究. 農業工程學報, 2003, 19(2): 171-175.
HAN L. Tenderizing technology for chilled cut yak meat by fermentation., 2003, 19(2): 171-175. (in Chinese)
[5] Liu R, Robyn D W, Zhou G H, Zhang W G.Contribution of nitric oxide and protein S-nitrosylation to variation in fresh meat quality., 2018, 143(5):30-38.
[6] Stamler J S, Lamas S, Fang F C. Nitrosylation: The prototypic redox-based signaling mechanism., 2001, 106(6): 675-683.
[7] ZHANG W G, XIAO S, AHN D U. Protein oxidation: Basic principles and implications for meat quality., 2013, 53(11):1191-1201.
[8] CARLIN K R M, HHFF-LONERGAN E, ROWE L J, LONERGAN S M. Effect of oxidation, pH, and ionic strength on calpastatin inhibition of μ-and m-calpain., 2006, 84(4): 925.
[9] LIU R, LI Y P, ZHANG W G, FU Q Q, LIU N, ZHOU G H. Activity and expression of nitric oxide synthase in pork skeletal muscles., 2015, 99: 25-31.
[10] BRANNAN R G, DECKER E A. Nitric oxide synthase activity in muscle foods., 2002, 62(2): 229-235.
[11] COTTRELL J J, MCDONAGH M B, DUNSHEA F R, WARNER R D. Inhibition of nitric oxide release pre-slaughter increases post-mortem glycolysis and improves tenderness in ovine muscles., 2008, 80(2): 511-521.
[12] ZHANG W, MARWAN A H, SAMARAWEERA H, LEE E J, AHN D U. Breast meat quality of broiler chickens can be affected by managing the level of nitric oxide., 2013, 92(11): 3044-3049.
[13] 李玉品. 蛋白質亞硝基化對宰后豬肉鈣蛋白酶系統和蛋白質降解的影響[D]. 南京: 南京農業大學, 2015.
LI Y P. Effects of protein nitrogenation on calpain activation and protein proteolysiis of pork during postmortem aging [D]. Nanjing: Nanjing Agricultural University, 2015. (in Chinese)
[14] KOH T J, TIDBALL J G. Nitric oxide inhibits calpain-mediated proteolysis of talin in skeletal muscle cells., 2000, 279(3): C806-C812.
[15] COTTRELL J J. Nitric oxide influences muscle physiology and meat quality [D]. Australia: James Cook University, 2004.
[16] ZHANG J S, KRAUS W E, TRUSKEY G A. Stretch-induced nitric oxide modulates mechanical properties of skeletal muscle cells., 2004, 287(2): C292-C299.
[17] COOK C J, SCOTT S M, DEVINE C E. Measurement of nitric oxide and the effect of enhancing or inhibiting it on tenderness changes of meat., 1998, 48(1/2): 85-89.
[18] 田甲春, 韓玲, 劉昕, 師希雄, 王文婷, 郭兆斌. 牦牛肉宰后成熟機理與肉用品質研究. 農業機械學報, 2012, 43(12): 146-150.
TIAN J C, HAN L, LIU X, SHI X X, WANG W T, GUO Z B. Ageing mechanism and meat quality during postmortem ageing of yak meat., 2012, 43(12): 146-150. (in Chinese)
[19] 李婕, 羅天林, 師希雄, 韓玲, 余群力, 馬君義. 牦牛肉宰后成熟過程中熱休克蛋白27表達量與食用品質的相關性分析. 食品科學, 2016, 37(9): 18-22.
LI J, LUO T L, SHI X X, HAN L, YU Q L, MA J Y. Correlation analysis between heat shock protein 27 expression and eating quality during postmortem aging of yak meat., 2016, 37(9): 18-22. (in Chinese)
[20] 黃明, 周光宏, 徐幸蓮, 趙蓮. 不同注射處理對牛肉剪切力和肌原纖維小片化指數的影響. 食品科學, 2005, 26(2): 49-51.
HUANG M, ZHOU G H, XU X L, ZHAO L. Effects of injection treatments on beef Warner-Bratzler shear force and myofibrillar fragmentation index.2005, 26(2): 49-51. (in Chinese)
[21] 李銀. 蛋白氧化對肌肉保水性的影響機制研究[D]. 北京: 中國農業科學院, 2014.
LI Y. Effect-mechanism of protein oxidation on water-holding capacity of muscle [D]. Beijing: Chinese Academy of Agricultural Sciences Dissertation, 2014. (in Chinese)
[22] OLIVER C N, AHN B W, MOERMAN E J, GOLDSTEIN S, STADTMAN E R. Age-related changes in oxidized proteins., 1987, 262(12): 5488-5491.
[23] LIU G, XIONG Y L, BUTTERFIELD D A. Chemical, physical, and gel-forming properties of oxidized myofibrils and whey-and soy-protein isolate., 2000, 65(5): 811-818.
[24] MAN H S J, TSUI A K Y, MARSDEN P A. Chapter Seven-Nitric oxide and hypoxia signaling., 2014, 96(12): 161-192.
[25] COTTRELL J J, PONNAMPAIAM E N, DUNSHEA F R, WARNER R D. Effects of infusing nitric oxide donors and inhibitors on plasma metabolites, muscle lactate production and meat quality in lambs fed a high quality roughage-based diet., 2015, 105: 8-15.
[26] 周光宏. 畜產品加工學. 北京: 中國農業出版社, 2011: 55.
ZHOU G H.. Beijing: China Agricultural Press, 2011: 55. (in Chinese)
[27] 劉瑞, 周光宏, 張萬剛. 一氧化氮和蛋白質亞硝基化對鮮肉品質的影響研究進展. 中國畜牧雜志, 2017(4). 1-2.
LIU R, ZHOU G H, ZHANG W G. Research progress on the effect of nitric oxide and protein nitrite on fresh meat quality., 2017(4): 1-2. (in Chinese)
[28] YOUNG M E, RADDA G K, LEIGHTON B. Nitric oxide stimulates glucose transport and metabolism in rat skeletal muscle., 1997, 322(1): 223-228.
[29] MERRY T L, LYNCH G S, MCCONELL G K. Downstream mechanisms of nitric oxide-mediated skeletal muscle glucose uptake during contraction., 2010, 299(6): R1656-R1665.
[30] SWATLAND H J. How pH causes paleness or darkness in chicken breast meat., 2008, 80(2): 396-400.
[31] MOLLER J K S, SKIBSTED L H. Nitric oxide and myoglobins., 2002, 102(4): 1167-1178.
[32] HUFF-LONERGAN E, MITSUHASHI T, BEEKMAN D D, JR P F, OLSON D G, ROBSON R M. Proteolysis of specific muscle structural proteins by mu-calpain at low pH and temperature is similar to degradation in postmortem bovine muscle., 1996, 74(5): 993-1008.
[33] SHACTER E. Quantification and significance of protein oxidation in biological samples., 2000, 32(3/4): 307-326.
[34] FENG X C, CHEN L, LEI N, WANG S X, XU X L, ZHOU G H, LI Z X. Emulsifying properties of oxidatively stressed myofibrillar protein emulsion gels prepared with (-)-epigallocatechin-3-gallate and NaCl., 2017, 65(13): 2816-2826.
[35] 胡忠良, 鄒玉峰, 林玉海, 普琦, 徐幸蓮. 氧化程度對肌原纖維蛋白熱凝膠及理化特性的影響. 食品科學, 2013, 34(17): 19-23.
HU Z L, ZOU Y F, LIN Y H, PU Q, XU X L. Effects of oxidation degree on heat-induced gel and physicochemical properties of myofibrillar protein., 2013, 34(17): 19-23. (in Chinese)
[36] 李玲, 季慧, 康大成, 周怡, 郭燕云. 氧化條件下茶多酚對豬肉肌原纖維蛋白理化和凝膠特性的影響. 食品科學, 2019, 40(2): 20-25.
LI L, JI H, KANG D C, ZHOU Y, GUO Y Y. Effects of tea polyphenols on physicochemical and gel properties of pork myofibrillar protein under oxidation conditions., 2019, 40(2):20-25. (in Chinese)
[37] ASTRUC T, MARINOVA P, LABAS R, GATELLIER P, SANTé-LHOUTELLIER V. Detection and localization of oxidized proteins in muscle cells by fluorescence microscopy., 2007, 55(23): 9554 -9558.
[38] ZHAO K, HUANG Z, LU H L, ZHOU J F, WEI T T. Induction of inducible nitric oxide synthase increases the production of reactive oxygen species in RAW264.7 macrophages., 2010, 30(4): 233-241.
Effect of Nitric Oxide Synthetase Inhibitor on Yak MeatQuality during Post-Mortem Aging
LI XueRu, SHI XiXiong, WANG JianZhong, ZHANG PanGao, TIAN Zhu, HAN Ling
(College of Food Science and Engineering, Gansu Agricultural University, Lanzhou 730070)
【Objective】The effect of nitric oxide on the yak meat quality of post-mortem was studied to provide a theoretical basis for improving the yak meat quality. 【Method】The(LD) muscles of 3-5-year-old castrated Gannan yak were used as the material. After removing the fascia and fat, the LD was cut into uniform-sized slices (8 cm × 8 cm), and uniformly pierced with a 20 G needle. Subsequently, a part of each sample were immersed at deionized water (as the control group), and the remainders of the muscle samples were immersed at 1, 10, and 100 mmol L-1nitric oxide synthase (NOS) inhibitor (N-nitro-L-arginine methyl ester hydrochloride) then aged at 4℃for 0, 1, 3, 5, and 7 d, which served as treatment group. Then, the NOS activity, the content of nitric oxide, sulfhydryl, and carbonyl, the myofibrillarfragmentation index (MFI), pH and color were analyzed. 【Result】The NOS activity and nitric oxide content of the meat sample in NOS inhibitor group were significantly decreased; at 7 d, the NOS activity of each NOS inhibitor treatment group was 30.9%, 43.6% and 74.7% lower than that of the control group, respectively. Nitric oxide levels were 4.7%, 12.5%, and 21.5% lower than the control group, respectively.The pH in the treatment group significantly decreased; at 7d, the treatment groups were 0.8%, 5.7%, and 15.2% lower than the control group, respectively. The 10 and 100 mmol L-1NOS inhibitor treatment groups were significantly different compared with the control group. The treatment significantly reduced the carbonyl content of the yak meat; at 7 d, treatment groups were 4.1%, 19.0%, and 22.2% lower than the control group, respectively. The MFI of the treatment group increased significantly; at 7 d, treatment groups were 31.1%, 23.3%, and 9.6% lower than the control group, respectively. The total sulfhydryl content was significantly increased in the treatment groups; at 7d, the control group was 3.2%, 3.7%, and 2.7% lower than the NOS inhibitor treatment groups. In addition, the treatment significantly reduced the* value and significantly increased the* value of samples; at 7d, the* values of each treatment groups were 7.1%, 40.2%, and 30.7% lower than the control group, respectively. The* value of treatment groups were 1.1%, 2.0%, and 1.1% higher than the control group, respectively. 【Conclusion】Nitric oxide promoted protein oxidation of yak meat post-mortem, inhibited tenderness of yak meat, decreased*value and increased*value, which adversely affected the quality of yak meat during post-mortem aging; NOS inhibitor inhibited NOS activity in muscle.
yak meat; post-mortem aging; nitric oxide; nitric oxide synthase inhibitor ; yak meat quality
2019-07-12;
2019-09-11
國家自然科學基金(地區科學基金項目)31760436、青年研究生指導教師扶持基金項目(GAU-QNDS-201716)
李雪茹,Tel:15870149590;E-mail:1418407813@qq.com。通信作者師希雄,Tel:13893134511;E-mail:sxix77@163.com
(責任編輯 趙伶俐)

