轉錄因子CsWRKY61對柑橘潰瘍病抗性的影響
龍琴,杜美霞,龍俊宏,何永睿,鄒修平,陳善春
轉錄因子CsWRKY61對柑橘潰瘍病抗性的影響
龍琴,杜美霞,龍俊宏,何永睿,鄒修平,陳善春
(西南大學/中國農業科學院柑桔研究所國家柑桔品種改良中心,重慶 400712)
【背景】柑橘潰瘍病(citrus bacterial canker,CBC)是世界柑橘產業上危害最嚴重的病害之一,由柑橘黃單胞桿菌柑橘亞種(subsp.,)引起,在國內外被列為檢疫對象。由于柑橘分子病理研究相對滯后,導致可供利用的抗性基因資源相對匱乏。WRKY轉錄因子參與植物抵御生物和非生物脅迫反應,前期研究發現柑橘WRKY轉錄因子可能在調控寄主抗病反應中起著重要作用。【目的】通過對超量表達、和轉基因晚錦橙()的潰瘍病抗性進行評價,明確這些基因在柑橘響應潰瘍病菌侵染中的生物學功能和抗病育種價值。進一步利用RNA-Seq解析調控的信號通路。【方法】利用農桿菌介導法進行柑橘遺傳轉化,獲得超量表達、和的晚錦橙;利用實時熒光定量PCR(qRT-PCR)分析轉基因植株中目的基因的表達水平以及拷貝數;以非轉基因植株為對照,采用離體針刺接種評價轉基因植株對潰瘍病的抗性;通過比較超量表達和野生型植株的轉錄組測序結果,探究提高柑橘潰瘍病抗性的內在機制。【結果】分別構建了CAMV啟動子控制、和表達的植物表達載體,通過組織化學染色和PCR鑒定分別獲得了6、8和6株轉基因晚錦橙。轉基因植株中目的基因的表達量有不同程度的提高,大部分轉基因植株中外源基因的拷貝數為1,只有超量表達的轉基因植株潰瘍病抗性顯著增強,其病斑面積明顯小于野生型植株,而超量表達和的轉基因植株抗病性與野生型相比無明顯差異。轉錄組分析結果顯示,超量表達的轉基因植株中生物脅迫相關途徑(包括病原入侵的感知、活性氧爆發、轉錄因子、防御基因、激素、細胞壁和次生代謝等)和信號轉導相關途徑(主要是激酶受體)均被顯著激活。【結論】超量表達能夠激活與生物脅迫和信號轉導相關的途徑,增強柑橘對潰瘍病的抗性;在柑橘抗病育種中存在潛在的應用價值。
柑橘黃單胞桿菌柑橘亞種;柑橘潰瘍病;CsWRKY61;超量表達;抗病性;轉錄組測序
0 引言
【研究意義】柑橘潰瘍病(citrus bacterial canker,CBC)是一種柑橘檢疫性細菌病害,由柑橘黃單胞桿菌柑橘亞種(subsp.,)引起[1]。其病原菌幾乎能夠危害柑橘的所有組織,嚴重時會造成落葉和落果,進一步發展將會導致枝梢枯死和幼樹死亡等,嚴重威脅世界柑橘產業的健康發展[2-3]。目前,只能通過化學農藥或集中銷毀苗木進行防控,但其勞動力和經濟成本較高。培育抗病栽培品種是解決該問題的根本途徑[4]。隨著CRISPR/Cas9等現代分子育種技術的興起,利用分子技術定向快速改良柑橘抗病性,創制新型抗性品種成為可能。然而,由于柑橘分子病理研究相對滯后,導致可供利用的抗性基因資源相對匱乏,目前柑橘抗病分子育種進展依然緩慢。因此,迫切需要挖掘柑橘源潛在的抗病基因,通過基因工程技術獲得抗潰瘍病的種質,為育種提供材料。【前人研究進展】WRKY轉錄因子是植物中最大的轉錄調控因子家族之一,是調控植物多方面過程的信號網絡的組成部分[5],含有一個或兩個WRKY結構域是其最顯著的特征。WRKY結構域大約由60個氨基酸殘基組成,其N端是絕對保守的,氨基酸序列為WRKYGQK,在C端則含有一個C2H2或C2HC型鋅指結構。根據WRKY結構域的數量和鋅指結構的類型,可將WRKY轉錄因子分為3個家族。Ⅰ類含兩個WRKY結構域;Ⅱ類和Ⅲ類含一個WRKY結構域。其中Ⅰ類和Ⅱ類WRKY轉錄因子均為C2H2型鋅指結構:C-X4-5-C-X22-23-H-X1-H;Ⅲ類WRKY轉錄因子的鋅指結構基序跟前兩類有所不同,為C2HC型:C-X7-C-X23-H-X1-C。此外,第Ⅱ類WRKY轉錄因子又可進一步分為5個亞類:Ⅱ(a)、Ⅱ(b)、Ⅱ(c)、Ⅱ(d)、Ⅱ(e)[6]。WRKY轉錄因子家族在擬南芥中有74個成員[7],水稻中有109個成員[8],毛白楊中有100個WRKY基因[9],在辣椒的基因組中有71個WRKY成員[10],在蘋果中鑒定出了116個WRKY基因[11]。在甜橙基因組中成功注釋了348個WRKY基因或片段。WRKY轉錄因子特異性識別并結合W-box“TTGACC/T”順式作用元件,通過調控下游基因的表達從而調節植物的衰老、形態建成、生物和非生物脅迫響應等多方面的進程[12-16]。目前,已有大量關于WRKY轉錄因子調控寄主植物抗病方面的研究,主要集中在擬南芥和水稻中[17-25]。如擬南芥中WRKY31、WRKY22、WRKY50、WRKY72、WRKY70、WRKY18、WRKY40和WRKY60參與寄主多種免疫應答調節,其中WRKY70是水楊酸(SA)和茉莉酸(JA)信號途徑相互拮抗的核心調節點,在植物抗病、抗蟲、抗逆防御中起著重要作用[26-28]。在柑橘中,一些WRKY轉錄因子(WRKY22、WRKY45和WRKY31等)在調控寄主抗病反應中的可能功能已有報道,比如可能是柑橘潰瘍病效應子flg22的一個靶標基因,參與柑橘的抗病反應[29]。然而,更多的研究是關于WRKY轉錄因子參與激素或非生物脅迫的調節[30-32]。【本研究切入點】WRKY家族基因在植物抗病育種中具有廣泛的應用前景,但在柑橘中鮮有研究。前期在高抗品種四季橘()和高感品種紐荷爾甜橙()的比較研究中發現,3個WRKY家族轉錄因子基因、和與柑橘潰瘍病抗性相關。在前期研究基礎上,本研究以高感品種晚錦橙()為材料,利用轉基因技術探究、和在柑橘潰瘍病菌侵染中的生物學功能。【擬解決的關鍵問題】探明在柑橘中超量表達、和對柑橘潰瘍病抗性的影響,明確這些基因在柑橘響應潰瘍病菌侵染中的生物學功能和抗病育種價值。
1 材料與方法
試驗于2016年7月至2018年9月在西南大學/中國農業科學院柑桔研究所國家柑桔品種改良中心完成。
1.1 試驗材料
柑橘遺傳轉化所用的材料為晚錦橙上胚軸,其種子采自中國農業科學院柑桔研究所國家柑桔品種改良中心資源圃,其無菌上胚軸的準備參考文獻[33]。超量表達目的基因的植物表達載體為pLGN(本實驗室改造),含抗性和報告融合基因,以方便轉基因植株的篩選,同時含有多克隆位點以利于外源基因的插入。植物遺傳轉化用農桿菌為EHA105菌株(本實驗室凍存)。
植物基本培養基為MS(Murashige and Skoog),購自Phyto Technology Laboratories?;常規酶制品購自大連TaKaRa公司;質粒提取和膠回收試劑盒購自Omega公司;植物總DNA和總RNA提取試劑盒購自Aidlab公司;實時熒光染料購自BIORAD公司;PGEM-T克隆載體購自Promega公司;其他常規試劑均為分析純。
1.2 植物表達載體的構建
、和的編碼序列參見文獻[34]。設計引物(表1),利用PCR在目的基因的5′和3′端分別添加合適的酶切位點,T-克隆到PGEM-T上,陽性克隆經PCR和測序驗證。然后,通過酶切連接技術將、、插入pLGN載體中CaMV啟動子的下游,分別構建植物表達載體p35S:CsWRKY50、p35S:CsWRKY61和p35S:CsWRKY72。將構建好的植物表達載體通過電激法轉入農桿菌EHA105中用于柑橘的遺傳轉化。

表1 基因克隆和轉基因植株鑒定所用引物
1.3 柑橘遺傳轉化
晚錦橙上胚軸遺傳轉化方法參照王軍政[35]的方法進行。經農桿菌浸染后外植體置于共培養基(添加2 mg·L-1BA、0.5 mg·L-1IAA、1 mg·L-12,4-D、100 mg·mL-1AS的MS培養基)培養2—3 d;然后轉到篩選培養基(添加2 mg·L-1BA、0.5 mg·L-1IAA、500 mg·L-1carb,50 mg·L-1km的MS培養基)上進行抗性芽再生和篩選培養。待抗性芽長到一定程度(1 cm以上),取葉片進行組織化學染色及插入基因的PCR鑒定,篩選陽性植株,將幼芽嫁接到晚錦橙實生苗上,于MS液體培養基中培養到接穗長至5 cm左右,再嫁接到枳橙實生苗上,于溫室中培養。
1.4 GUS組織化學染色
參照Jefferson等[36]的方法進行組織化學染色。具體操作如下:取抗性芽的葉片,放入已加入5-溴-4-氯-3-吲哚葡糖苷酸(X-Gluc)染色液的試管中,于37℃避光保溫過夜。染色完成后用95%的乙醇脫色,直至非轉基因植株葉片的葉綠素完全褪去呈現白色,統計染色情況,并拍照記錄。
1.5 轉基因植株PCR鑒定
按照Aidlab公司DNA提取試劑盒(cat.No.DN15)方法提取陽性植株的基因組DNA。為了避免植株內源目的基因的干擾,根據序列和目的基因序列設計目的基因表達盒的擴增(圖1、表1),用于目的基因在轉基因植株中整合的鑒定。PCR反應體積25 μL,反應條件:98℃ 1 min;98℃ 10 s,58℃ 10 s,72℃ 20 s,30次循環;72℃ 5 min。擴增完成后將PCR產物于瓊脂糖凝膠(1.0%,W/V)中進行電泳分析。
1.6 外源基因拷貝數的實時熒光定量PCR(qRT-PCR)分析
參照許蘭珍等[37]定量PCR方法,分析轉基因植株外源基因拷貝數。以柑橘內源單拷貝基因脂質轉移蛋白基因為內參基因[38],以前期確認的單拷貝轉基因植株GA-5為對照,利用qRT-PCR分析轉基因拷貝數。按照BIORAD公司的定量PCR試劑盒(cat.No.170-8882AP)說明書進行目的基因的拷貝數分析。反應體積20 μL,反應條件:95℃ 3 min;94℃ 10 s,58℃ 10 s,72℃ 10 s,40次循環;72℃10 min。以GA-5植株為對照,采用2-ΔΔCt法計算轉基因植株中目的基因的拷貝數。
1.7 目的基因表達水平的實時熒光定量PCR分析
用Aidlab公司的 EASYspin植物RNA快速提取試劑盒(cat.No.RN09)提取柑橘葉片的總RNA。嚴格參照BIORAD公司的iScriptTMcDNA合成試劑盒(cat.No.170-8891)說明書合成cDNA第一鏈。使用BIORAD公司的定量PCR試劑盒(cat.No.170- 8882AP)進行目的基因的相對定量分析。所用定量PCR引物見表2[34],使用20 μL反應體系,反應條件:95℃ 3 min;94℃ 10 s,56℃ 10 s,72℃ 10 s,共40次循環;72℃ 10 min。選用柑橘為內參基因,以非轉基因柑橘植株為對照,采用2-ΔΔCt法計算轉基因柑橘植株中目的基因的相對表達量。

表2 實時熒光定量PCR所用引物序列
1.8 轉基因植株的潰瘍病抗性評價
借鑒李云鋒等[39]的方法分離、純化和培養柑橘潰瘍病菌。選取成熟的新葉(每個株系選取6片),洗凈表面灰塵,用75%酒精消毒表面,再用無菌水沖洗3—5遍,于無菌培養皿中保濕備用。將潰瘍病菌培養至OD600為0.5,再用無菌水稀釋1 000倍至濃度為5×105cfu/mL,備用。采用離體針刺法接種[40],用直徑0.5 mm無菌針頭沿葉片中脈兩邊針刺24孔,每邊12孔。每孔添加1 μL潰瘍病菌菌液,接種后用含有無菌水棉球覆蓋葉柄保濕,石蠟帶封嚴培養皿,于28℃,16 h·d-1光照培養10 d。每天觀察發病情況并照相記錄。以野生型(wild-type,WT)為對照,利用ImageJ 2.0軟件計算接種10 d后病斑面積。根據病斑面積大小,將病情分為6個級別:0級(S<0.25 mm2);1級(0.25 mm2≤S<0.75 mm2);2級(0.75 mm2≤S<1.25 mm2);3級(1.25 mm2≤S<1.75 mm2);4級(1.75 mm2≤S<2.25 mm2);5級(S≥2.25 mm2)。分別對每級所包含的病斑數目進行統計,然后計算各株系的病情指數(disease index,DI),DI=100×Σ(各級病斑數×相應級數值)/(病斑總數×最大級數)。
1.9 轉錄組測序分析
取轉基因和野生型植株的葉片,液氮速凍,干冰運輸送上海美吉公司進行轉錄組測序和信息學分析。以甜橙基因組序列(http://citrus.hzau.edu.cn/orange/ index.php)為參考,利用TopHat2軟件對測序數據進行比對分析。使用FPKM計算基因的表達水平。以非轉基因植株為對照,采用DESeq2軟件進行表達差異的顯著性分析,以錯誤發現率FDR<0.01,差異倍數|log2fold change|>1作為差異表達基因(DEG)的篩選標準。利用非冗余蛋白數據庫(non-redundant protein database,Nr)、非冗余核苷酸數據庫(NCBI non- redundant nucleotide database,Nt)、蛋白質序列數據庫(SwissProt protein database,SwissProt)、蛋白質直系同源數據庫(Cluster of Orthologous Groups,COG)、蛋白質家族域數據庫(Protein families database,Pfam)、基因本體論數據庫(Gene Ontology,GO)和東京基因與基金組百科全書(Kyoto Encyclopedia of Genes and Genomes,KEGG)數據庫對基因進行功能注釋。
為了詳細分析調控的代謝途徑和基因,對獲得的轉錄組數據進一步進行MapMan功能注釋(http://mapman.gabipd.org/web/guest/mercator)。以|log2fold change|>1且-value校正值padj<0.05為顯著性標準可視化MapMan途徑和功能,并使用Benjamin-Hochberg方法(FDR≤0.05)對MapMan途徑和功能進行Wilcoxon雙尾檢測,篩選顯著富集的途徑、功能和基因[41]。
1.10 數據分析
試驗結果均為3次重復的平均值,采用Excel 2016進行數據整理、標準偏差計算及圖表繪制,差異顯著性分析采用SPSS 20.0軟件完成。
2 結果
2.1 超量表達CsWRKY50、CsWRKY61和CsWRKY72晚錦橙植株的獲得
用組成型表達的CaMV啟動子控制、和的表達,分別構建植物表達載體p35S:WRKY50(W50)、p35S:WRKY61(W61)、p35S:WRKY72(W72)(圖1),利用農桿菌介導法進行晚錦橙的遺傳轉化。首先通過組織化學染色及外源的PCR擴增對卡那霉素抗性植株進行篩選(圖2-A、2-B)。然后通過對目的基因的PCR擴增進一步鑒定陽性植株(圖2-C)。為了避免內源目的基因的干擾,PCR擴增的上下游引物分別設計在啟動子和目的基因上(表1、圖1)。經鑒定共獲得W50、W61和W72轉基因植株各6、8和6株,具體見圖2-A。
2.2 轉基因植株外源基因拷貝數及目的基因表達水平
以為內參基因,轉基因植株GA-5為對照,對組織化學染色和PCR檢測呈陽性的轉基因植株進行qRT-PCR分析。結果表明,W50-1、W50-3,W61-1、W61-3、W61-5、W61-6、W61-7、W61-9、W61-11、W61-12和W72-5、W72-7、W72-10株系為單拷貝;W50-5和W72-1、W72-2株系為雙拷貝(表3)。
以野生型植株為對照,利用qRT-PCR分析、、在轉基因植株中的表達水平。結果顯示,所有W50轉基因植株中表達水平均顯著高于野生型,其中W50-3和W50-5表達水平相對較高;同樣,所有W61轉基因植株中表達水平均顯著高于野生型,其中W61-5、W61-6、W61-9和W61-11的表達相對較高;5株W72轉基因植株中表達水平顯著高于野生型,1株W72轉基因植株中表達低于野生型,其中W72-2和W72-5的表達相對較高(圖3)。結合外源基因插入的拷貝數分析結果,選擇表達水平相對較高的W50-5,W61-5、W61-9、W61-11和W72-5進行重點研究。
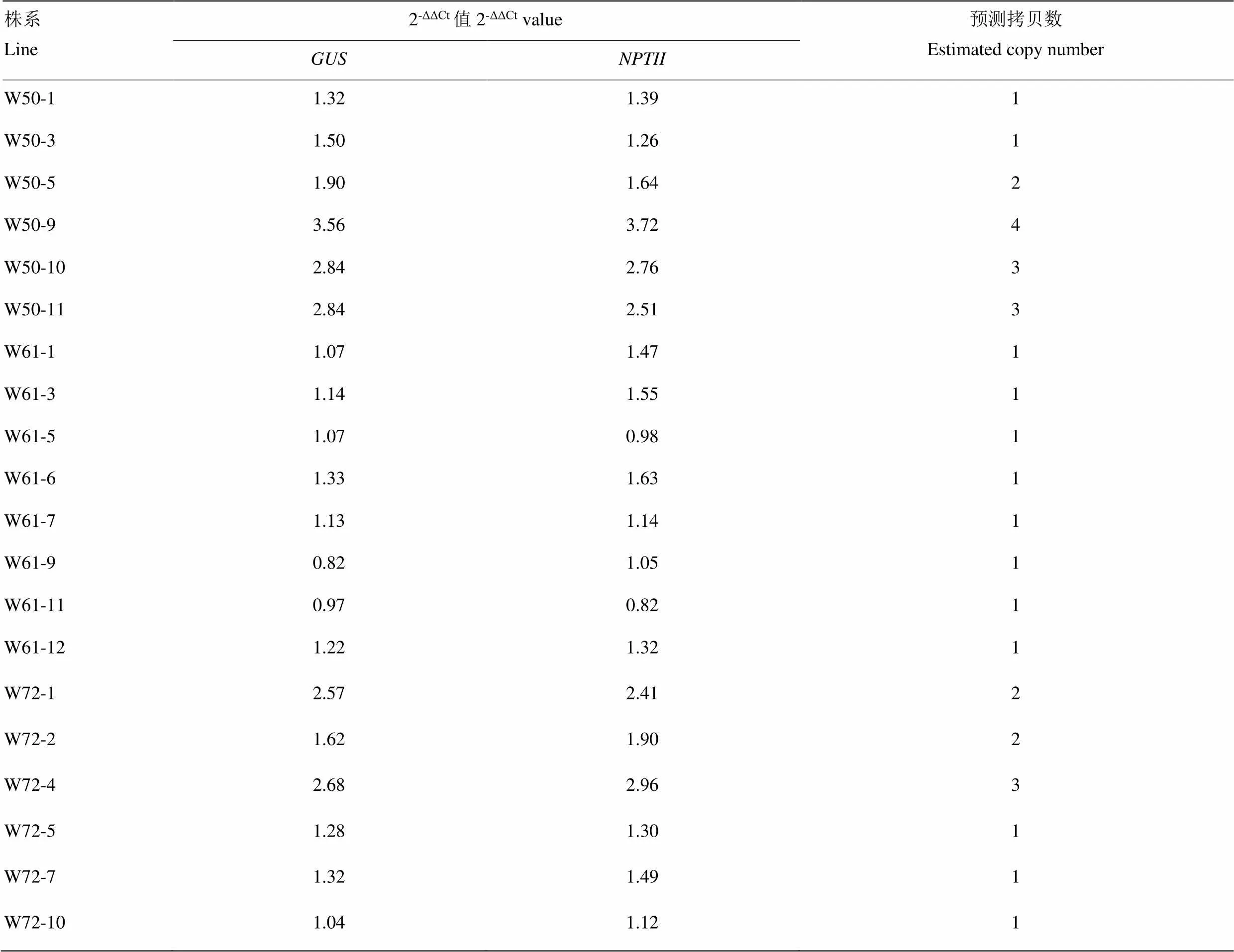
表3 轉基因植株外源基因拷貝數實時熒光定量PCR分析
2.3 轉基因植株潰瘍病抗性評價
對目的基因表達水平顯著提高的轉基因株系進行潰瘍病抗性評價。結果表明,在所獲得的轉基因植株中,只有超量表達的轉基因植株表現明顯的抗性增強,其病斑明顯小于野生型植株,而超量表達和的轉基因植株病斑大小與野生型相比無明顯差異(圖4-A)。
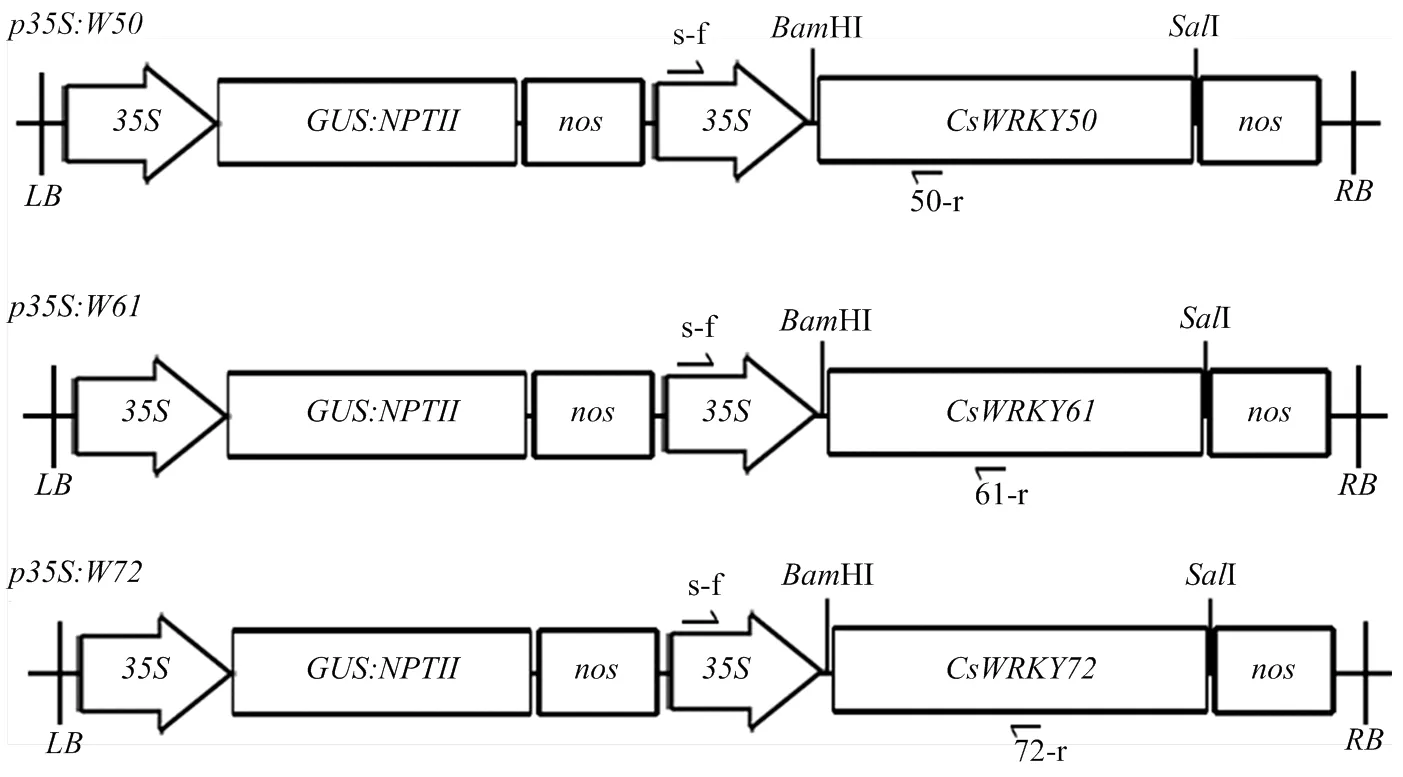
35S:花椰菜花葉病毒CaMV 35S啟動子Cauliflower mosaic virus 35S promoter (CaMV 35S);GUS:NPTII:β-葡萄糖醛酸酶GUS報告基因與卡那霉素NPTII抗性基因的融合基因The fusion gene of β-glucuronidase and neomycin phosphotransferase genes;nos:胭脂堿合酶基因的轉錄終止序列The terminator of the nopaline synthase gene。單箭頭表示轉基因植株鑒定用引物 Arrow indicates the primer used to determine transgenic plant
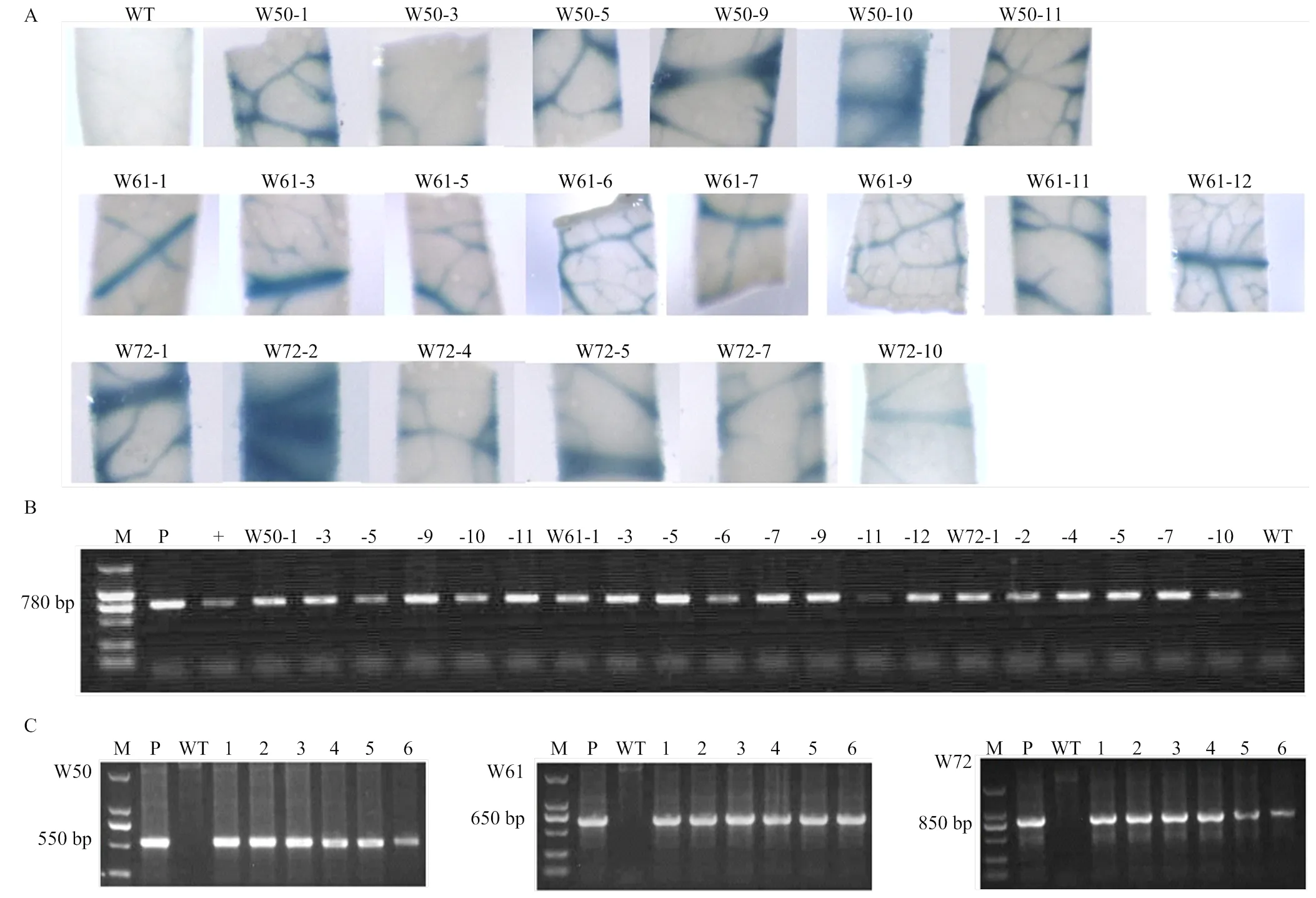
A:轉基因植株的GUS組織化學染色圖GUS histochemical staining of transgenic plants;B:轉基因植株NPTII擴增結果Amplification results of NPTII in transgenic plants;C:部分轉基因植株目的基因的PCR擴增PCR amplification of target genes in some transgenic plants。M:DNA marker;P:質粒模板plasmid template;+:已鑒定的陽性植株對照Identified positive plant control
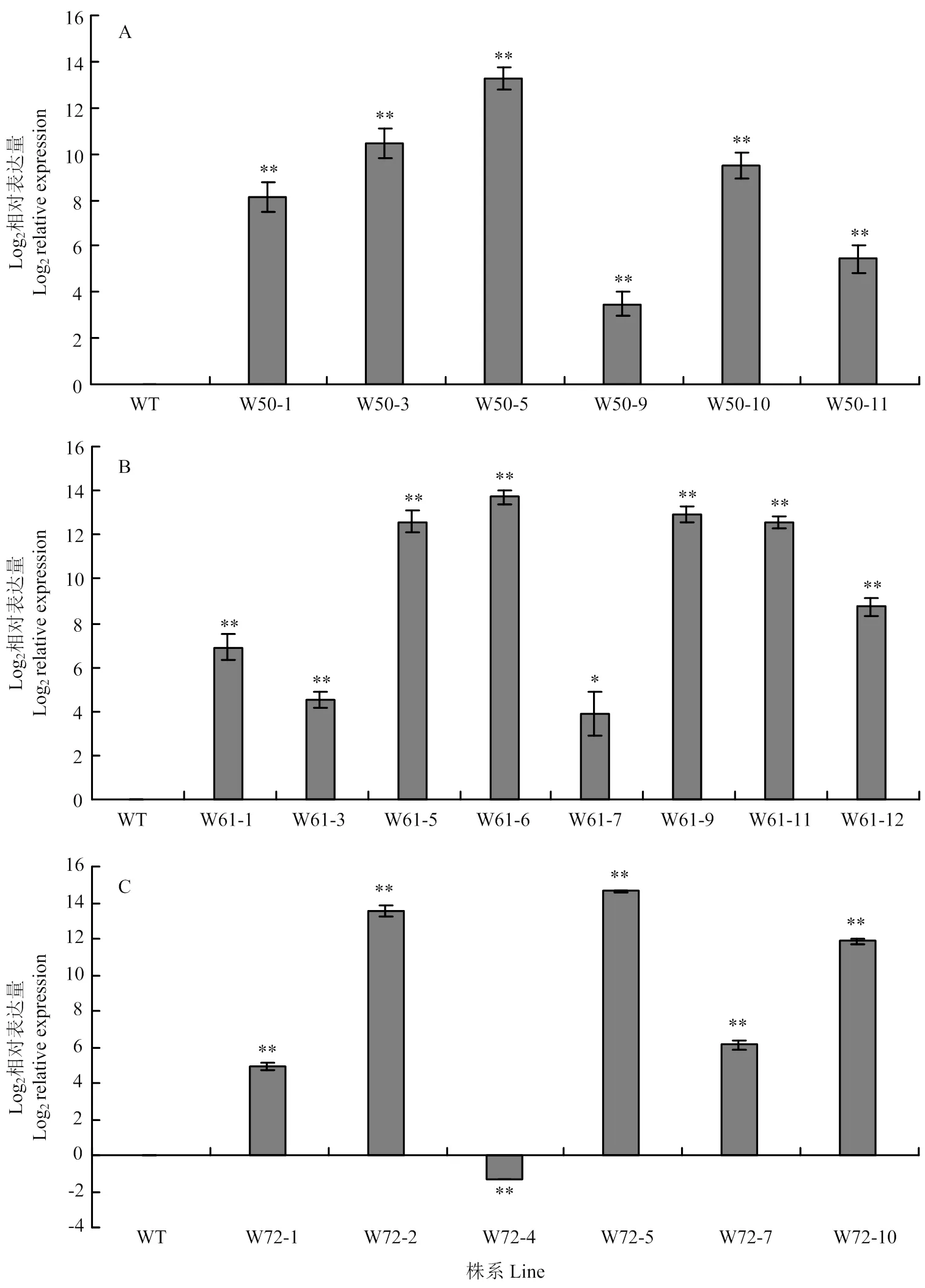
采用雙尾t檢驗確定與WT對照相關的統計學意義(*:P<0.05;**:P<0.01)。圖4同
為了對超量表達轉基因植株的抗性水平進行定量比較,進一步對其病斑面積和病情指數進行了統計分析。結果顯示,針刺接種10 d,W61-3和W61-7株系的病斑面積與野生型無明顯差異,其余株系的病斑面積均顯著小于野生型,其中W61-5、W61-6、W61-9和W61-11株系的病斑面積相對較小(圖4-B)。此外,病情指數的統計結果顯示,W61-3和W61-7株系的病情指數與野生型無明顯差異,而其余株系的病情指數均顯著降低(圖4-C)。結果表明,與野生型相比轉基因植株對潰瘍病的抗性顯著提高,其中W61-5、W61-6、W61-9和W61-11株系的抗性水平相對較高。
2.4 超量表達CsWRKY61對植株表達譜的影響
對抗性水平最高的轉基因株系W61-5和W61-9進行了轉錄組測序分析。聚類熱圖分析表明,W61-5和W61-9株系中基因表達譜與野生型相比有明顯的差異(圖5-A)。此外,與野生型相比,W61-5和W61-9株系分別有1 671和2 933個差異表達基因。在W61-5中有1 116個基因上調表達,555個基因下調表達,在W61-9中有2 010個基因上調表達,923個下調表達,其中有1 469個差異表達基因在兩株轉基因植株中具有相似的表達譜(圖5-B、5-C)。MapMan pathway富集分析顯示,兩株轉基因植株中生物脅迫和信號轉導相關途徑均被顯著激活,以W61-9株系變化更加明顯(圖5-D)。結果表明,超量表達正調控植物應答生物脅迫和信號轉導途徑。
進一步分析W61-9株系中與生物脅迫相關的差異基因情況。結果顯示,有85個差異基因直接與生物脅迫相關,且有75個基因顯著上調表達。這些基因包括病原入侵的感知、活性氧爆發、信號轉導、轉錄因子和防御基因。另外,許多與脅迫相關的激素信號、細胞壁和次生代謝等基因也顯著上調表達(圖6、表4)。
對W61-9株系中與信號轉導途徑相關的差異基因情況進一步分析。結果顯示,信號轉導途徑中主要是激酶受體基因受到影響,其中有10類激酶受體基因受到顯著影響,且絕大部分都是上調表達,包括富亮氨酸重復、奇異果甜蛋白、未知功能域(DUF 26)、植物凝集素、葉銹病LRK10 like、S-基因座、胞壁相關激酶、賴氨酸基序、褶皺樣和受體樣胞漿激酶(圖7-A、表4)。此外,與翻譯后修飾及蛋白質降解相關的基因也絕大部分上調表達(圖7-B、表4)。

圖4 轉基因植株的潰瘍病抗性評價
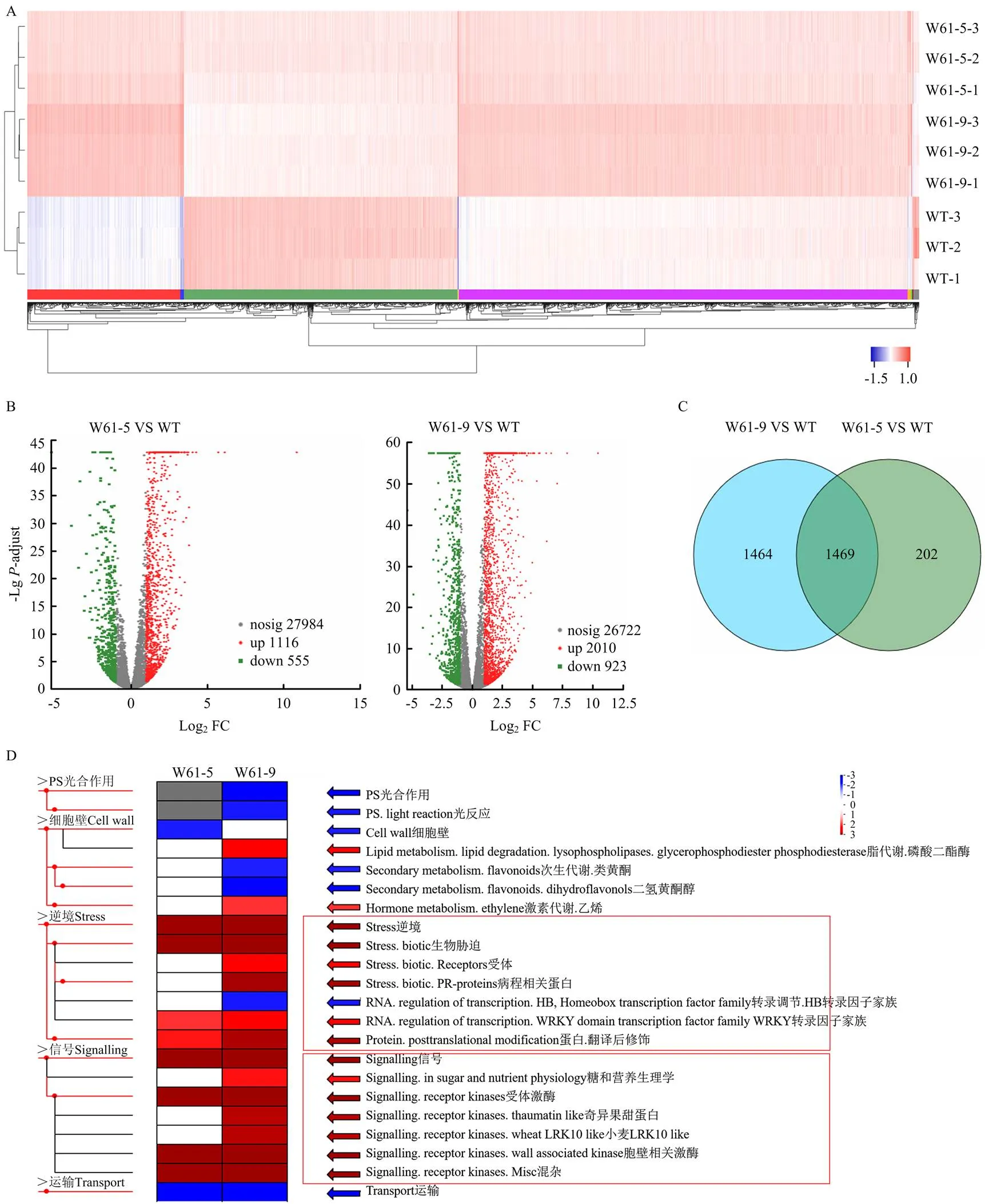
A:差異基因表達分析聚類熱圖。紅色表示上調,藍色表示下調Cluster heat map for differential gene expression analysis. Red and blue indicate up-regulated and down-regulated, respectively。B:差異基因表達分析火山圖。紅色表示上調,綠色表示下調Volcano map of differential gene expression analysis. Red and green indicate up-regulated and down-regulated, respectively。C:差異基因表達分析維恩圖。中間重疊部分代表共有的差異基因Venn diagram of differential gene expression analysis. The middle overlap represents the shared genes。D:差異表達基因的MapMan可視化分析。紅色表示上調,藍色表示下調MapMan visual analysis of differential genes. Red and blue indicate up-regulated and down-regulated, respectively
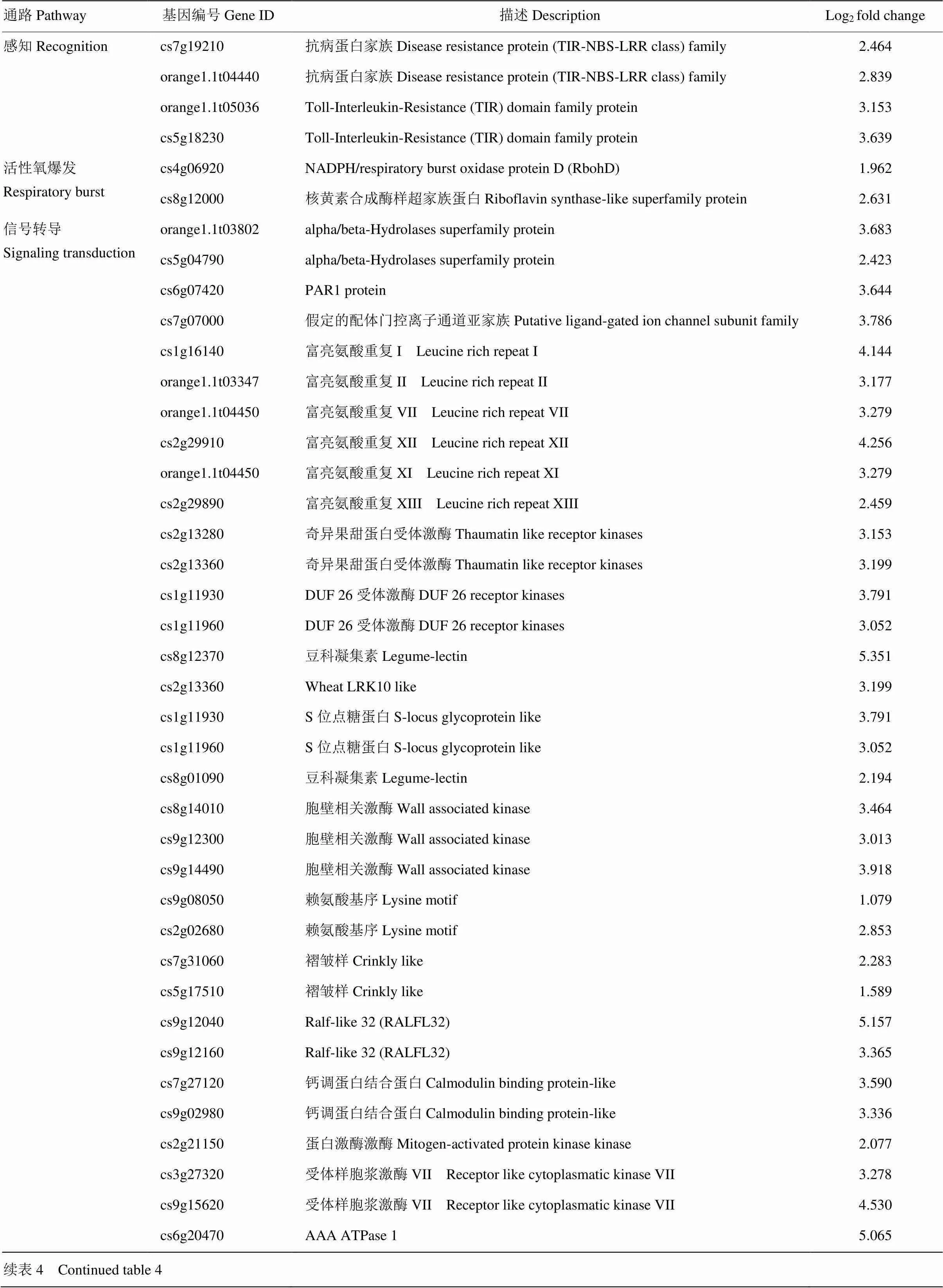
表4 轉基因植株中生物脅迫相關的差異基因情況

該圖為MapMan注釋的轉基因株系W61-9中與生物脅迫相關的差異基因情況。每個方塊表示一個基因,紅色表示上調表達,綠色表示下調表達The figure shows the differential genes involved in biotic stress of W61-9 transgenic line by MapMan. Each square represents one gene. Red and green indicate up-regulated expression and down-regulated expression, respectively
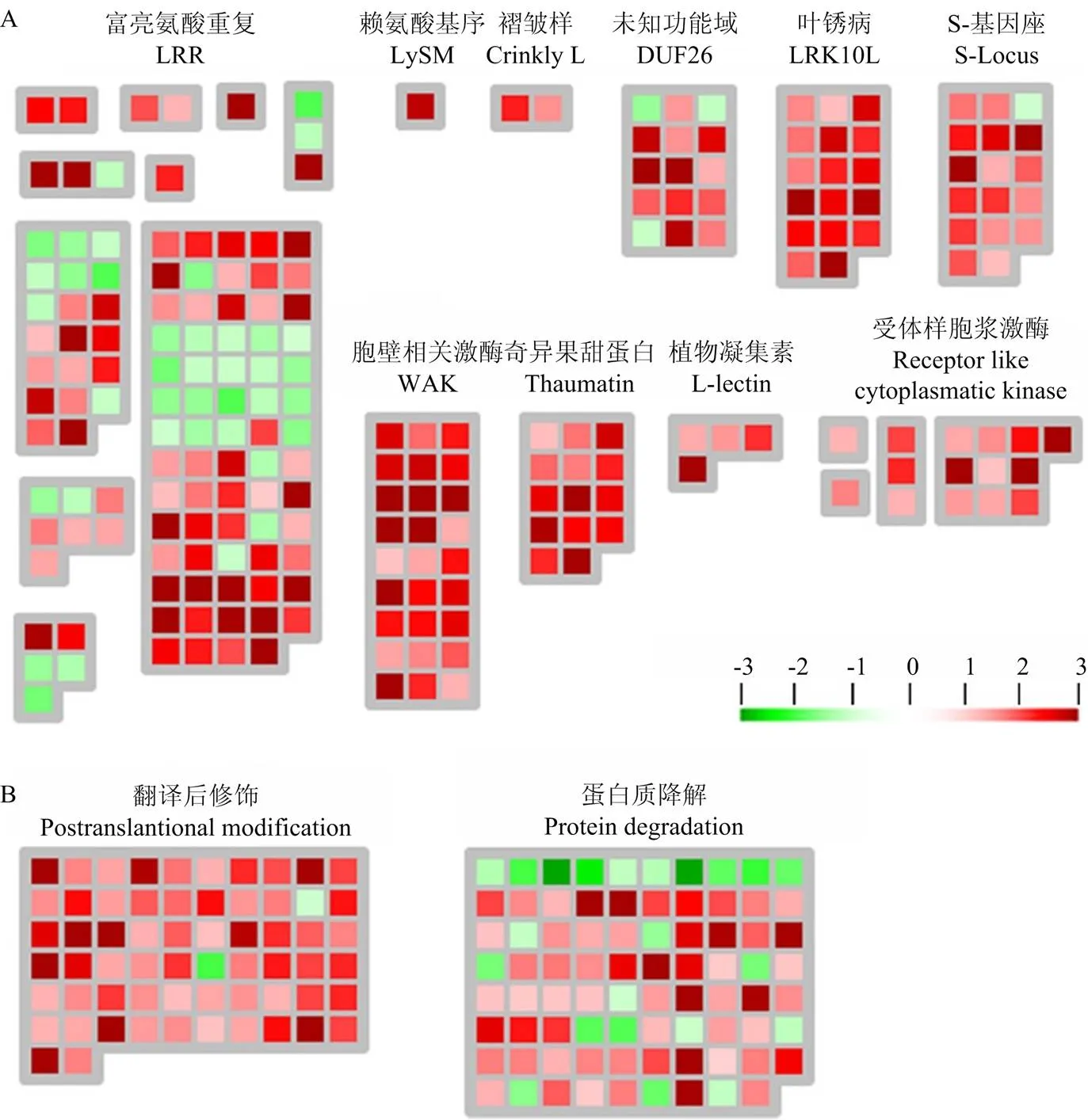
A:W61-9中受體樣激酶相關基因的表達情況Differential expression of receptor-like kinase-related genes of W61-9 line;B:W61-9中蛋白質代謝相關基因的表達情況Differential expression of genes related to protein metabolism of W61-9 line
3 討論
WRKY轉錄因子家族成員眾多,參與調節植物對生物、非生物脅迫的響應以及生長發育等多方面進程[12]。在柑橘中,Ayadi等發現和在所有非生物脅迫條件下都可能上調,但是唯一被病原菌誘導上調表達的基因,表明其在柑橘抗病性方面有潛在價值;此外還發現可能與黃龍病的防御反應相關[31]。在水稻中,的過表達增強了水稻對紫外線的耐受性和抗病性[42];過表達和增加了水稻對稻瘟病和白葉枯的敏感性,而抑制表達能夠增強其抗病性[21]。在擬南芥中,超量表達能夠提高對灰霉病的抗性,敲除該基因增加了對灰霉菌的敏感性[43];異源表達來自葡萄的提高了轉基因植株對白粉病的抗性[44]。在楊樹中,轉的毛白楊對黑斑病的耐受性增強;過表達的毛果楊對潰瘍病的抗性提高[45]。而在本研究中,過表達增強了轉基因柑橘對潰瘍病的抗性,表明WRKY轉錄因子在植物抗病性方面有很大的應用價值。
本研究發現超量表達通過激活轉基因植株中生物脅迫和信號轉導相關途徑來提高潰瘍病抗性。這些基因主要涉及病原入侵的感知、活性氧爆發、轉錄因子和防御基因,與脅迫相關的激素信號、細胞壁和次生代謝等基因,以及受體樣激酶基因。有研究表明,病原菌侵染后感病部位會出現活性氧的急劇上升,從而誘導植物發生細胞程序性死亡,這種“活性氧爆發”被稱作是細胞水平上寄主植物對病原菌侵染的最早應答之一,對寄主抗病性有積極作用[46-47]。大量研究顯示轉錄因子、激素信號、細胞壁和次生代謝相關基因在植物抗病性中發揮重要作用[48-52]。Gao等研究表明對蘿卜皺紋病毒有負調控作用,可能參與植物免疫信號通路[53]。在水稻中,被鑒定為稻瘟病抗性基因[54]。此外,有研究發現AtWRKY61對多種脅迫都有響應,且這種響應很可能通過其抑制相關基因表達而實現;同時AtWRKY61分別與AtWRKY9和AtWRKY72存在蛋白互作,這種互作可能對其參與調節多種脅迫的應答反應有重要作用[55]。本研究中轉錄組測序揭示,有20個WRKY轉錄因子受到超量表達的顯著影響,這些WRKY轉錄因子與CsWRKY61的互作關系有待深入研究。此外,病程相關蛋白(PR蛋白)是寄主植物在受到病原物侵染后誘導表達豐度最高的一類蛋白,是系統獲得性抗性(SAR)的分子標記。Qiu等[16]研究表明,WRKY轉錄因子與PR蛋白存在相互調節關系。課題組前期研究發現,CsWRKY與CsPR-1相互影響,和的轉錄水平在過表達的轉基因柑橘中明顯上調[34]。在本研究中,轉錄組測序結果顯示超量表達的轉基因植株中絕大部分PR蛋白的表達顯著提高。這些結果與超量表達顯著提高了轉基因植株對潰瘍病的抗性相吻合,但其具體的調節機制有待進一步研究。
Gao等[56]研究表明,可能通過正調控水楊酸信號途徑,負調控茉莉酸信號途徑從而增強對灰霉病的抗性;周鵬飛[34]研究表明,受潰瘍病菌誘導后,的轉錄水平在抗病品種四季橘中大幅度提高,而在感病品種紐荷爾臍橙中變化不明顯,表明可能對潰瘍病抗性有積極作用;此外,Bhattarai等[57]發現WRKY72型轉錄因子參與了番茄和擬南芥的基礎免疫以及番茄R基因介導的基因對基因的抗性;Xu等[27]研究表明,接種潰瘍病菌后,隨著接種時間的增加在感病品種紐荷爾臍橙中的表達量逐漸下降,而在抗病品種四季橘中無明顯變化,推測潰瘍病菌侵染通過下調的表達,可能對介導的抗病過程有抑制作用。然而,本研究中抗病性評價結果顯示超量表達和的植株病斑面積與野生型對照無明顯差異,推測可能是轉基因植株太少未篩選到抗性株系,或者轉基因植株通過其他途徑抵消了和發揮的作用。
4 結論
能夠激活與生物脅迫和信號轉導相關的途徑,是柑橘抗病育種中有潛在應用價值的抗性基因。研究結果為柑橘潰瘍病抗性遺傳改良提供了重要基因資源。
[1] Brunings A M, Gabriel D W.: breaking the surface., 2003, 4(3): 141-157.
[2] Schubert T S, Rizvi S A, Sun X, Gottwald T R, Graham J H, Dixon W N. Meeting the challenge of eradicating citrus canker in Florida—again., 2001, 85(4): 340-356.
[3] Behlau F, Belasque J, Bergamin Filho A, Graham J H, Leite R P, Gottwald T R. Copper sprays and windbreaks for control of citrus canker on young orange trees in southern Brazil., 2008, 27(3/5): 807-813.
[4] Das A K. Citrus canker-A review., 2003, 5(1): 52-60.
[5] Bakshi M, Oelmüller R. WRKY transcription factors: Jack of many trades in plants., 2014, 9(2):.
[6] Eulgem T, Rushton P J, Robatzek S, Somssich I E. The WRKY superfamily of plant transcription factors., 2000, 5(5): 199-206.
[7] Eulgem T, Somssich I E. Networks of WRKY transcription factors in defense signaling., 2007, 10(4): 366-371.
[8] Ross C A, Liu Y, Shen Q J. Thegene family in rice ()., 2007, 49(6): 827-842.
[9] Jiang Y, Duan Y, YIN J, Ye S, Zhu J, Zhang F, LU W, FAN D, LUO K. Genome-wide identification and characterization of theWRKY transcription factor family and analysis of their expression in response to biotic and abiotic stresses., 2014, 65(22): 6629-6644.
[10] 刁衛平, 王述彬, 劉金兵, 潘寶貴, 郭廣君, 戈偉. 辣椒全基因組WRKY轉錄因子的分析. 園藝學報, 2015, 42(11): 2183-2196.
DIAO W P, WANG S B, LIU J B, PAN B G, GUO G J, GE W. Gemone-wide analysis of the WRKY transcription factor family in pepper., 2015, 42(11): 2183-2196. (in Chinese)
[11] 許瑞瑞, 張世忠, 曹慧, 束懷瑞. 蘋果WRKY轉錄因子家族基因生物信息學分析. 園藝學報, 2012, 39(10): 2049-2060.
XU R R, ZHANG S Z, CAO H, SHU H R.Bioinformatics analysis of WRKY transcription factor genes family in apple., 2012, 39(10): 2049-2060. (in Chinese)
[12] Phukan U J, Jeena G S, Shukla R K. WRKY transcription factors: molecular regulation and stress responses in plants., 2016, 7: Article 760.
[13] Dang F F, Wang Y N, Yu L, Eulgem T, Lai Y, Liu Z Q, WANG X, QIU A L, ZHANG T X, LIN J, CHEN Y S, GUAN D Y, CAI H Y, MOU S L, HE S L. CaWRKY40, a WRKY protein of pepper, plays an important role in the regulation of tolerance to heat stress and resistance toinfection., 2013, 36(4): 757-774.
[14] Miao Y, Jiang J, Ren Y, Zhao Z. The single-stranded DNA-binding protein WHIRLY1 repressesexpression and delays leaf senescence in a developmental stage-dependent manner in., 2013, 163(2): 746-756.
[15] Pandey S P, Roccaro M, Sch?n M, Logemann E, Somssich I E. Transcriptional reprogramming regulated by WRKY18 and WRKY40 facilitates powdery mildew infection of., 2010, 64(6): 912-923.
[16] Qiu Y P, Yu D Q. Over-expression of the stress-inducedenhances disease resistance and drought tolerance in., 2009, 65(1): 35-47.
[17] Kloth K J, Wiegers G L, Busscher-Lange J, Van Haarst J C, Kruijer W, Bouwmeester H J, Dicke M, Jongsma M A. AtWRKY22 promotes susceptibility to aphids and modulates salicylic acid and jasmonic acid signalling., 2016, 67(11): 3383-3396.
[18] Abbruscato P, Nepusz T, Mizzi L, Corvo M D, Morandini P, Fumasoni I, MICHEL C, PACCANARO A, GUIDERDONI E, SCHAFFRATH U, MOREL J B, PIFFANELLI P, FAIVRE-RAMPANT O., a monocot WRKY gene, plays a role in the resistance response to blast., 2012, 13(8): 828-841.
[19] Kim K C, Lai Z, Fan B, Chen Z.WRKY38 and WRKY62 transcription factors interact with histone deacetylase 19 in basal defense., 2008, 20(9): 2357-2371.
[20] Lai Z, Vinod K M, Zheng Z, Fan B, Chen Z. Roles ofWRKY3 and WRKY4 transcription factors in plant responses to pathogens., 2008, 8: 68.
[21] Liu J, Chen X, Liang X, Zhou X, Yang F, Liu J, HE S Y, GUO Z. Alternative splicing of riceandtranscription factor genes in pathogen defense., 2016, 171(2): 1427-1442.
[22] Liu S, Kracher B, Ziegler J, Birkenbihl R P, Somssich I E. Negative regulation of ABA signaling by WRKY33 is critical forimmunity towards2100., 2015, 4: e07295.
[23] Liu X, Bai X, Wang X, Chu C., a rice transcription factor, is involved in rice defense response., 2007, 164(8): 969-979.
[24] Wu K L, Guo Z J, Wang H H, Li J. The WRKY family of transcription factors in rice andand their origins., 2005, 12: 9-26.
[25] Pandey S P, Somssich I E. The role of WRKY transcription factors in plant immunity., 2009, 150(4): 1648-1655.
[26] ülker B, Mukhtar M S, Somssich I E. The WRKY70 transcription factor ofinfluences both the plant senescence and defense signaling pathways., 2007, 226(1): 125-137.
[27] Xu X, Chen C, Fan B, Chen Z. Physical and functional interactions between pathogen-inducedWRKY18, WRKY40, and WRKY60 transcription factors., 2006, 18(5): 1310-1326.
[28] Zhou X, Jiang Y, Yu D. WRKY22 transcription factor mediates dark-induced leaf senescence in., 2011, 31(4): 303-313.
[29] Shi Q, Febres V J, Jones J B, Moore G A. Responsiveness of different citrus genotypes to thessp.-derived pathogen-associated molecular pattern (PAMP) flg22 correlates with resistance to citrus canker., 2015, 16(5): 507-520.
[30] Vives-Peris V, Marmaneu D, Gómez-Cadenas A, Pérez- Clemente R M. Characterization ofwrky transcription factors and their responses to phytohormones and abiotic stresses., 2018, 62(1): 33-44.
[31] Ayadi M, Hanana M, Kharrat N, Merchaoui H, Marzoug R B, Lauvergeat V, Reba? A, Mzid R. The wrky transcription factor family in citrus: valuable and useful candidate genes for citrus breeding., 2016, 180(3): 516-543.
[32] ?ahin-?evik M, Moore G A. Identification of a drought- and cold-stress inducible wrky gene in the cold-hardy citrus relative., 2013, 41(2): 57-68.
[33] Zou X, Li D, Luo X, Luo K, Pei Y. An improved procedure for-mediated transformation of trifoliate orange (L. Raf.) via indirect organogenesis., 2008, 44(3): 169-177.
[34] 周鵬飛. 柑橘潰瘍病相關WRKY轉錄因子和PR基因的篩選與功能分析[D]. 重慶: 西南大學, 2017.
ZHOU P F. Screening and functional analysis of WRKY transcription factor and pathogenesis-related protein genes associated with citrus canker[D]. Chongqing: Southwest University, 2017. (in Chinese)
[35] 王軍政.分泌型融合基因的構建及其轉化柑桔的研究[D]. 重慶: 西南大學, 2012.
WANG J Z. Construction and citrus transformation of novelgene for improving extracellualr secretion of antibacterial peptide[D]. Chongqing: Southwest University, 2012. (in Chinese)
[36] Jefferson R A, Kavanagh T A, Bevan M W. Gus fusions:-glucuronidase as a sensitive and versatile gene fusion marker in higher plants., 1987, 6(13): 3901-3907.
[37] 許蘭珍, 何永睿, 雷天剛, 彭愛紅, 姚利曉, 姜國金, 李強, 鄒修平, 陳善春. 轉基因柑橘外源基因拷貝數的實時熒光定量pcr檢測. 園藝學報, 2016, 43(6): 1186-1194.
XU L Z, HE Y R, LEI T G, PENG A H, YAO L X, JIANG G J, LI Q, ZOU X P, CHEN S C. Identification of the copy number of exogenous gene in transgenic citurs by quantitative real-time PCR., 2016, 43(6): 1186-1194. (in Chinese)
[38] Wu Z, Burns J K. Isolation and characterization of a cdna encoding a lipid transfer protein expressed in ‘valencia’ orange during abscission., 2003, 54(385): 1183-1191.
[39] 李云鋒, 李祥. 柑桔潰瘍病菌存活期的研究. 植物檢疫, 2002, 16(2): 69-72, 77.
LI Y F, LI X. Survival period ofpv.., 2002, 16(2): 69-72, 77. (in Chinese)
[40] 李云鋒, 李祥. 柑桔潰瘍病菌離體葉接種檢驗法的研究. 華中農業大學學報, 2000, 19(5): 421-423.
LI Y F, LI X. Detection method of inoculation on citurs leaveswithpv., 2000, 19(5): 421-423. (in Chinese)
[41] Thimm O, Blasing O, Gibon Y, Nagel A, Meyer S, Kruger P, Selbig J, Muller L A, Rhee S Y, Stitt M. MAPMAN: a user-driven tool to display genomics data sets onto diagrams of metabolic pathways and other biological processes., 2004, 37(6): 914-939.
[42] Wang H, Hao J, Chen X, Hao Z, Wang X, Lou Y, PENG Y, GUO Z. Overexpression of riceenhances ultraviolet b tolerance and disease resistance in rice plants., 2007, 65(6): 799-815.
[43] Zheng Z, Qamar S A, Chen Z, Mengiste T.wrky33 transcription factor is required for resistance to necrotrophic fungal pathogens., 2006, 48(4): 592-605.
[44] Wang X, Guo R, Tu M, Wang D, Guo C, Wan R, LI Z, WANG X. Ectopic expression of the wild grape WRKY transcription factor VqWRKY52 inenhances resistance to the biotrophic pathogen powdery mildew but not to the necrotrophic pathogen., 2017, 8: Article 97.
[45] 朱鏡如. 毛果楊轉錄因子基因的克隆與功能分析[D]. 重慶: 西南大學, 2013.
ZHU J R. Isolation and functional analysis of. Chongqing: Southwest University, 2013. (in Chinese)
[46] Heath M C. Hyper sensitive response-related death., 2000, 44(3): 321-334.
[47] Greenberg J T, Yao N. The role and regulation of programmed cell death in plant-pathogen interactions., 2004, 6(3): 201-211.
[48] Robert-Seilaniantz A, Grant M, Jones J D G. Hormone crosstalk in plant disease and defense: more than just jasmonate- salicylate antagonism., 2011, 49: 317-343.
[49] Hückelhoven R. Cell wall-associated mechanisms of disease resistance and susceptibility., 2007, 45: 101-127.
[50] Vairappan C S, Anangdan S P, Kai L T, Matsunaga S. Role of secondary metabolites as defense chemicals against ice-ice disease bacteria in biofouler at carrageenophyte farms., 2010, 22(3): 305-311.
[51] 郭艷玲, 張鵬英, 郭默然, 陳靠山. 次生代謝產物與植物抗病防御反應. 植物生理學報, 2012, 48(5): 429-434.
Guo Y L, Zhang P Y, Guo M R, CHEN K S. Secondary metabolites and plant defence against pathogenic disease., 2012, 48(5): 429-434. (in Chinese)
[52] Yang K Y, Liu Y, Zhang S. Activation of a mitogen-activated protein kinase pathway is involved in disease resistance in tobacco., 2001, 98(2): 741-746.
[53] Gao R, Liu P, Yong Y, Wong S M. Genome-wide transcriptomic analysis reveals correlation between higher wrky61 expression and reduced symptom severity in turnip crinkle virus infected., 2016, 6: 24604.
[54] Yan L, Qi X, Young N D, Olsen K M, Caicedo A L, Jia Y. Characterization of resistance genes to rice blast fungusin a “green revolution” rice variety., 2015, 35: 52.
[55] 范曉江, 郭小華, 牛芳芳, 楊博, 江元清. 擬南芥WRKY61轉錄因子的轉錄活性與互作蛋白分析. 西北植物學報, 2018, 38(1): 1-8.
FAN X J, GUO X H, NIU F F, YANG B, JIANG Y Q. Exploring the transcriptional activity and interacting proteins of WRKY61 transcriptional factor in., 2018, 38(1): 1-8. (in Chinese)
[56] Gao Q M, Venugopal S, Navarre D, Kachroo A. Low oleic acid-derived repression of jasmonic acid-inducible defense responses requires the WRKY50 and WRKY51 proteins., 2011, 155(1): 464-476.
[57] Bhattarai K K, Atamian H S, Kaloshian I, Eulgem T. WRKY72-type transcription factors contribute to basal immunity in tomato andas well as gene-for-gene resistance mediated by the tomato R gene., 2010, 63(2): 229-240.
Effect of Transcription Factor CsWRKY61 on Citrusbacterial Canker Resistance
LONG Qin, Dumeixia, Long JunHong, Heyongrui, Zou XiuPing, Chen ShanChun
(National Center for Citrus Variety Improvement, Citrus Research Institute, Southwest University/Chinese Academy of Agricultural Sciences, Chongqing 400712)
【Background】Citrus bacterial canker (CBC) caused bysubsp.() is one of the most serious citrus diseases in the world, which is a quarantine disease. Due to the relatively backward research of citrus molecular pathology, the available resistance gene resources are relatively scarce. WRKY transcription factor is involved in plant responses to biotic and abiotic stress. The previous study has found that citrus WRKY transcription factor may play an important role in regulating host disease resistance response.【Objective】The objective of this study is to evaluate the canker resistance of transgenic citrus () with over-expression of,and, clarify the biological function and disease resistance breeding value of these genes in citrus in response to. RNA-seq was further used to analyze the signaling pathway regulated by.【Method】-mediated method was used to obtain transgenic citrus plants with over-expression of,and. Real-time quantitative PCR (qRT-PCR) was used to analyze the expression level and copy number of the target genes.pinprick inoculation was used to evaluate the resistance of transgenic plants to canker disease. The molecular mechanism ofimproving citrus bacterial canker resistance was investigated by transcriptome sequencing analysis of over-expressionand wild-type (WT) plants.【Result】The plant expression vectors of CAMVpromoter controlling the expression of,andwere constructed, and 6, 8 and 6 transgenic lines were obtained bystaining and PCR identification, respectively. The expression of the target gene in transgenic plants increased in different degrees. The copy number of exogenous genes in most transgenic plants was 1. Only the transgenic plants with over-expression ofhad significantly enhanced canker disease resistance, and the lesion area was significantly smaller than that of WT plants, while over-expression ofandtransgenic plants had no significant difference in disease resistance compared with WT. Transcriptomics analysis showed that biotic stress related pathways (including pathogen recognition, respiratory burst, transcription factors, defense genes, hormones, cell wall and secondary metabolism, etc.) and signal transduction-related pathways (mainly kinase receptors) were significantly activated in over-expression oftransgenic plants. 【Conclusion】Over-expression ofcan activate pathways related to biotic stress and signal transduction, enhance citrus bacterial canker resistance. It is suggested thathas potential application value in citrus disease resistance breeding.
subsp.(); citrus bacterial canker; CsWRKY61; over-expression; disease resistance; transcriptome sequencing
2019-09-26;
2019-11-13
國家重點研發計劃(2018YFD1000300)、重慶市自然科學基金-博士后基金(cstc2019jcyj-bshX0024)、中央高校基本科研業務費(XDJK2019C027)、國家現代農業產業技術體系建設專項資金(CARS-26)
龍琴,E-mail:longlong860923@126.com。通信作者鄒修平,E-mail:zouxiuping@cric.cn。通信作者陳善春,E-mail:scchen@cric.cn
(責任編輯 岳梅)

