利用CRISPR/Cas9技術編輯水稻香味基因Badh2
祁永斌,張禮霞,王林友,宋建,王建軍
利用CRISPR/Cas9技術編輯水稻香味基因
祁永斌,張禮霞,王林友,宋建,王建軍
(浙江省農業科學院作物與核技術利用研究所,杭州 310021)
【目的】稻米香味是水稻品質改良的一個重要內容,其性狀主要受1個隱性基因的控制。利用CRISPR/Cas9基因編輯技術將常規品種中的進行編輯,從而獲得發生突變的基因編輯株系,使香味性狀得到改良。【方法】利用CRISPR/Cas9基因編輯的原理,在水稻的第2和第7外顯子處設計靶點,通過Blast分析確定其特異性并構建到CRISPR/Cas9表達載體。以浙江省主要推廣的水稻品種嘉58和秀水134的愈傷組織為受體,利用農桿菌介導的遺傳轉化法,通過潮霉素抗性篩選獲得陽性轉基因植株。轉基因株系經測序明確其在的突變類型,經PCR分析與鑒定獲得發生突變并無轉基因標記成分的穩定株系。利用氣相色譜質譜聯用儀(GC-MS)檢測基因編輯株系糙米米粉中2-AP的含量,明確其香味成分與非轉基因對照之間的差異。【結果】在水稻第2和第7外顯子處設計靶點構建表達載體,通過遺傳轉化轉基因株系的完成了定向突變。共獲得T0代嘉58基因編輯的株系15株,在第2外顯子處發生突變的有8株5種不同的突變類型,均為不同單堿基插入不同位點;在第7外顯子處發生突變的有7株5種不同的突變方式,均為堿基或片段缺失。獲得秀水134基因編輯的株系11株,在第2外顯子處共有5株,均為單堿基插入;在第7外顯子處有6株,均為片段缺失。48株T1代秀水134基因編輯株系中,共獲得16株無轉基因標記的基因編輯株系,其中5株在第2外顯子發生突變,11株在第7外顯子處發生突變。4個T2代基因編輯株系的米粉中2-AP平均含量分別為0.309、0.347、0.332和0.295 μg·g-1,極顯著(<0.01)高于非轉基因對照(0.046 μg·g-1)。【結論】利用CRISPR-Cas9技術可對水稻香味基因進行定向編輯,并且可獲得無轉基因成分的基因編輯株系,其香味性狀得到明顯改良。
水稻;CRISPR/Cas9;基因編輯;;香味
0 引言
【研究意義】水稻是中國重要的糧食作物,香米由于具有獨特香味,深受消費者青睞,生產和市場價值較高。因此,水稻的香味性狀已成為衡量大米品質的一個重要指標,是水稻品質改良的重要研究內容,發掘和創制優質香稻資源是開展稻米品質改良的重要途徑。【前人研究進展】從20世紀70年代起,許多研究者對香米的香氣成分進行了廣泛而深入的研究,Yajima等[1]在1979年報道香米含有114種揮發性化合物,Buttery等[2]發現2-乙酰-1-吡咯啉(2-AP)是香米香味的主要組成成分,2-AP在香米品種除根系外的其他各個組織中均能被檢測到。目前,研究表明,稻米香味主要受水稻第8染色體上的隱性基因調控。該基因由15個外顯子和14個內含子組成,其中,第8外顯子編碼一個VTELGGKSP結構域,第9外顯子編碼一個28半胱氨酸結構域,都是2種β-乙醛脫氫酶BAD1和BAD2的保守域,第10外顯子編碼的EGCRLGSVVS也在BAD蛋白中非常保守,在非香型水稻中被發現[3]。研究發現,在一些香米品種如蘇御糯、泰國茉莉花型香米和印度巴斯瑪蒂型香米品種中,由于在的第7外顯子上有8 bp的堿基缺失和3個SNPs差異導致移碼突變,翻譯提前終止;在中國的一些香米品種中,發現第2外顯子上有7 bp的堿基缺失,造成發生突變,從而產生香味。由于香型水稻中編碼區的第7或第2外顯子處發生了移碼突變,導致其編碼的乙醛脫氫酶翻譯提前終止,功能保守的結構域不能翻譯。因此,無法完成脫氫反應,從而造成2-乙酰-1-吡咯啉(2-AP)的積累而產生香味[4-9]。張江麗等[10]鑒定了86份具有香味的水稻種質資源,其中絕大部分的香味性狀受等位基因控制。因此,是調控稻米香味的主要基因,通過人工突變的方式,改變其DNA遺傳信息,可以創制出新的香型種質資源。目前,鑒定稻米香味的常規方法是利用人工嗅覺直接判斷,或者將需要檢測的組織在水或KOH溶液中煮沸后根據氣味再進行人工判斷[11],也可以利用GC-MS氣相色譜質譜聯用儀通過成分檢測確定其香味[12]。這些方法在香味檢測的過程中需要花費大量的人力、物力和時間,而且檢測結果因個體差異并不準確,限制其在育種過程中的利用。隨著生物技術的發展,利用分子標記輔助選擇、轉基因抑制表達、基因編輯等方法可提高育種效率,加快香型水稻的培育。利用香型品種中的分子特征,發展的SNP標記可用于香味基因的分子標記輔助選擇,從而提高育種效率[13-15]。利用RNAi技術降低在轉基因植株中的表達,從而使2-AP不能被降解[16];Chen等[17]利用玉米泛素啟動子驅動人工microRNA在轉基因植株表達,使轉基因株系中的表達下調,其后代籽粒中的2-AP含量顯著提高。近年來,隨著基因編輯技術的不斷發展和成熟,利用基因編輯技術改良目標性狀基因成為有效的手段之一。轉錄激活樣效應因子核酸酶(transcription activator-like effector nuclease,TALEN)技術[18],鋅指核酸酶(Zinc-finger nuclease,ZFN)技術[19]和成簇規律間隔短回文重復(clustered regulatory interspaced short palindromic repeat,CRISPR)[20]等被視為有效的基因編輯工具。【本研究切入點】Shan等[21]利用TALEN 技術,對日本晴的進行編輯,純合的T1代株系中2-AP含量明顯增加。邵高能等[22]利用CRISPR/Cas9系統對中花11的進行編輯,在1株純合的基因編輯株系中的轉錄顯著下調,香味物質大量積累。因此,利用基因編輯技術改良水稻香味性狀,可加快香稻育種進程。但日本晴與中花11均為模式品種,其本身農藝性狀與推廣品種相比具有一定的差距,難以在生產上直接利用。【擬解決的關鍵問題】本研究以浙江省主要推廣的水稻品種嘉58、秀水134為研究材料,利用CRISPR/Cas9基因編輯技術獲得不同的轉基因株系,通過測序及PCR鑒定獲得發生突變并穩定遺傳的無標記轉基因純合株系,基因編輯株系的2-AP含量顯著高于非轉基因對照,為香型水稻的利用提供新的種質資源。
1 材料與方法
1.1 材料
以浙江省主要推廣的晚粳稻品種嘉58與秀水134為材料,利用農桿菌介導的遺傳轉化法,將植物表達載體T-DNA片段插入水稻基因組。轉基因材料于2018年正季種植于浙江省農業科學院楊渡試驗基地轉基因試驗區,采用常規種植與田間管理。
1.2 基因編輯載體構建
根據香型水稻在第2和第7外顯子出現堿基缺失突變的特性,利用https://crispr.cos.uni-heidelberg. de/index.html在線分析工具,分別以第2和第7外顯子序列為靶序列設計靶點,其中Oligo-up1和Oligo-lw1為第2外顯子設計靶點接頭,Oligo-up2和Oligo-lw2為第7外顯子設計靶點接頭。結合靶點上下游DNA序列通過Blast分析,確保其特異性。Oligo二聚體制備(20 μL體系),含Buffer Aneal 18 μL、上下游引物各1 μL。95℃加熱3 min后,以0.2℃·s-1緩慢降至20℃。將Oligo二聚體構建至CRISPR/Cas9載體(圖1),10 μL體系含CRISPR/Cas9載體2 μL、Oligo二聚體1 μL、Enzyme Mix 1 μL、和H2O 6 μL,20℃反應60 min(以上載體試劑盒由杭州百格生物技術有限公司提供)。構建好的Cas9/gRNA-Oligo質粒載體通過測序驗證后用于水稻遺傳轉化。
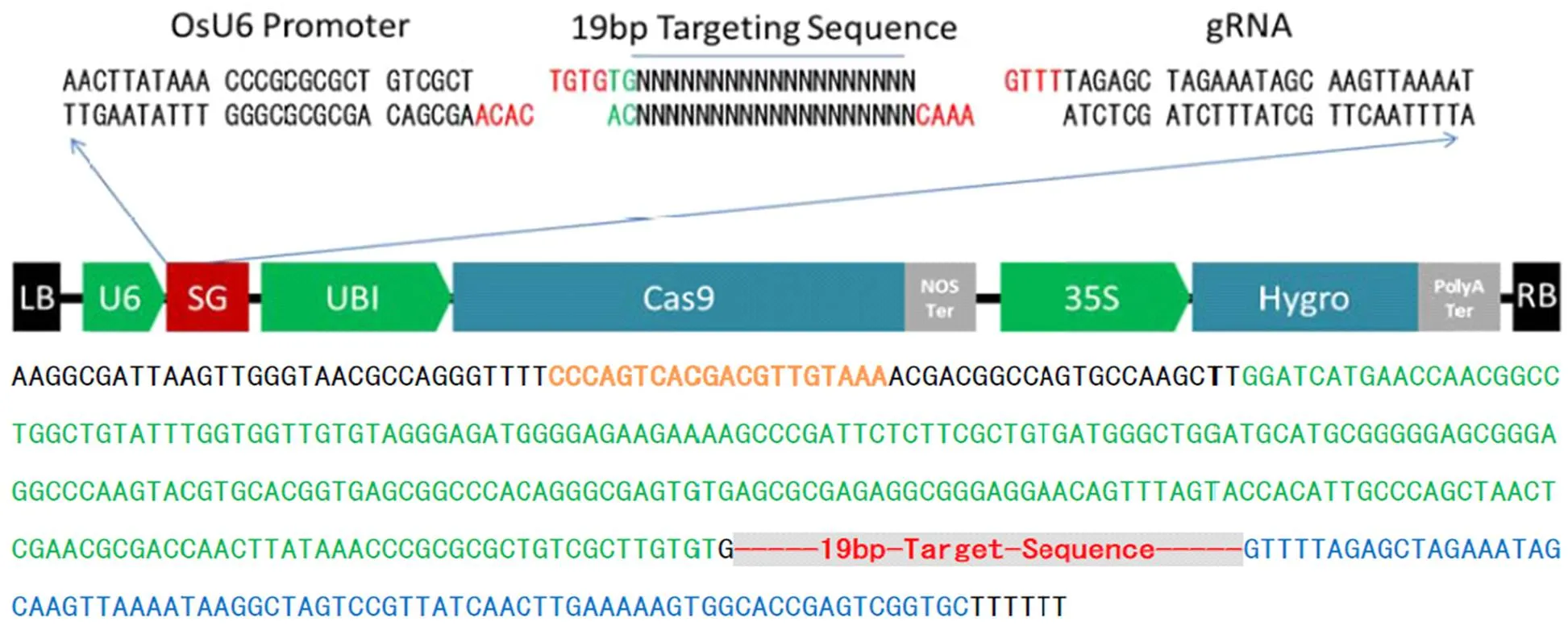
LB:載體左邊界;U6:水稻OsU6啟動子;SG:向導RNA;UBI:UBI啟動子;Cas9:Cas9蛋白;Nos Ter:Nos終止子;35S:35S啟動子;Hygro:潮霉素基因;Poly A Ter:PolyA終止子;RB:載體右邊界
1.3 基因編輯株系的靶點分析與鑒定
經過驗證的質粒載體轉化到農桿菌感受態細胞EHA105中,浸染并轉化嘉58與秀水134愈傷組織,通過潮霉素篩選獲得轉基因再生植株。水稻葉片基因組DNA由CTAB法提取,利用引物(-F與-R,表1)和引物(-F與-R)通過PCR鑒定陽性轉基因植株。PCR反應體系(20 μL)為2.0×PCR Buffer 10 μL、上下游引物各0.5 μL、DNA 2 μL和H2O 7 μL。PCR反應程序為95℃ 3min;95℃ 30 s,60℃ 30 s,72℃ 30 s,35個循環;72℃ 5 min。PCR反應產物于1.5%瓊脂糖凝膠電泳后于紫外燈下拍照。根據陽性轉基因植株靶點特性,分別以exon2和exon7的引物,利用高保真KOD Fx酶擴增靶點相鄰序列。PCR反應體系(20 μL)為2.0×Kod Fx buffer 10 μL、dNTP(2 mmol·L-1)2 μL、引物各0.5 μL、Kod Fx 0.5 μL、DNA 2 μL和H2O 4.5 μL。PCR反應程序為95℃ 3min;95℃ 30 s,60 ℃ 30 s,68℃ 30 s,35個循環;68℃ 5 min。PCR反應產物于1.5%瓊脂糖凝膠電泳,割膠回收后測序,根據測序結果分析轉基因T0代植株靶點的突變類型。

表1 本研究所用各種引物及序列
1.4 稻米香味2-AP含量測定
分別取基因編輯植株和對照的成熟種子30 g,去殼并將糙米碾磨成米粉后測定香味物質2-乙酰-1-吡咯啉(2-AP)含量。以2,4,6-三甲基吡啶作為內標(濃度229.25 ng·ml-1),每次稱取400 mg米粉樣品,重復3次,置于10 ml細口玻璃瓶,加入0.8 ml含有內標的乙醇浸提試劑于80℃烘箱中浸提3 h,取出靜置至室溫,利用0.22 μm的一次性針頭過濾膜過濾,取150 μl于內襯管中后放入2 ml樣品瓶,使用GC-MS氣相色譜質譜聯用儀(日本島津公司)測定,檢測數據由Excel 2010和SPSS17.0軟件進行分析。
2 結果
2.1 基因編輯表達載體的構建
以日本晴DNA序列為模板序列,分別以水稻()的第2和第7外顯子為靶點,結合https://crispr.cos.uni-heidelberg.de/index. html在線分析工具,通過Blast序列比對,分別設計了20和19 bp保守的特異序列,通過制備Oligo二聚體后,將其構建到CRISPR/Cas9表達載體(圖2)。構建好的質粒載體利用引物SG-SR3和PUV4-R進行PCR擴增,PCR產物經測序后確認sgRNA序列已構建到表達載體中,將其轉化到農桿菌感受態EHA105后進行遺傳轉化。
2.2 轉基因株系Badh2突變特性分析
利用農桿菌介導的水稻轉基因法,轉化嘉58和秀水134的愈傷組織,通過潮霉素選擇分別獲得26株和18株獨立的轉化株系。為鑒定轉基因株系在第2和第7外顯子的突變情況,分別以-F和-R引物對與-F和-R引物對,利用高保真酶KOD Fx對的靶點相鄰序列進行PCR擴增并測序。結果顯示,26株嘉58轉基因株系在第2外顯子處共有10株,其中無突變2株,8株轉基因突變株系有5種不同的突變方式,均為不同單堿基插入不同突變位點;第7外顯子處的轉基因株系共有16株,其中9株未發生突變,7株轉基因株系發生5種突變方式,均為片段或堿基缺失(圖2)。因此,共獲得嘉58基因編輯株系15株。18株秀水134的轉基因株系在第2外顯子處共有8株,其中3株無突變,5株均為單堿基插入;在第7外顯子處有10株,其中4株無突變,6株均為片段缺失(圖2)。因此,共獲得秀水134基因編輯株系11株。
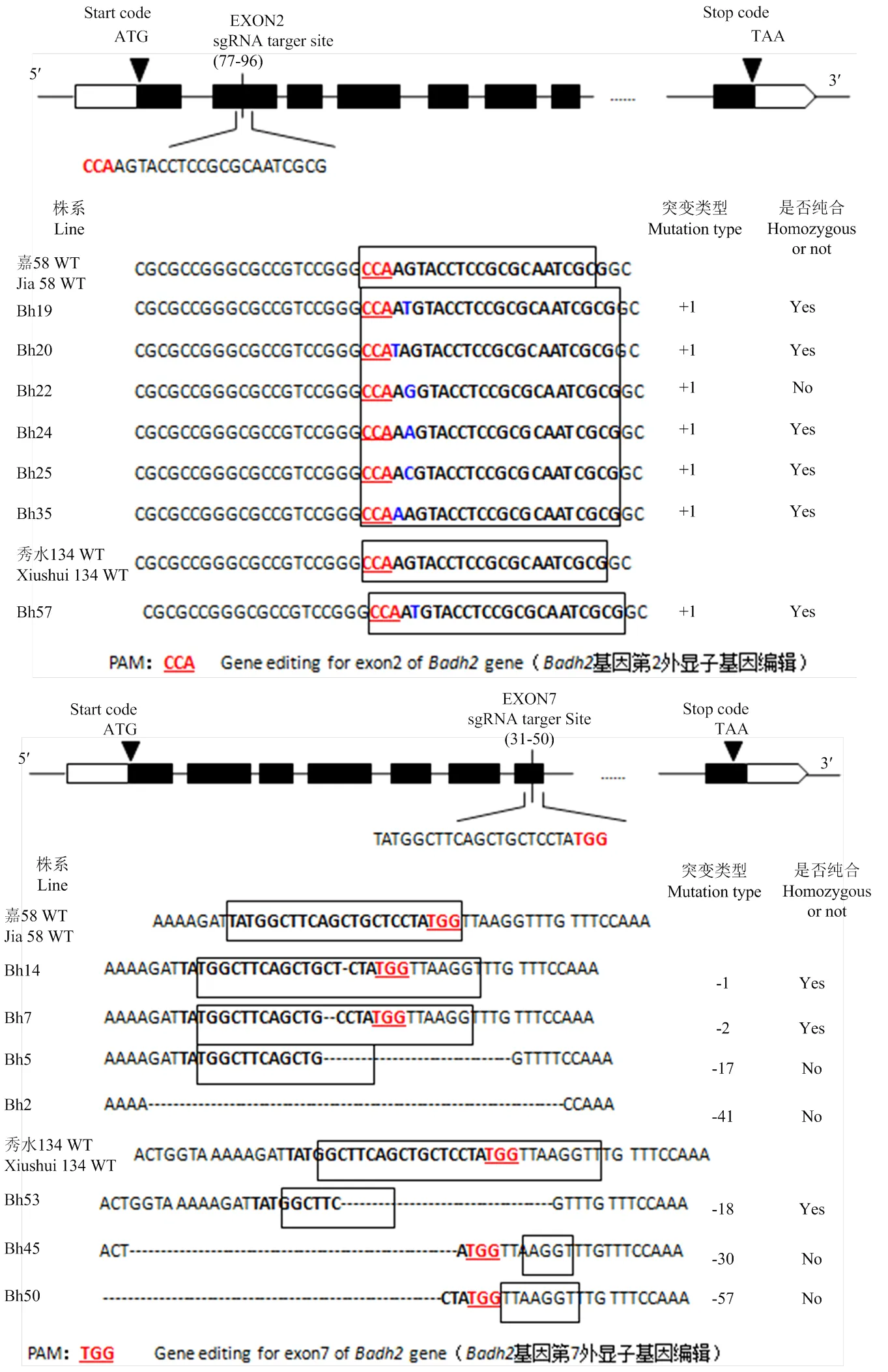
Start code:起始密碼子;Stop code:終止密碼子;Exon2:第2外顯子;Exon7:第7外顯子;sgRNA target site:sgRNA靶點。方框表示靶標序列,紅色下劃線字體表示PAM序列,藍色字體表示插入堿基,橫線表示缺失堿基,+表示堿基插入,-表示堿基缺失The box represented target sequence. The red words with the underline represented PAM sequence. The blue words indicated the insertion base. The transverse line indicated the deletion sequences. + represented base insertion, -indicated base deletion
2.3 無標記轉基因株系鑒定
為獲得無轉基因成分的基因編輯株系,選擇秀水134基因編輯的2個T0代株系Bh57和Bh53開展進一步的分析,其中Bh57為單堿基插入造成移碼突變,Badh2蛋白翻譯提前終止;Bh53為片段缺失,其編碼的氨基酸與野生型相比缺少6個氨基酸。每個株系種植24株,提取單株基因組DNA并分別利用潮霉素選擇標記引物對與核酸酶引物對,通過PCR檢測分析其在T1代株系中的情況。結果表明,在Bh57的24個T1代單株中,共檢測到5株不含和(圖3),測序結果表明其突變特性與T0代一致;同時,在Bh53的24個T1代單株中,共檢測到11株不含和(圖3),測序結果表明其突變特性與T0代一致。因此,可以從T1代株系中分離到不含轉基因成分的基因編輯株系,而且這些株系在靶點的突變特性與其T0代一致,基因編輯的這種突變可以穩定遺傳到下一代。根據田間表現,從2個T1代株系中各選擇2個單株進行繁殖,分別命名為Bh1、Bh2、Bh3和Bh4。
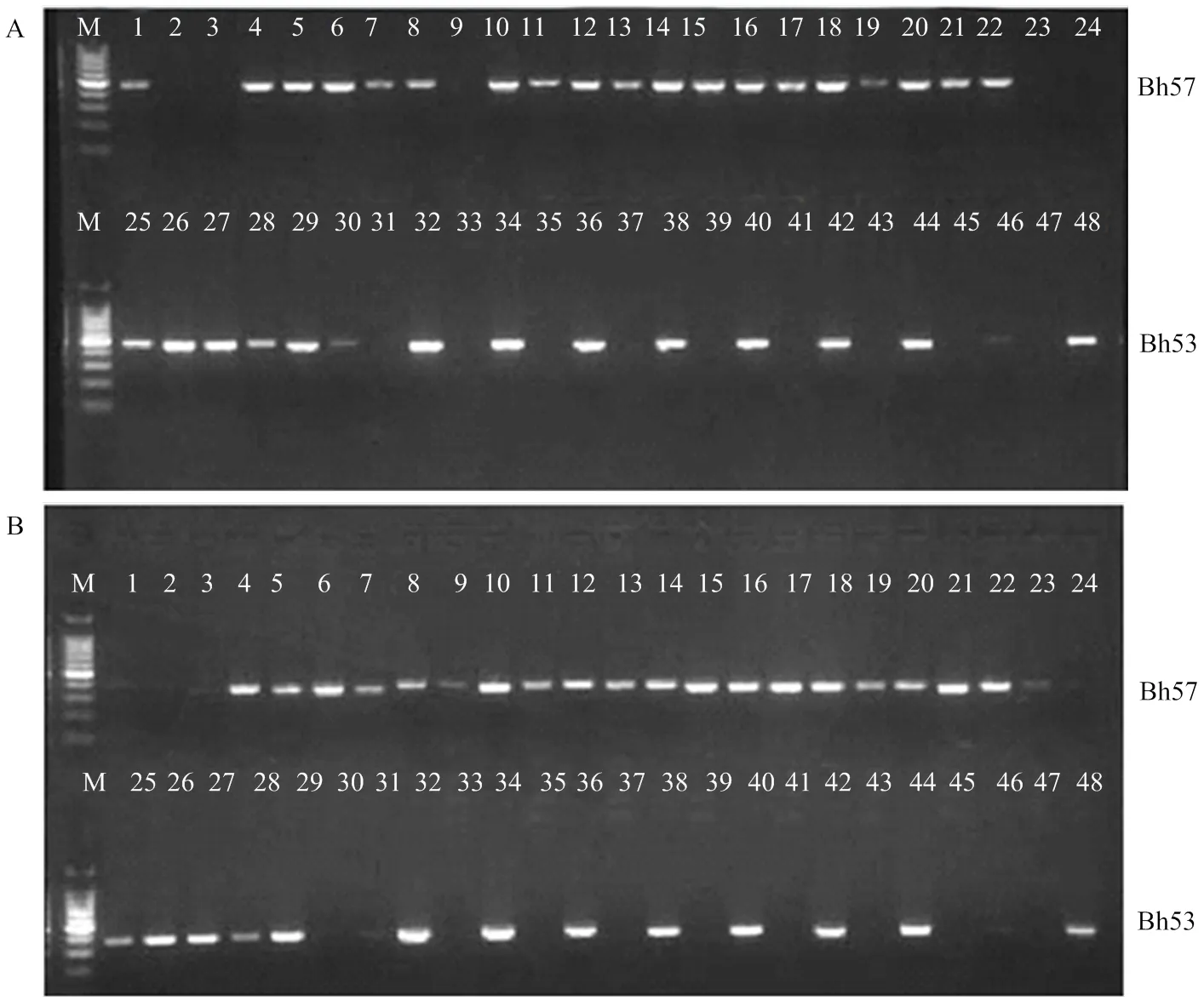
圖3 T1代基因編輯株系中潮霉素Hpt(A)與核酸酶Cas9(B)的PCR檢測
2.4 基因編輯株系中香味物質2-AP的含量檢測
為檢測基因編輯株系中香味物質2-AP的含量,分別選擇并收獲4個T2代基因編輯株系Bh1、Bh2、Bh3和Bh4的成熟種子,去殼后碾磨成糙米米粉,利用GC-MS氣相色譜質譜聯用儀測定,其中,Bh1與Bh2為單堿基插入后導致移碼突變,Bh3與Bh4為18 bp片段缺失即為缺失突變。2-AP含量檢測結果顯示,所有基因編輯株系的2-AP含量均極顯著(<0.01)高于野生型對照品種(0.046 μg·g-1),其中Bh2的2-AP平均含量最高,達0.347 μg·g-1,Bh3與Bh1的2-AP平均含量分別為0.332和0.309 μg·g-1,Bh4的2-AP平均含量最低為0.295 μg·g-1,而野生型對照的2-AP平均含量僅為0.046 μg·g-1(圖4)。因此,利用基因編輯技術使水稻發生突變,可獲得香味性狀得到改良的香型材料。
3 討論
香味是影響稻米品質的一個重要性狀,是水稻品質改良的主要研究目標。香米的種植與選育具有悠久的歷史,國外有著名的印度巴斯馬蒂型香米、泰國的茉莉花香型、日本的宮香、美國的Jasmine85和Della都以其獨特的香味、優良的米質享譽世界[23-24]。中國的香米種植也具有悠久的歷史,主要有東北的稻花香,云南的螃蟹谷,廣西靖西香糯等香米稻種資源[25],但是這些品種不僅具有獨特的地理區域特性,而且產量、抗倒伏、抗病性等亟需改良[26]。目前,傳統育種仍以雜交、回交等方式將香味性狀導入目標品種,但由于香味成分檢測繁雜,傳統的檢測方法主觀性較強,準確性有待提高,難以大規模利用。因此,利用傳統的育種技術改良稻米香味性狀仍然受到各種因素的制約。
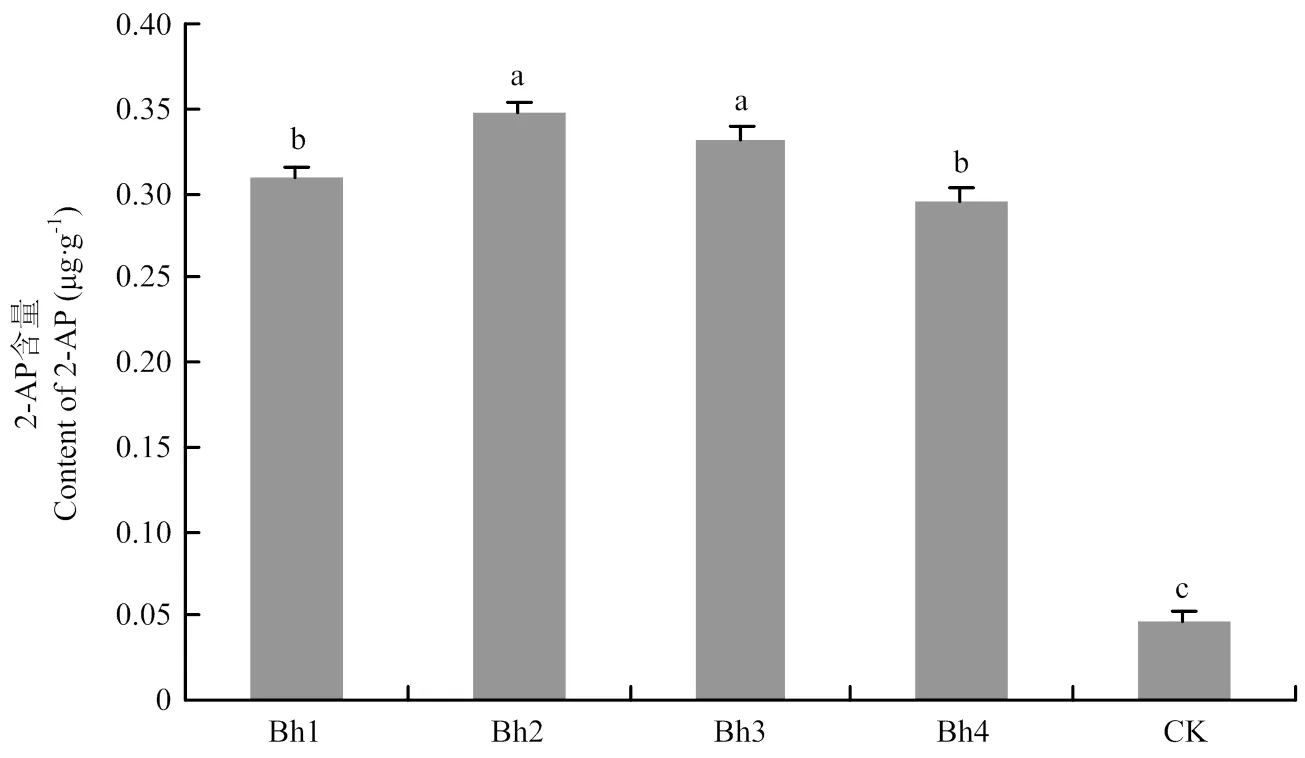
不同字母表示不同株系在0.01水平上差異極顯著
隨著生物技術的發展,尤其是香味基因的克隆[4],分子標記輔助選擇[13-15]、RNAi[16]、基因編輯[21-22]等技術的不斷成熟,通過香味基因的定向改良提高香味品質顯得更為高效。前人研究表明,是控制稻米香味的一個重要基因,通過生物技術方法使發生突變,從而獲得定向改良的香味資源用于育種利用。但是,通過基因編輯獲得的香型水稻材料均以模式品種日本晴、中花11等為轉化受體,其本身農藝性狀與推廣品種相比具有一定的差距,難以在生產上直接利用,通過基因編輯獲得的香型材料仍需通過雜交、回交等傳統技術導入推廣品種才能得以在生產上利用。因此,其應用受到一定的限制。本研究利用CRISPR/Cas9基因編輯技術,以浙江省主要推廣的水稻品種嘉58與秀水134為改良目標,通過的定向編輯,獲得不同類型的轉基因突變株系,經PCR分析結合測序鑒定,可在轉基因后代中分離到無轉基因標記的純合株系,而且其突變特性可穩定遺傳給后代,2-AP含量的檢測結果表明,這些轉基因株系的香味成分均顯著高于對照秀水134,其香味性狀得到明顯改良。同時,秀水134與嘉58為浙江省主要推廣的粳稻品種,其本身農藝性狀優良,基因編輯后代株系具有潛在的應用價值。
CRISPR/Cas9技術是目前應用最為廣泛的基因編輯技術,其Cas9蛋白主要由RECⅠ、RECⅡ、Bridge helix、HNH、RuvC,PAM-Interacting等功能域組成,其中RECⅠ負責與向導RNA的結合,HNH和RuvC主要負責單鏈DNA的切割[27-28]。隨著Cas9蛋白密碼子的優化,編輯效率得到了大幅提升,Cas9核酸酶一般在PAM序列下游第3個堿基開始切割雙鏈DNA,在切割與修復的過程中產生突變[29-30]。本研究利用優化的Cas9蛋白將水稻第2和第7外顯子作為靶標序列進行基因編輯。測序結果顯示,不同靶點產生的突變類型各不相同,不僅有單堿基插入,還有堿基缺失,甚至大片段缺失,其在靶點的突變仍具不可預測性。但不管是堿基插入造成的移碼突變還是片段缺失造成的缺失突變,這種突變均能在后代株系中穩定遺傳,并且其米粉中的2-AP含量顯著高于對照,因此,在改良稻米香味性狀方面仍有效。此外,CRISPR/Cas9基因編輯技術仍存在脫靶等缺陷[31-32],組織培養過程中也存在自然突變的可能。因此,基因編輯株系在香味性狀得到改良的前提下,其潛在的突變等仍需要做進一步的分析,從而為優良香型水稻材料的創制提供重要的種質資源。
4 結論
利用CRISPR/Cas9基因編輯技術,可對水稻香味基因第2和第7外顯子進行定向突變,且這種突變能夠穩定遺傳給后代。無標記基因編輯株系稻米中香味成分2-AP含量極顯著高于對照秀水134,通過基因編輯可實現對稻米香味性狀的定向改良。
[1] Yajima I, Yanai T, Nakamura M, Sakakibara H, Habu T. Volatile flavor components of cooked rice kaorimai (scented rice,.)., 1979, 43: 2425-2429.
[2] Buttery R G, Ling L C, Juliano B O, Turnbaugh J G. Cooked rice aroma and 2-acetyl-1-pyrroline., 1983, 31: 823-826.
[3] Li Q L, Gao X R, Yu X H, Wang X Z, An L J. Molecular cloning and characterization of betaine aldehyde dehydrogenase gene fromand its use in improved tolerance to salinity in transgenic tobacco., 2003, 25(17): 1431-1436.
[4] Chen S, Yang Y, Shi W, Ji Q, He F, Zhang Z, Cheng Z, Liu X, Xu M., encoding betaine aldehyde dehydrogenase, inhibits the biosynthesis of 2-acetyl-1-pyrroline, a major component in rice fragrance., 2008, 20(7): 1850-1861.
[5] Bradbury L M, Fitzgerald T L, Henry R J, Jin Q, Waters D L. The gene for fragrance in rice., 2005, 3(3):363-370.
[6] Sakthivel K, Sundaram R M, Shobha Rani N, Balachandran S M, Neeraja C N. Genetic and molecular basis of fragrance in rice., 2009, 27(4): 468-473.
[7] Okpala N E, Mo Z, Duan M, Tang X. The genetics and biosynthesis of 2-acetyl-1-pyrroline in fragrant rice., 2019, 135: 272-276.
[8] 余亞瑩, 邵高能, 圣忠華, 蔣漢偉, 賀記外, 孫園園, 蔡怡聰, 胡培松,唐紹清. 國內外香稻資源遺傳多樣性研究. 植物分類與資源學報, 2015, 37(6): 871-880.
YU Y Y, SHAO G N, SHENG Z H, JIANG H W, HE J W, SUN Y Y, CAI Y C, HU P S, TANG S Q. Genetic diversity of global aromatic rice varieties., 2015, 37(6): 871-880. (in Chinese)
[9] Shao G, Tang S, Chen M, Wei X, He J, Luo J, Jiao G, Hu Y, Xie L, Hu P. Haplotype variation at, the gene determining fragrance in rice., 2013, 101(2): 157-162.
[10] 張江麗, 李蘇潔, 李娟, 普世皇, 普玉嬌, 張亮, 譚亞玲, 陳麗娟, 譚學林, 金壽林, 文建成. 不同來源水稻種質資源香味基因位點的鑒定. 分子植物育種, 2015, 13(4): 727-733.
Zhang J l, Li S j, Li J, Pu S H, Pu Y j, Zhang L, Tan Y l, Chen L j, Tan X l, Jin S l, Wen J c. Identification of the fragrant genelocus in rice germplasm resources original from different area., 2015, 13(4): 727-733. (in Chinese)
[11] Sood B C, Siddiq E A. A rapid technique for scent determination in rice., 38 (1978): 268-271.
[12] Lorieux M, Petrov M, Huang N, Guiderdoni E, Ghesquière A. Aroma in rice: genetic analysis of a quantitative trait., 1996, 93(7): 1145-1151.
[13] Jin Q S, Waters D, Cordeiro G M, Henry R J, Reinke R F. A single nucleotide polymorphism (SNP) marker linked to the fragrance gene in rice (L.)., 2003, 165: 359-364.
[14] Masouleh A K, Waters D L, Reinke R F, Henry R J. A high-throughput assay for rapid and simultaneous analysis of perfect markers for important quality and agronomic traits in rice using multiplexed MALDI-TOF mass spectrometry., 2009, 7(4): 355-363.
[15] 陸艷婷, 劉慶龍, 王俊敏, 嚴文潮, 俞法明, 金慶生. 利用等位基因特異擴增快速檢測水稻香味基因. 作物學報, 2008, 34(2): 243-246.
LU Y T, LIU Q L, WANG J M, YAN W C, YU F M, JIN Q S. Detection of rice fragrant gene by allele-specific amplification., 2008, 34(2): 243-246. (in Chinese)
[16] Niu X, Tang W, Huang W, Ren G, Wang Q, Luo D, Xiao Y, Yang S, Wang F, Lu BR, Gao F, Lu T, Liu Y. RNAi-directed downregulation ofresults in aroma (2-acetyl-1-pyrroline) production in rice (L.)., 2008, 8: 100.
[17] Chen M L, Wei X J, Shao G N, Tang S Q, Luo J, Hu P S. Fragrance of the rice grain achieved via artificial microRNA-induced down-regulation of., 2012, 131: 584-590.
[18] Shan Q, Wang Y, Chen K, Liang Z, Li J, Zhang Y, Zhang K, Liu J, Voytas D F, Zheng X, Zhang Y, Gao C. Rapid and efficient gene modification in rice andusing TALENs., 2013, 6: 1365-1368.
[19] Cantos C, Francisco P, Trijatmiko K R, Slamet- Loedin I, Chadha-Mohanty P K. Identification of "safe harbor" loci in indica rice genome by harnessing the property of zinc-finger nucleases to induce DNA damage and repair., 2014, 26; 5: 302.
[20] Liang Z, Zhang K, Chen K, Gao C. Targeted mutagenesis inusing TALENs and the CRISPR/Cas system., 2014, 41: 63-68.
[21] Shan Q, Zhang Y, Chen K, Zhang K, Gao C. Creation of fragrant rice by targeted knockout of thegene using TALEN technology., 2015, 13(6): 791-800.
[22] 邵高能, 謝黎虹, 焦桂愛, 魏祥進, 圣忠華, 唐紹清, 胡培松. 利用CRISPR/CAS9技術編輯水稻香味基因. 中國水稻科學, 2017, 31(2): 216-222.
SHAO G N, XIE L H, JIAO G A, WEI X J, SHENG Z H, TANG S Q, HU P S. CRISPR/CAS9-mediated editing of the fragrant gene, 2017, 31(2): 216-222. (in Chinese)
[23] Jain S, Jain R K, Mccouch S R. Genetic analysis of Indian aromatic and quality rice (L.) germplasm using panels of fluorescently-labeled microsatellite markers., 2004, 109(5): 965-977.
[24] Pachauri V, Singh M K, Singh A K. Origin and genetic diversity of aromatic rice varieties,molecular breeding and chemical and genetic basis of rice aroma., 2010, 19(2): 127-143.
[25] 鄭家團, 楊德衛, 董煉飛, 游晴如, 鄭軼, 涂詩航, 周鵬. 香型水稻的遺傳和育種現狀. 福建農業學報, 2012, 27(10): 1134-1138.
ZHENG J T, YANG D W, DONG L F, YOU Q R, ZHENG Y, TU S H, ZHOU P. Inheritance and breeding actuality of new quasi-aromatic rice (L.)., 2012, 27(10): 1134-1138. (in Chinese)
[26] 黃庭旭, 江文清, 游晴如, 周仕全, 劉端華, 謝冬容, 邱慧明. 秈型香稻恢復系大粒香-15的選育與利用. 福建農業學報, 2006, 21(2): 83-88.
Huang T X, Jiang W Q, You Q R, ZHOU S Q, LIU D H, XIE D R, QIU H M. Breeding and utilization of fragrant restoring line Dalixiang 15 ofhybrid rice., 2006, 21(2): 83-88. (in Chinese)
[27] Friedland A E, Tzur Y B, Esvelt K M, Colaiácovo M P, Church G M, Calarco J A. Heritable genome editing invia a CRISPR-Cas9 system., 2013, 10: 741-743.
[28] Xie K, Zhang J, Yang Y. Genome-wide prediction of highly specific guide RNA spacers for CRISPR-Cas9-mediated genome editing in model plants and major crops., 2014, 7: 923-926.
[29] Feng Z, Mao Y, Xu N, Zhang B, Wei P, Yang D L, Wang Z, Zhang Z, Zheng R, Yang L, Zeng L, Liu X, Zhu J K. Multigeneration analysis reveals the inheritance, specificity, and patterns of CRISPR/Cas-induced gene modifications in., 2014, 111: 4632-4637.
[30] Luo M, Gilbert B, Ayliffe M. Applications of CRISPR/Cas9 technology for targeted mutagenesis, gene replacement and stacking of genes in higher plants., 2016, 35(7): 1439-1450.
[31] Endo M, Mikami M, Toki S. Multigene knockout utilizing off-target mutations of the CRISPR/Cas9 system in rice., 2015, 56: 41-47.
[32] Pattanayak V, Lin S, Guilinger J P, Ma E, Doudna J A, Liu D R. High-throughput profiling of off-target DNA cleavage reveals RNA-programmed Cas9 nuclease specificity., 2013, 31(9): 839-843.
CRISPR/Cas9 Targeted Editing for the Fragrant Gene
Qi YongBin, Zhang LiXia, Wang LinYou, Song Jian, Wang JianJun
(Institute of Crop Science and Nuclear Technology Utilization, Zhejiang Academy of Agricultural Sciences, Hangzhou 310021)
【Objective】Rice fragrance, a very important trait for quality improvement, is mainly controlled by a recessive geneIn this study, CRISPR/Cas9-mediated editing were used to generate the gene-edited rice plants with the fragrant【Method】 The targeted sequences were designed according to the sequence of exon2 and exon7 of theby the principle of CRISPR/Cas9 gene editing. Its specificity of the targeted sequence was determined by Blast analysis, and then constructed into CRISPR/Cas9 expression vector. The callus of Jia58 and Xiushui134 which are widely cultivated in the Zhejiang Province were selected as explants to transform by-mediated genetic transformation, and the positive transgenic plants were obtained by the screening of hygromycin resistance. Sequencing analysis of transgenic lines was used to detect the presence of the mutation type on the loci of. Stable marker-free gene-edited lines carrying the mutation onwere obtained by PCR analysis and identification. The content of 2-AP in the brown rice flour were measured by GC-MS, and the difference between the gene-edited lines and non-transgenic control was determined. 【Result】of the transgenic lines was directionally mutated by the genetic transformation using the expression vector on which the target sequence of the exon2 and exon7 were designed and constructed. A total of 15 T0gene-edited lines were obtained from Jia58. Eight of them were generated mutation on the exon2 with five different mutations types in which different single base was inserted into different position. Seven of them were generated mutations on the exon7 with five different mutation types in which the base or fragment deletion was produced. A total of 11 T0gene-edited lines were obtained from Xiushui134, of which five lines were generated mutations on the exon2 with the single base insertion and six lines on the exon7 with the fragment deletion. A total of 16 marker-free gene-edited lines were obtained from 48 T1Xiushui134, of which five lines were generated mutations on the exon2, and 11 lines on the exon7. The average 2-AP content in brown rice flour of four T2gene-edited lines were 0.309, 0.347, 0.332 and 0.295 μg·g-1respectively, which were significantly higher (<0.01) than that of the non-transgenic control (0.046 μg·g-1). 【Conclusion】 Thewhich controlled the rice fragrance trait was directionally edited by using CRISPR/Cas9-mediated technology, and the marker-free gene-edited lines were obtained, of which the fragrance ofedited lines were significantly improved.
rice; CRISPR/Cas9; gene editing;; fragrance
2019-09-02;
2019-11-30
浙江省科技廳公益技術研究項目(2017C32007)、浙江省糧食新品種選育重大科技專項(2016C02050)、國家重點研發計劃“七大作物育種”重點專項(2017YFD0100302)、浙江省農業科學院人才培養項目(2018R16R08E01)
祁永斌,E-mail:qi_yongbin@hotmail.com。通信作者王建軍,E-mail:wangjj4197@163.com
(責任編輯 李莉)

