小麥、玉米兩熟秸稈還田土壤中6種有機酸對小麥紋枯病的化感作用
趙緒生,齊永志,閆翠梅,甄文超
小麥、玉米兩熟秸稈還田土壤中6種有機酸對小麥紋枯病的化感作用
趙緒生1,2,齊永志1,2,閆翠梅1,2,甄文超2,3,4
(1河北農業大學植物保護學院,河北保定 071001;2省部共建華北作物改良與調控國家重點實驗室,河北保定 071001;3河北農業大學農學院, 河北保定 071001;4河北省作物生長調控重點實驗室,河北保定 071001)
【】冬小麥、夏玉米一年兩熟是中國北方最廣泛的農作制度,中國北方小麥、玉米生產普遍采用秸稈還田的耕作方式,關于秸稈還田對小麥土傳病害的影響一直存在爭議。通過分析不同秸稈還田年限地塊耕層土壤中的主要有機酸對小麥幼苗生長、禾谷絲核菌()及紋枯病發生的化感作用,明確我國北方冬小麥、夏玉米一年兩熟種植體系下秸稈還田對小麥紋枯病發生的影響。利用GC-MS技術分析玉米秸稈還田地塊耕層土壤乙酸乙酯提取物中化學物質的種類與含量,并分別用氯化三苯基四氮唑(TTC)還原法、電導率法、氮藍四唑光化(NBT)還原法和愈創木酚比色法測定含量較高的6種有機酸對小麥幼苗根系活力、根系細胞膜透性、超氧化物歧化酶(SOD)和過氧化物酶(POD)活性的影響,用常規方法測定其對禾谷絲核菌和紋枯病發生的影響。秸稈還田地塊耕層土壤中含有機酸、烷烴、醇、酰胺及醛類等化學物質,相對含量分別為45.45%、17.70%、17.08%、6.12%和5.44%;含量較高的有機酸類物質包括鄰羥基苯甲酸(9.24%)、3-苯基-2-丙烯酸(4.12%)、對羥基苯甲酸(3.21%)、4-羥基-3,5-二甲氧基苯甲酸(2.26%)、二十一烷酸(1.88%)、4-甲氧基鄰氨基苯甲酸(1.73%)、8-十八碳烯酸(0.76%)和3-(4-羥基-3-甲氧基苯基)-2-丙烯酸(0.52%)。0.08—10.0 μg·mL-1濃度的4-甲氧基鄰氨基苯甲酸和3-(4-羥基-3-甲氧基苯基)-2-丙烯酸對禾谷絲核菌的菌絲生長(10.0 μg·mL-14-甲氧基鄰氨基苯甲酸除外)、菌絲干重和菌核數量均表現明顯促進作用,且2種物質在土壤中的含量均隨秸稈還田年限延長呈增多趨勢。0.4和0.08μg·mL-1鄰羥基苯甲酸對禾谷絲核菌的菌絲生長和菌核形成有明顯促進作用;而50.0 μg·mL-1鄰羥基苯甲酸和4-羥基-3-甲氧基-苯甲酸,以及0.4—50.0μg·mL-1苯甲酸均表現為抑制作用。在2.0—50.0 μg·mL-1濃度范圍內,隨著6種有機酸濃度的提高,其對小麥幼苗生長的抑制作用越強,對羥基苯甲酸抑制作用最強,其次是鄰羥基苯甲酸,4-甲氧基鄰氨基苯甲酸最弱。0.4—50.0 μg·mL-1濃度的3-(4-羥基-3-甲氧基苯基)-2-丙烯酸、4-甲氧基鄰氨基苯甲酸、鄰羥基苯甲酸和對羥基苯甲酸均加重小麥紋枯病發生,其中,3-(4-羥基-3-甲氧基苯基)-2-丙烯酸助長作用最強,發病率和病情指數最高增幅分別達49.0%和46.7%;而苯甲酸和4-羥基-3-甲氧基-苯甲酸對小麥紋枯病發生無顯著影響。冬小麥、夏玉米一年兩熟秸稈還田土壤中含有機酸、酯、烴、酰胺及醛類等化學物質,有機酸類物質相對含量最高。3-(4-羥基-3-甲氧基苯基)-2-丙烯酸、4-甲氧基鄰氨基苯甲酸、鄰羥基苯甲酸和對羥基苯甲酸在一定濃度下均可助長小麥紋枯病的發生,其中3-(4-羥基-3-甲氧基苯基)-2-丙烯酸助長作用最強,而苯甲酸和4-羥基-3-甲氧基-苯甲酸對紋枯病發生無明顯影響。還田秸稈在土壤中腐解產生的有機酸類物質促進病原菌生長、抑制小麥根系生理活性和生長的化感作用,可能是中國北方小麥、玉米兩熟秸稈還田條件下小麥紋枯病加重發生的主要原因之一。
秸稈還田;小麥紋枯病;禾谷絲核菌;GC-MS;化感作用;有機酸
0 引言
【研究意義】冬小麥、夏玉米一年兩熟是中國北方最廣泛的農作制度。自1990年以來,中國北方小麥-玉米一年兩熟區普遍采用秸稈還田的耕作方式,每年秸稈還田面積約1 100萬公頃。秸稈還田不僅有利于提高土壤有機質含量、調節土壤溫濕度、提高生產效率,還能減少因焚燒秸稈造成的環境污染[1-2]。但近年來發現,由禾谷絲核菌()引起的小麥紋枯病(wheat sheath blight,WSB)在長期秸稈還田地塊呈加重趨勢[3-5],已成為中國北方小麥優質、高產的重要限制因素[6-9]。據統計,近十年來,小麥紋枯病在河南、山東、河北3省麥區每年發生總面積高達150萬公頃以上,一般發病地塊減產5%—30%,嚴重地塊減產超過50%[7-9]。關于秸稈還田對小麥土傳病害的影響一直存在爭議,明確秸稈還田與當前小麥紋枯病發生加重的相關性,可為小麥紋枯病綜合防控提供參考。【前人研究進展】有研究者認為還田秸稈為小麥土傳病原菌存活、增殖營造了適宜的生態環境條件,進而提高了病原菌基數,最終導致土傳病害重發[10-12]。但是,秸稈還田也可提高土壤有機質含量,增加土壤中拮抗菌數量,增強作物抗病性,從而抑制病害發生[13-14]。Chou等[15]研究表明,腐熟稻渣中檢測出對羥基苯甲酸等5種有機物質,該類物質對水稻和萵苣種子的胚根生長有顯著抑制作用;張玉銘等[16]研究發現,在播種后第5—10天覆蓋麥秸釋放出的水溶性毒素(化感物質)對玉米幼苗生長的抑制作用最強。玉米秸稈對小麥幼苗的相克作用最強,但對大豆幼苗生長的他感相生和玉米幼苗的自感相生作用次之;小麥秸稈覆蓋后釋放的化感物質能抑制玉米株高、干重、根干重等生物指標[17]。筆者所在實驗室前期研究發現,盆栽條件下,澆灌0.12—0.48 g·mL-1的玉米秸稈腐解液,顯著加重了紋枯病發病程度;GC-MS分析發現玉米秸稈腐解物中苯甲酸衍生物和鄰苯二甲酸酯類物質相對含量較高[18]。【本研究切入點】基于小麥、玉米兩熟秸稈還田地區小麥紋枯病呈現加重趨勢的生產現實問題,以秸稈還田土壤中主要有機化學物質對小麥紋枯病的化感作用為切入點,明確秸稈還田麥區紋枯病重發機制[19-20]。【擬解決的關鍵問題】利用GC-MS技術分析不同秸稈還田年限地塊耕層土壤中的主要化學物質成分,通過模擬試驗測定相對含量較高的6種有機酸對小麥幼苗生長、禾谷絲核菌生長及紋枯病發生的化感作用,明確秸稈還田與小麥紋枯病重發的相關性,為小麥紋枯病綜合防控提供科學依據。
1 材料與方法
1.1 小麥、玉米兩熟秸稈還田土壤中有機化學物質的GC-MS分析
試驗區在河北農業大學望都試驗基地(E115°05′,N38°39′)。試驗地為壤土、肥力中等。采用小麥、玉米一年兩熟秸稈還田種植方式,每年收獲玉米后,秸稈粉碎還田,并旋耕至0—20 cm土層;小麥收獲后,秸稈粉碎還田,覆蓋于土壤表面。該地塊2008—2010年小麥紋枯病發病較重。2011—2018年,每年10月上旬播種小麥,品種為良星66(國審麥2008010),播量225 kg·hm-2,行距15 cm,播深4—5 cm。底肥施120 kg·hm-2N,135 kg·hm-2P2O5和105 kg·hm-2K2O。12月上旬灌溉一次,次年3月下旬追肥(120 kg·hm-2N)并第二次灌溉,灌溉量均為600 m3·hm-2。6月中旬播種玉米,品種為鄭單958(國審玉20000009),密度69 000株/hm2,行距60 cm。隨播種施225 kg·hm-2N,135 kg·hm-2P2O5和105 kg·hm-2K2O。播后灌水600 m3·hm-2。
分別于2012、2015和2018年小麥拔節期(紋枯病發生高峰期),每年隨機選取12個樣點,用直徑5 cm土鉆在小麥根系周圍取0—20 cm土壤,混勻過40目篩后,用四分法取200 g土壤樣品;然后用乙酸乙酯按質量體積比1﹕1萃取3次,合并萃取液,室溫下減壓濃縮至2 mL后冷干;再加入250 μL硅烷化試劑(BSTFA﹕吡啶=5﹕1),并在80℃水浴2 h,得耕層土壤提取液;提取液經0.45 μm濾膜過濾后利用質譜聯機(Agilent 7890A/5975C GCMS,USA)進行分析[18]。
色譜分析條件:毛細管柱(HP-5,Crosslinked 5% pH ME Siloxanle,30 m×0.25 mm×0.25 μm)進樣口溫度250℃;程序升溫:柱溫50℃(2 min),以6℃·min-1程序升溫至250℃(保持15 min);載氣:He;流速:1.0 ml·min-1。質譜條件:EI源(電子轟擊源);轟擊電壓70 eV;掃描范圍m/z:30—600;掃描速度0.2 s掃全程;離子源溫度:200℃;四極桿溫度:150℃。
1.2 6種有機酸對禾谷絲核菌的化感效應測定
根據1.1中所測主要有機酸及其含量,選取4-甲氧基鄰氨基苯甲酸、3-(4-羥基-3-甲氧基苯基)-2-丙烯酸、4-羥基-3-甲氧基-苯甲酸、鄰羥基苯甲酸、苯甲酸和對羥基苯甲酸6種有機酸(購自Sigma公司),分別定量稱取,用無菌水充分溶解后配制成500 μg·mL-1母液;母液用無菌水依次稀釋至100、20、4和0.8 μg·mL-1,再經0.22 μm濾膜過濾;取6 mL濾液加入含有54 mL 50℃ PDA培養基的三角瓶中,搖勻得含有機酸分別為50.0、10.0、2.0、0.4和0.08 μg·mL-1的培養基,并倒入直徑為9 cm培養皿中,每皿15 mL,以加入等體積無菌水為對照,每種有機酸每濃度4次重復,每重復4皿。
無菌條件下,分別在已培養3 d的禾谷絲核菌(RHD1205,河北農業大學植物病害生態學研究室提供)菌落邊緣打制直徑0.5 cm菌餅,將菌餅轉接到上述含不同有機酸、鋪有無菌玻璃紙的培養基上,25℃黑暗倒置培養。在菌落未長滿培養皿前,采用十字交叉法測量各處理菌落直徑;黑暗培養21 d后統計每皿禾谷絲核菌形成菌核數量,并于80℃條件下烘干至恒重;用無菌鑷子將菌絲從玻璃紙上刮下,稱其鮮重后放入80℃鼓風干燥箱中烘至恒重稱量。
1.3 6種有機酸對小麥幼苗生長及其根系生理指標的化感效應測定
采集農田土壤,類型為壤土,有機質為1.34%,全氮、速效磷和速效鉀含量分別88.6、12.5和48.7 mg·kg-1,pH 6.8,自然陰涼處風干并過40目篩;再經121℃濕熱滅菌3次(60 min/次),室溫晾干后分別取3 kg壤土置于20 cm×20 cm×25 cm的營養缽中。每缽播種50粒表面經1% HgCl2消毒(5 min)[12]的小麥種子,品種為良星66(國審麥2008010)。分別用50.0、10.0、2.0、0.4和0.08 μg·mL-1濃度的6種有機酸稀釋液均勻澆灌,每缽300 mL,以澆灌等體積無菌水為對照。每處理3次重復,每重復4缽。自然條件下培養50 d后,測定各處理小麥根數、根長和根系干鮮重,每濃度處理各測2缽,共6缽;取每濃度處理剩余6缽小麥根系,分別用2,3,5-三苯基氯化四氮唑(TTC)還原法、電導率法、氮藍四唑光化還原法和愈創木酚比色法測定小麥幼苗根系活力、根系細胞膜透性、超氧化物歧化酶(SOD)和過氧化物酶(POD)活性[21-22]。
1.4 6種有機酸對小麥紋枯病發生的影響測定
分別將禾谷絲核菌RHD1205接種到PDA培養基上,在菌落外緣打取直徑為0.5 cm菌餅,并接種至含有200 g無菌煮熟麥粒的500 mL三角瓶中,每瓶接種20個菌餅。25℃黑暗培養40 d后,搖勻得帶菌的麥粒接種體。
稱取90 g接菌種體接種到滅菌壤土中并充分混勻,分別播種3個小麥品種(良星66,國審麥2008010;石新828,冀審麥2013012;邯6172,國審麥2003036,均為感病品種),然后每缽澆灌不同濃度有機酸稀釋液300 mL,播種、培養方法同上。以澆灌等體積無菌水為對照,每品種每濃度處理3次重復,每重復3缽。培養50 d后,調查小麥紋枯病發病率和病情指數[18]。
1.5 數據統計分析
采用SPSS13.0軟件的新復極差法(Duncan’s multiple range test)進行方差分析。參照Williamson等[23]的方法,采用化感效應系數()進行化感效應分析,當T≥C時,=1-C/T;當T<C時,=T/C-1。式中,C為對照值,T為處理值。當≥0時,為促進作用;當<0時,為抑制作用,絕對值的大小與作用強度一致。
2 結果
2.1 小麥、玉米兩熟秸稈還田土壤乙酸乙酯提取物中主要有機化學物質
利用GC/MS對土壤乙酸乙酯提取物中主要有機化學物質成分進行分析,2012、2015和2018年檢測結果如表1、表2所示,在土壤乙酸乙酯提取物中,有機酸類物質含量均相對最高,平均占總鑒定物質的45.45%;其次是烷烴類、醇類和酰胺類,分別占17.70%、17.08%和6.12%;醛類、酯類相對含量較低,各占5.44%和3.01%。2012年土壤中檢測到萘類、烯烴類,但2015年和2018年未檢測到。2018年檢測到安自香酸鹽類物質,但2012年和2015年均未檢測到。
檢測到的有機酸類物質中,主要包含鄰羥基苯甲酸(9.24%)、3-苯基-2-丙烯酸(4.12%)、對羥基苯甲酸(3.21%)、4-羥基-3,5-二甲氧基苯甲酸(2.26%)、二十一烷酸(1.88%)、4-甲氧基鄰氨基苯甲酸(1.73%)、8-十八碳烯酸(0.76%)和3-(4-羥基-3-甲氧基苯基)-2-丙烯酸(0.52%)。其他類化學物質中,三十四烷、鄰苯二甲酸二丁酯、甲酸癸酯、N-乙基乙酰胺、3,5-二甲基苯甲醛和2-甲基戊基-鄰苯二甲酸異二丁酯等相對含量較高。對比2012、2015和2018年3次檢測結果發現,隨著秸稈還田時間的延長,麥田耕層土壤中鄰羥基苯甲酸、4-羥基-3,5-二甲氧基苯甲酸、3-苯基-2-丙烯酸、9-十六碳烯酸和3-(4-羥基-3-甲氧基苯基)-2-丙烯酸等相對含量均呈增加趨勢。

表1 不同年度土壤乙酸乙酯提取物中檢測出的有機物質
a:化合物在色譜柱中的保留時間Retention time of compounds in the column;b:三甲基硅衍生物Identified as a trimethylsilyation (TMS) derivative;c:色譜峰面積,以百分數表示Area of peak in the chromatogram expressed as a percentage;“-”:含量低未檢測出The content was too low and couldn’t be detected

表2 不同年度土壤乙酸乙酯提取物中檢測出的各類有機物質所占比例
“-”:含量低未檢測出The content was too low and couldn’t be detected
2.2 6種有機酸對禾谷絲核菌的作用
6種有機酸中除苯甲酸外,其他有機酸對禾谷絲核菌菌絲生長、菌絲干重和菌核形成均表現低濃度促進、高濃度抑制的作用,但不同種類有機酸對上述指標影響程度差異明顯(表3)。其中,0.08—10.0 μg·mL-1濃度的4-甲氧基鄰氨基苯甲酸和3-(4-羥基-3-甲氧基苯基)-2-丙烯酸對禾谷絲核菌的菌絲生長(10.0 μg·mL-14-甲氧基鄰氨基苯甲酸除外)、菌絲干重和菌核數量均表現明顯促進作用,在0.03—0.23。而50.0 μg·mL-1濃度的4-羥基-3-甲氧基-苯甲酸能抑制禾谷絲核菌菌絲生長,降低菌絲干重、菌核干重和菌核數量,分別為-0.11、-0.14、-0.13和-0.17,其他濃度均無顯著作用。
0.4和0.08 μg·mL-1鄰羥基苯甲酸均明顯促進了禾谷絲核菌的菌絲生長,提高了菌絲干重,最高達0.21;而50.0 μg·mL-1濃度處理對菌落直徑、菌核數量和菌核干重均表現明顯抑制作用,分別為-0.11、-0.10和-0.05。苯甲酸在測試濃度>0.4 μg·mL-1的所有處理對禾谷絲核菌的菌絲生長、菌絲干重、菌核數量和菌核干重均表現明顯抑制作用,且抑制作用隨濃度增高逐漸增強,最高為-0.26。>2.0 μg·mL-1處理的對羥基苯甲酸對禾谷絲核菌的菌核數量、菌核干重也均表現明顯抑制作用,在-0.16—-0.01,而≤0.4 μg·mL-1濃度的處理對羥基苯甲酸對菌絲生長無顯著作用。
2.3 6種有機酸對小麥幼苗生長的影響
6種有機酸對小麥幼苗生長影響的測定結果如表4所示,除0.4和0.08 μg·mL-14-甲氧基鄰氨基苯甲酸外,隨著6種有機酸濃度的增高,其對小麥幼苗生長的抑制作用增強。對羥基苯甲酸抑制作用最強,50 μg·mL-1濃度處理的種子萌發率為0;其次是鄰羥基苯甲酸,50 μg·mL-1濃度處理后小麥根系鮮重僅為0.1 g,地上部單株鮮重不足0.05 g;4-甲氧基鄰氨基苯甲酸抑制作用最弱,最高濃度處理對小麥單株根數、根長、根系鮮重和地上部鮮重的分別為-0.28、-0.58、-0.45和-0.30。
2.4 6種有機酸對小麥幼苗根系生理活性的作用
6種有機酸對小麥根系生理活性的作用測定結果表明,所有供試濃度鄰羥基苯甲酸和對羥基苯甲酸均顯著降低了小麥根系活力,降幅分別在10.7—99.5和8.6—99.5 μg·g-1·h-1;除最低濃度外,4-甲氧基鄰氨基苯甲酸、3-(4-羥基-3-甲氧基苯基)-2-丙烯酸、4-羥基-3-甲氧基-苯甲酸和苯甲酸各濃度處理的小麥根系活力也均明顯降低。6種有機酸較高濃度處理均顯著增大了根系相對電導率,而0.4 μg·mL-1濃度處理下根系相對電導率均無顯著變化。2.0—50.0 μg·mL-1濃度的4-甲氧基鄰氨基苯甲酸、3-(4-羥基-3-甲氧基苯基)-2-丙烯酸、4-羥基-3-甲氧基-苯甲酸、鄰羥基苯甲酸和對羥基苯甲酸均顯著抑制了小麥根系SOD和POD活性,降幅為10.8%—87.5%;而0.08和0.4 μg·mL-1濃度處理對這2種酶活性無明顯作用。除0.08 μg·mL-1濃度處理外,其他濃度苯甲酸對小麥根系SOD和POD活性具有顯著抑制作用(表5)。
2.5 6種有機酸對小麥紋枯病發生的作用
室內盆栽試驗表明6種有機酸對小麥紋枯病發生的影響有所不同(表6),苯甲酸和4-羥基-3-甲氧基-苯甲酸各濃度處理均未影響小麥品種良星66、石新 828和邯6172紋枯病的發生程度。除0.08 μg·mL-1處理外,其他3-(4-羥基-3-甲氧基苯基)-2-丙烯酸的濃度處理均顯著增強3個小麥品種紋枯病發生程度。2.0—50.0 μg·mL-1濃度的4-甲氧基鄰氨基苯甲酸也明顯加重了3個小麥品種紋枯病發生程度。鄰羥基苯甲酸和對羥基苯甲酸的各濃度處理均加重了紋枯病發生,3個小麥品種發病率和病情指數平均增幅均超過9.0%。

表3 6種有機酸對禾谷絲核菌菌絲生長和菌核形成的影響
表中值為每組重復的平均值;同列數據后不同字母表示處理間差異顯著(<0.05)。下同
Values in the table are the mean of each group of replicates; Different letters in the same column after the data indicate significant difference among treatments at<0.05 level. The same as below
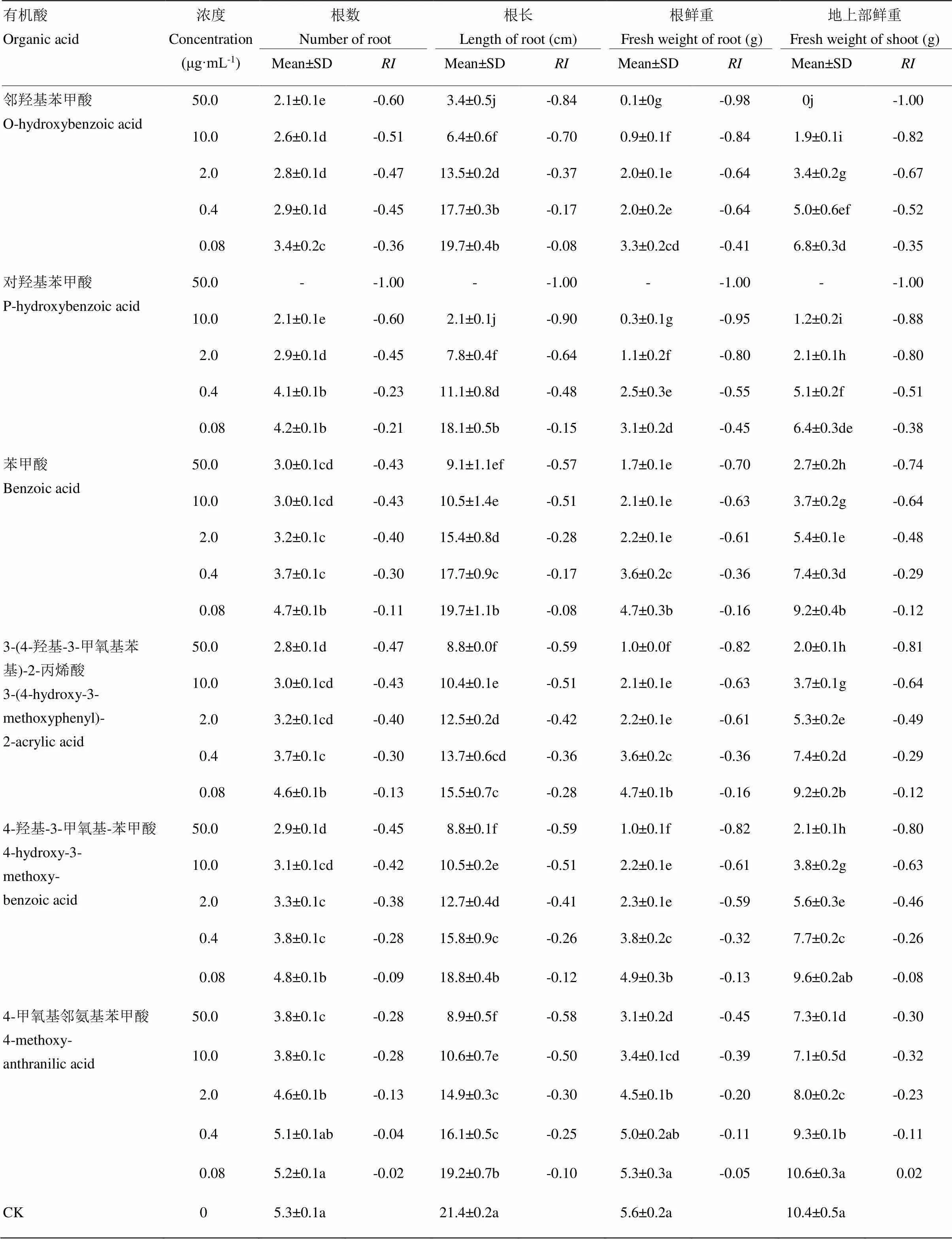
表4 6種有機酸對小麥幼苗生長的作用
“-”:該值無法測量The value couldn’t be measured
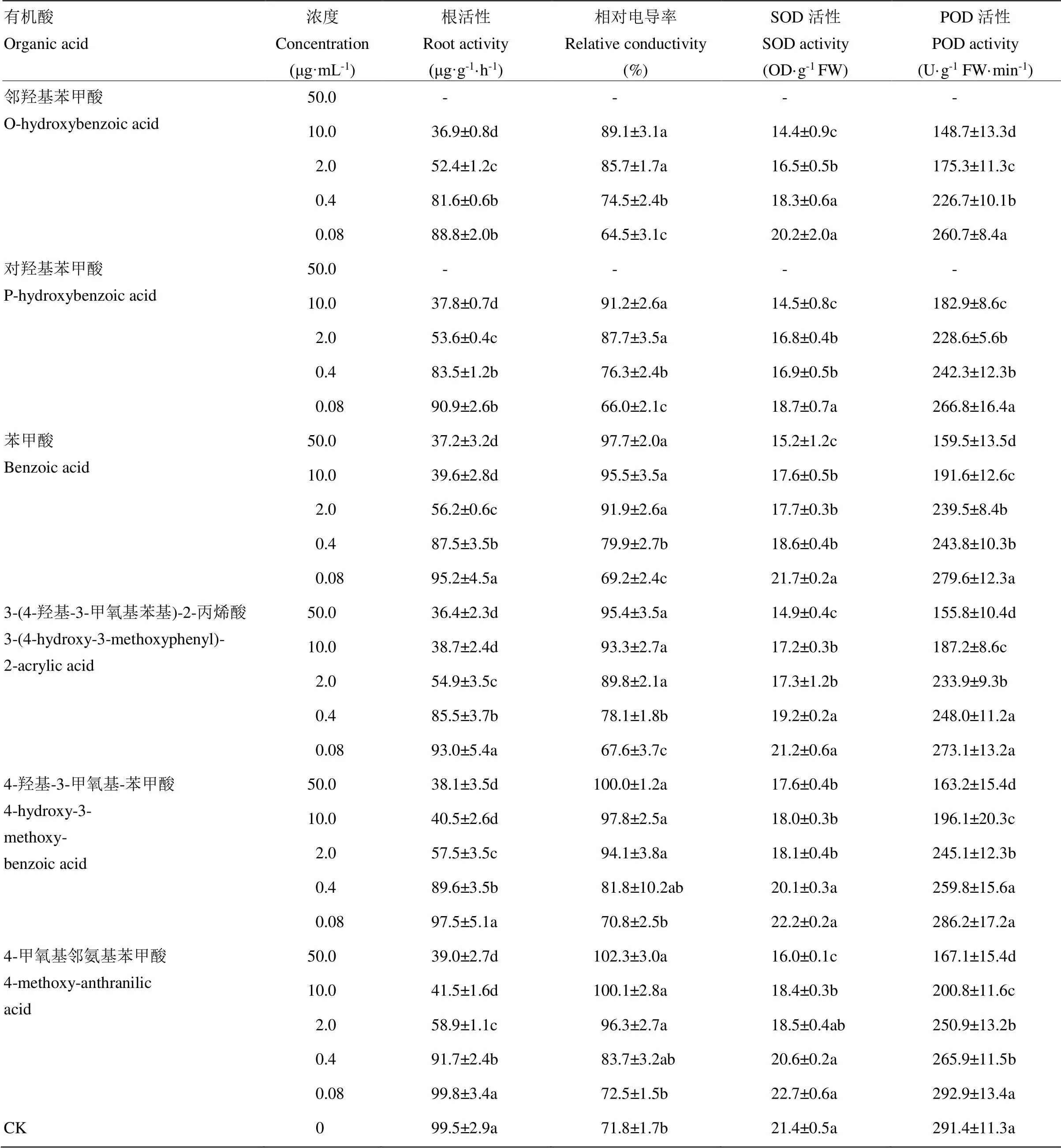
表5 6種有機酸對小麥幼苗根系生理活性的影響
“-”:根太少或沒有根The root was too few or no root
3 討論
3.1 秸稈還田后在土壤中分解產生的化感物質種類
有研究表明,田菁不同濃度秸稈提取液對水稻幼苗地上部和根系生長均表現出明顯的抑制作用[24];麥秸分解液中可分離出含量相對較高的丁香酰甘油9-O--D-吡喃葡萄糖甙和L-色氨酸,兩者在一定濃度下均能抑制萵苣和水芹的根系生長[25];黃瓜、碗豆和草莓根系殘茬在土壤中腐解產生苯甲酸、3-苯基-2-丙烯酸、對羥基苯甲酸等,對下茬植株具有較強的自毒作用[26-27]。本實驗室前期研究發現,玉米秸稈腐解物對小麥幼苗具有不利的化感作用,有利于小麥紋枯病和根腐病的發生[18]。本研究在小麥、玉米秸稈還田耕層土壤中檢測出有機酸類、酯類、烴類、酰胺類、醛類等化學物質,其中相對含量較高的鄰羥基苯甲酸、3-苯基-2-丙烯酸、對羥基苯甲酸、9-十六碳烯酸、4-甲氧基鄰氨基苯甲酸等,均已被證明是對黃瓜、豌豆和草莓等作物有顯著影響的化感物質[26-28]。對羥基苯甲酸對小麥幼苗根系生長指標的抑制作用最強[29],各濃度抑制率在15.4%—100.0%;其次是鄰羥基苯甲酸(水楊酸)。
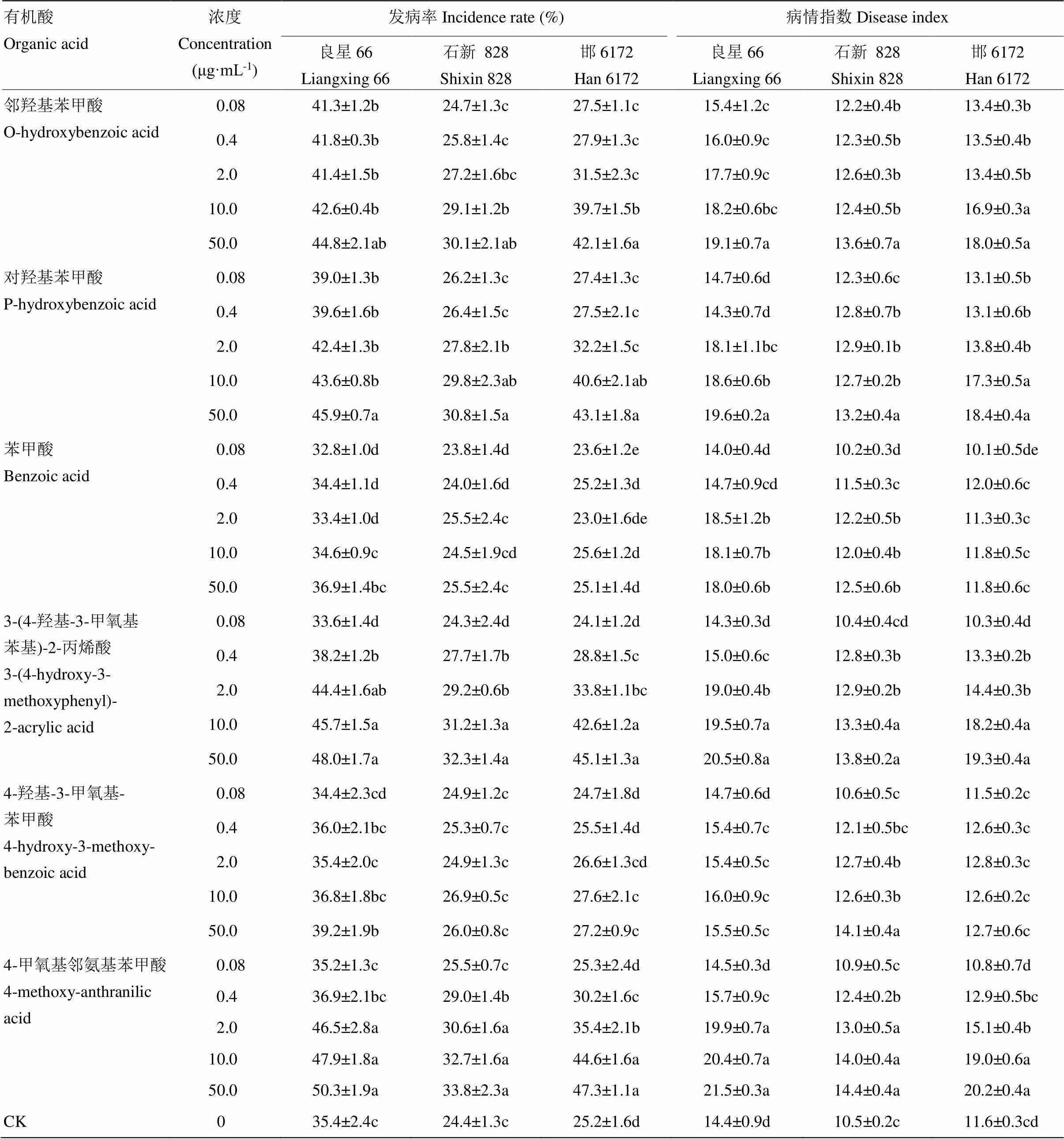
表6 6種有機酸對不同品種小麥紋枯病發生的影響
3.2 化感物質對土傳病害發生的促進作用
He等[30-31]研究發現,西洋參根區土壤中的香豆酸、丁香酸、香草酸等有機酸類物質對立枯絲核菌()和木賊鐮孢()菌絲生長均表現出一定的促進作用;NICOL等[32]研究表明,人參腐解物中化感物質皂甙能促進疫霉和腐霉的增長,從而導致人參根部病害明顯加重;大豆、甜瓜、西瓜和花生等作物殘茬或根系腐解產物中阿魏酸、苯甲酸、肉桂酸等物質在土壤中積累,會刺激尖鐮孢()的菌絲生長和孢子萌發[33-36],從而加重枯萎病發生;亦有研究表明,綠原酸可顯著抑制萵苣根尖細胞分裂,降低莖長及鮮重[37-38];肉桂酸、阿魏酸、香草酸等化感物質可顯著降低西瓜、杉木、黃瓜、草莓和楊樹根系活力,增強根系離子滲漏,降低根系SOD或POD活性,進而減弱其抗逆或抗病能力[28,34-35,39]。本研究發現,小麥、玉米秸稈還田耕層土壤中的鄰羥基苯甲酸、4-羥基-3-甲氧基-苯甲酸和4-甲氧基鄰氨基苯甲酸等化感物質對禾谷絲核菌具有顯著促進作用,對小麥幼苗生長、根系活力和保護酶活性均表現抑制作用,可能是秸稈還田條件下小麥紋枯病發生加重的主要原因之一。
鄰羥基苯甲酸、3-(4-羥基-3-甲氧基苯基)-2-丙烯酸和4-甲氧基鄰氨基苯甲酸對禾谷絲核菌生長的促進作用可能為小麥紋枯病加重發生的主要因素;但是,對禾谷絲核菌生長無明顯影響的對羥基苯甲酸處理后,紋枯病亦加重發生,究其原因可能與該物質對小麥幼苗生長較強的抑制作用密切相關[29]。本試驗中,苯甲酸對禾谷絲核菌生長表現出明顯抑制作用,可能由于其降低了小麥幼苗根系生理活性,減弱了受體抗逆性,最終導致發病程度亦未明顯減輕。
3.3 利用化感物質降解菌防控土傳病害
如何減輕化感物質對作物生長的抑制作用和對土傳病害的促進作用,己成為許多學者關注的焦點問題。據報道,鞘氨醇桿菌、柔膜菌、芽孢桿菌等均對化感物質具有很強的降解能力,能明顯緩解作物土傳病害的發生[40-43]。向土壤中施加優勢木霉菌可調整微生物群落結構和降解土壤中殘留的化感物質,提高植株抗病性,起到緩解連作障礙的作用[44]。在明確秸稈腐解產物中促進土傳病害發生的化感物質種類基礎上,篩選有益微生物,創制微生物菌劑,降解秸稈還田土壤中有害化感物質,克服對小麥生長的抑制作用,減緩對紋枯病的促進作用,可為我國小麥、玉米兩熟區秸稈還田條件下小麥紋枯病等土傳病害綠色防控提供新的思路和方法。
4 結論
冬小麥、夏玉米一年兩熟秸稈還田土壤中含有機酸、酯、烴、酰胺及醛類等化學物質,有機酸類相對含量最高。相對含量較高的3-(4-羥基-3-甲氧基苯基)-2-丙烯酸、4-甲氧基鄰氨基苯甲酸、鄰羥基苯甲酸和對羥基苯甲酸能通過促進禾谷絲核菌菌絲生長、增加菌核產生數量、降低小麥幼苗根系細胞保護酶活性、增強細胞內養分外滲,進而產生助長小麥紋枯病發生的化感作用;其中,3-(4-羥基-3-甲氧基苯基)-2-丙烯酸對小麥紋枯病發生的助長作用最強,而苯甲酸和4-羥基-3-甲氧基-苯甲酸對紋枯病的發生無顯著影響。耕層土壤中有機酸類物質產生和積累,可能是中國北方小麥、玉米兩熟秸稈還田條件下小麥紋枯病加重發生的主要原因之一。
[1] WitT C, Cassman K G, Olk D C, BIKER U, LIBOON S P, SAMSON M I, OTTOW J C. Crop rotation and residue management effects on carbon sequestration, nitrogen cycling and productivity of irrigated rice systems.,2000, 225(1): 263-278.
[2] SHARMA P, ABROL V, Sharma R K. Impact of tillage and mulch management on economics, energy requirement and crop performance in maize-wheat rotation in rainfed subhumid inceptions, India., 2011, 34: 46-51.
[3] 陳延熙, 唐文華, 張敦華, 簡小鷹. 我國小麥紋枯病病原學的初步研究. 植物保護學報, 1986, 13(1): 39-44.
Chen Y X, Tang W H, Zhang D H, Jian X Y. A preliminary study on etiology of sharp eyespot of wheat in china.,1986, 13(1): 39-44. (in Chinese)
[4] Kumar J, Sch?fer P, Hückelhoven R, Langen G, Baltruschat H, Stein E, Nagarajan S, Kogel K H., a cereal pathogen of global concern: cytological and molecular approaches towards better control., 2002, 3(4): 185-195.
[5] Daval S, Lebreton L, Gazengel K, Boutin M, Guillerm-Erckelboudt A Y, Sarniguet A. The biocontrol bacteriumPf29Arp strain affects the pathogenesis-related gene expression of the take-all fungusvar.on wheat roots., 2011, 12: 839-854.
[6] Lu L, Rong W, Zhou R, Huo N, Zhang Z. TaCML36, a wheat calmodulin-like protein, positively participates in an immune response to., 2019,7(5): 608-618.
[7] Hamada M S, Yin Y N, Chen H G, Ma Z H. The escalating threat of, the causal agent of sharp eyespot in wheat., 2011, 67(11): 1411-1419.
[8] Yang M M, Mavrodi D V, Mavrodi O V, Bonsall R F, Parejko J A, Paulitz T C, Thomashow L S, Yang H T, Weller D M, Guo J H. Biological control of take-all by fluorescentspp. from Chinese wheat fields.,2011, 101(12): 1481-1491.
[9] Qu T L, Zhang J L, Meng Z L, Liu X L, Cao Y S, Li J Q, Hao J J. Metabolism of fungicide 2-allylphenol in., 2014, 102: 136-141.
[10] 董金皋. 農業植物病理學. 2版. 北京: 中國農業出版社, 2007.
Dong J G... Beijing: China Agriculture Press, 2007.(in Chinese)
[11] 張雪松, 曹永勝, 曹克強. 保護性耕作與小麥主要土傳病害問題和治理對策. 西北農林科技大學學報(自然科學版), 2005, 33(增刊): 47-48.
Zhang X S, Cao Y S, Cao K Q. Management of wheat soil-borne diseases under the conservative farming system.,2005, 33(Suppl.): 47-48. (in Chinese)
[12] Lemańczyk G, Kwa?naH. Effects of sharp eyespot () on yield and grain quality of winter wheat., 2013, 135: 187-200.
[13] Bailey K L, Lazarovits G. Suppressing soil-borne diseases with residue management and organic amendments., 2003, 72(2): 169-180.
[14] Gill J S, Sivasithamparam K, Smettem K R J. Soil moisture affects disease severity and colonisation of wheat roots byAG-8., 2001, 33(10): 1363-1370.
[15] Chou C H, Lin H J. Autointoxication mechanism of. I. Phytotoxic effects of decomposing rice residues in soil., 1976, 2(3): 353-367.
[16] 張玉銘, 馬永清. 麥秸覆蓋夏玉米對其苗期生長發育的生化他感作用研究初報. 生態學雜志, 1994, 13(3): 70-72.
Zhang Y M, Ma Y Q. Alleopathic effect of wheat straw mulching on seedling growth and development of summer corn., 1994, 13(3): 70-72. (in Chinese)
[17] 謝瑞芝, 李少昆, 李小君, 金亞征, 王克如, 初震東, 高世菊. 中國保護性耕作研究分析——保護性耕作與作物生產. 中國農業科學, 2007, 40(9): 1914-1924.
Xie R Z, Li S K, Li X J, Jin Y Z, Wang K R, Chu Z D, Gao S J. The analysis of conservation tillage in China—conservation tillage and crop production: reviewing the evidence., 2007, 40(9): 1914-1924. (in Chinese)
[18] Qi Y Z, Zhen W C, Li H Y. Allelopathy of decomposed maize straw products on three soil-born diseases of wheat and the analysis by GC-MS., 2015, 14(1): 88-97.
[19] VILLAGRASA M, GUILLAMON M, LABANDEIRA A, TABERNER A, ELJARRAT E, BARCELO D. Benzoxazinoid allelochemicals in wheat: distribution among foliage, roots and seeds., 2006, 54(4): 1009-1015.
[20] QIAN H F, XU X Y, CHEN W, JIANG H, JIN Y X, LIU W P, FU Z W. Allelochemical stress causes oxidative damage and inhibition of photosynthesis in., 2009, 75(3): 368-375.
[21] Khamssi N N, Najaphy A. Physiological and biochemical responses of durum wheat under mild terminal drought stress., 2018, 64(4): 59-63.
[22] Tian X Y, He M R, Wang Z L, Zhang J W, Song Y L, He Z L, Dong Y J. Application of nitric oxide and calcium nitrate enhances tolerance of wheat seedlings to salt stress., 2015, 77(3): 343-356.
[23] Williamson G B, Richardson D. Bioassays for allelopathy: Measuring treatment responses with independent controls., 1988, 14(1): 181-187.
[24] Gonzalez T, Ruíz Y, Pérez R, García Y, Franco I, Nogueiras C. Allelopathic activity ofBrem. before black glume weedy (red) rice (L)., 2006, 18(2): 134-137.
[25] Nakano H, Morita S, Shigemori H, Hasegawa K. Plant growth inhibitory compounds from aqueous leachate of wheat straw., 2006, 48(3): 215-219.
[26] Ye S F, Zhou Y H, Sun Y, Zou L Y, Yu J Q. Cinnamic acid causes oxidative stress in cucumber roots, and promotes incidence ofwilt., 2006, 56: 255-262.
[27] Wang X j, Peter S, Liu Z q, Armstrong R, Rochfort S, Tang C x. Allelopathic effects account for the inhibitory effect of field-pea (L.) shoots on wheat growth in dense clay subsoils.,2019, 55(7): 649-659.
[28] Zhao X S, Zhen W C, Qi Y Z, Liu X J, Yin B Z. Coordinated effects of root autotoxic substances andSchl. f. sp.on the growth and replant disease of strawberry., 2009, 3(1): 34-39.
[29] 齊永志. 玉米秸稈還田的微生態效應及對小麥紋枯病的適應性控制技術[D]. 保定: 河北農業大學, 2014.
QI Y Z. Micro-ecological effect of maize straw returning to field and the adaptive control technology on wheat sheath blight[D]. Baoding: Hebei agricultural university, 2014. (in Chinese)
[30] He C N, Gao W W, Yang J X, Bi W, Zhang X S, Zhao Y J. Identification of autotoxic compounds from fibrous roots ofL., 2009, 318(1/2): 63-72.
[31] Goswami R S, Punja Z K. Molecular and biochemical characterization of defense responses in ginseng () roots challenged with., 2008, 72(1): 10-20.
[32] Nicol R W, YOUSEF L, Traquair J A, Bernards M A. Ginsenosides stimulate the growth of soilborne pathogens of American ginseng., 2003, 64(1): 257-264.
[33] Wang J l, Li X L, Zhang J L, Yao T, Wei D, Wang Y F, Wang J G. Effect of root exudates on beneficial microorganisms— Evidence from a continuous soybean monoculture., 2012, 213(12): 1883-1892.
[34] 楊瑞秀, 高增貴, 姚遠, 劉限, 孫淑清, 王瑩. 甜瓜根系分泌物中酚酸物質對尖孢鐮孢菌的化感效應. 應用生態學報, 2014, 25(8): 2355-2360.
YANG R X, GAO Z G, YAO Y, LIU X, SUN S Q, WANG Y. Allelopathic effects of phenolic compounds of melon root exudates onf. sp.., 2014, 25(8): 2355-2360. (in Chinese)
[35] 郝文雅, 冉煒, 沈其榮, 任麗軒. 西瓜、水稻根分泌物及酚酸類物質對西瓜專化型尖孢鐮刀菌的影響. 中國農業科學, 2010, 43(12): 2443-2452.
Hao W Y, Ran W, Shen Q R, Ren L X. Effects of root exudates from watermelon, rice plants and phenolic acids onf. sp..,2010, 43(12): 2443-2452. (in Chinese)
[36] Liu P, Liu Z H, Wang C B, Guo F, Wang M, Zhang Y F, Dong L, Wan S B. Effects of three long-chain fatty acids present in peanut (L.) root exudates on its own growth and the soil enzymes activities., 2012, 29(1): 13-24.
[37] Caspersen S, Alsanius B W, Sundin P, Jensén P. Bacterial amelioration of ferulic acid toxicity to hydroponically grown lettuce (L.)., 2000, 32(8/9): 1063-1070.
[38] Caspersen S, Sundin P, Munro M, Aealsteinsson S, Hooker J E, Jensén P. Interactive effects of lettuce (L.), irradiance, and ferulic acid in axenic, hydroponic culture., 1999, 210(1): 115-126.
[39] Chen L c, Wang S l, Wang P, Kong C h. Autoinhibition and soil allelochemical (cyclic dipeptide) levels in replanted Chinese fir () plantations., 2014, 374(1/2): 793-801.
[40] Schmidt S K. Degradation of juglone by soil bacteria., 1988, 14(7): 1561-1571.
[41] Dong L L, Xu J, Li Y, FANG H L, NIU W H, LI X W, ZHANG Y J, DING W L, CHEN S L. Manipulation of microbial community in the rhizosphere alleviates the replanting issues in., 2018, 125: 64-74.
[42] Liu S, Qin F, Yu S.root-associated fungi can counteract the negative influence of phenolic acid allelochemicals., 2018, 127: 1-7.
[43] Chen S Y, Guo L Y, Bai J G, Zhang Y, Zhang L, Wang Z, Chen J X, Yang H X, Wang X J. Biodegradation of p-hydroxybenzoic acid in soil byCSY-P1 isolated from cucumber rhizosphere soil., 2014, 389(1): 197-210.
[44] Chen A W, Zeng G M, Chen G Q, Fan J Q, Zou Z J, Li H, Hu X J, Long F. Simultaneous cadmium removal and 2,4-dichlorophenol degradation from aqueous solutions by., 2011, 91(3): 811-821.
Allelopathy of Six Organic Acids on Wheat Sheath Blight in the Soil of Winter Wheat-Summer Maize Double Cropping Straw Returning System
Zhao XuSheng1,2, QI YongZhi1,2, YAN CuiMei1,2, ZHEN WenChao2,3,4
(1College of Plant Protection, Hebei Agricultural University, Baoding 071001, Hebei;2State Key Laboratory for Crop Improvement and Control in North China, Baoding 071001, Hebei;3College of Agronomy, Hebei Agricultural University, Baoding 071001, Hebei;4Hebei Key Laboratory of Crop Growth Control, Baoding 071001, Hebei)
【】Double cropping of winter wheat and summer maize is the most extensive farming system in northern China. Straw returning has been widely used in wheat and maize production. But, the effect of straw returning on the occurrence of soil borne diseases of wheat has been controversial. The objective of this study is to analyze the main chemical constituents in the cultivated-layer soil with different straw returning years and the allelopathic effects of the main organic acids on the growth of wheat seedlings, the mycelium growth and sclerotia formation ofand occurrence of wheat sheath blight (WSB), and to understand the relationship between straw returning and WSB incidence.【】Gas chromatography-mass spectrometry (GC-MS) technique was used to analyze the types and contents of chemical substances in the extract of ethyl acetate from the cultivated soil where maize straw returning, and the effects of 6 organic acids with higher content on the root activity, root cell membrane permeability, superoxide dismutase (SOD) and peroxidase (POD) activity of wheat seedlings were determined with the TTC reduction, electrical conductivity, NBT photoreduction and guaiacol colorimetry methods, respectively. Meanwhile, the effects of these organic acids on the mycelium growth, sclerotium formation and occurrence of WSB were determined by the conventional methods.【】The relative contents of organic acids, alkanes, alcohols, amides, and aldehydes in the cultivated-layer soil and straw returning were 45.45%, 17.70%, 17.08%, 6.12%, and 5.44%, respectively. Organic acids mainly included o-hydroxybenzoic acid (9.24%), 3-phenyl-2-acrylic acid (4.12%), p-hydroxybenzoic acid (3.21%), 4-hydroxy-3,5- dimethoxybenzoic acid (2.26%), heneicosanoic acid (1.88%), 4-methoxy-anthranilic acid (1.73%), 8-octadecanoic acid (0.76%) and 3-(4-hydroxy-3- methoxyphenyl)-2-acrylic acid (0.52%). 4-methoxy-anthranilic acid and 3-(4-hydroxy-3-methoxyphenyl)-2-acrylic acid at 0.08-10.0 μg·mL-1had significant promoting effects on mycelial growth (expect 4-methoxy-anthranilic acid at 10.0 μg·mL-1), dry weight and sclerotium formation of, and the relative content of the two substances increased with the extension of straw returning years. o-hydroxybenzoic acid significantly promoted mycelial growth and sclerotia formation ofat 0.4 and 0.08 μg·mL-1. In contrast, 50.0 μg·mL-1of o-hydroxybenzoic acid and 4-hydroxyl-3-methoxy-benzoic acid, and 0.4-50.0 μg·mL-1of benzoic acid all showed inhibitory effects. All 6 organic acids at concentrations of 2.0-5.0 μg·mL-1inhibited the growth of wheat seedlings in a dose-dependent manner. The inhibitory effect of p-hydroxybenzoic acid was the strongest, followed by o-hydroxybenzoic acid, and 4-methoxy-anthranilic acid was the weakest. 3-(4-hydroxy-3-methoxyphenyl)-2-acrylic acid, 4-methoxyanthranilic acid, o-hydroxybenzoic acid, and p-hydroxybenzoic acid at concentrations of 0.4-50.0 μg·mL-1aggravated the occurrence of WSB. 3-(4-hydroxy-3-methoxyphenyl)-2-acrylic acid had the strongest enhancing effect, with the incidence and disease index increased by 49.0% and 46.7%, respectively. Benzoic acid and 4-hydroxy-3-methoxyphenyl-benzoic acid had no significant effect on the occurrence of WSB.【】Organic acids, esters, hydrocarbons, amides, and aldehydes were found in the cultivated-layer soil in the winter wheat-summer maize double cropping straw returning system. Organic acids were the most abundant of those chemicals. 3-(4-hydroxy-3-methoxyphenyl)-2-acrylic acid, 4-methoxyanthranilic acid, o-hydroxybenzoic acid, and p-hydroxybenzoic acid at a certain concentration can promote the occurrence of WSB. 3-(4-hydroxy-3-methoxyphenyl)-2-acrylic acid has the strongest stimulatory effect, while benzoic acid and 4-hydroxy-3-methoxy-benzoic acid have no effect on the occurrence of WSB. Allelopathic effects of organic acids in the cultivated-layer soil, including the promotion on pathogen growth and inhibition on physiological activity and growth of wheat roots, may be one of the main reasons for the serious occurrence of WSB in the straw returning region in northern China.
straw returning; wheat sheath blight;; GC-MS; allelopathy; organic acid

10.3864/j.issn.0578-1752.2020.15.010
2020-02-29;
2020-04-02
國家重點研發計劃(2017YFD0300906)、國家科技支撐計劃(2012BAD04B06)、河北省教育廳項目(ZD2016162)、河北省自然科學基金(C2016204211)、河北省現代農業產業技術體系小麥產業技術創新團隊建設項目(HBCT2018010205)
趙緒生,E-mail:zhaoxusheng2000@yeah.net。齊永志,E-mail:qiyongzhi1981@163.com。趙緒生和齊永志為同等貢獻作者。通信作者甄文超,E-mail:wenchao@hebau.edu.cn
(責任編輯 岳梅)

