民族藥紅毛七研究進展
覃彬華 劉一文 張昌文


摘要:指出了紅毛七為小檗科植物,紅毛七的干燥根及根莖,主要分布于東北、湖北、西藏等地,常用于治療脘腹寒痛,跌打損傷,風濕痹痛,月經不調。主要含有生物堿、三萜皂苷、環烯醚萜、脂肪酸、甾醇等化學成分。且發現紅毛七有抗風濕、抗炎鎮痛、抑菌、杭氧化以及杭腫瘤等活性。綜述了其化學成分及其藥理活性,為紅毛七的進一步開發研究提供理論參考。
關鍵詞:紅毛七;化學成分;藥理活性
中圖分類號:R284.1 文獻標識碼:A 文章編號:1674-9944(2020)04-0179-07
1 引言
紅毛七(Caulophyllum robustum Maxim.)為小檗科植物,紅毛七的根及根莖,又名葳嚴仙、紅毛三七、海椒七、搜山貓、火焰叉、金絲七、雞骨升麻、紅毛細辛、黑汗腿等。生于海拔950~3000m的林下或者山溝陰處。在湖北省作為土家族特色民族藥,分布宜昌市五峰縣,全國主要分布于東北、四川、西藏、陜西、浙江、貴州等地,具有活血化瘀、清熱解毒、活血化瘀、祛風除濕,行氣止痛之功效,常用于治療月經不調,痛經,產后血瘀腹痛,脘腹寒痛,跌打損傷,關節炎,胃痛,風濕痹痛[1]。另外,在其他文獻記載了紅毛七的抗風濕作用,其中《民間常用草藥匯編》《峨眉藥用植物》《全國醫藥產品大全》均有記載紅毛七的治跌打,除風濕作用,說明紅毛七在民族醫藥中的作用。
2 紅毛七化學成分研究進展
近年來國內外學者對紅毛七的化學成分進行了系統研究,經報道已經分離得到70余個化合物,植物中主要含有生物堿、三萜皂苷、環烯醚萜、紫羅蘭醇、甾醇、揮發油、淀粉、樹膠、色素等成分[2]。發現其有抗風濕,抗炎鎮痛,抑菌,抗細胞毒,抗氧化、降血糖以及抗腫瘤等活性[3],且發現生物堿和皂苷為其活性成分,對化合物的主要結構進行詳細的綜述。
2.1 生物堿類化學成分
生物堿是紅毛七中的主要化學成分之一,主要含有阿樸啡類、異喹啉類生物堿M S Flom等[4]從紅毛七中分離得到Magnoflorine(1),Anagyrine(2),N-methyl-cytisine(3),Baptifoline(4)。Kennelly E J等[5]從類葉牡丹中分離得到Taspine(5),Sparteine(6),5,6-Dehydro-α-isolupanine(7),Lupanine(8),Thalictroidine(9),α-isolupanine(10)。Li Y等[6]運用現代手段,分析得出紅毛七中含有Boldine(11), Cytisine(12)等一系列生物堿,Ali Z等[7]從類葉牡丹分離得到O-acetylbaptifolin(13),Caulophyllumine A(14),Caulophyllumine B(15),Piperidylacetophenone(16)等生物堿。Wang S等[8]從紅毛七中分離得到一類新的芴酮生物堿Caulophine(17)。Wang X L等[9]從紅毛七中又分離得到幾個新的芴酮生物堿Caulophylline A(18),Caulophylline B(19),Caulophylline C(20),Caulophylline D(21),Caulophyl-line E(22)。王倩等[10]紅毛七中分離得到兩種生物堿epimediphine(23),(+)-reticuline(24)。
2.2 皂苷類化學成分
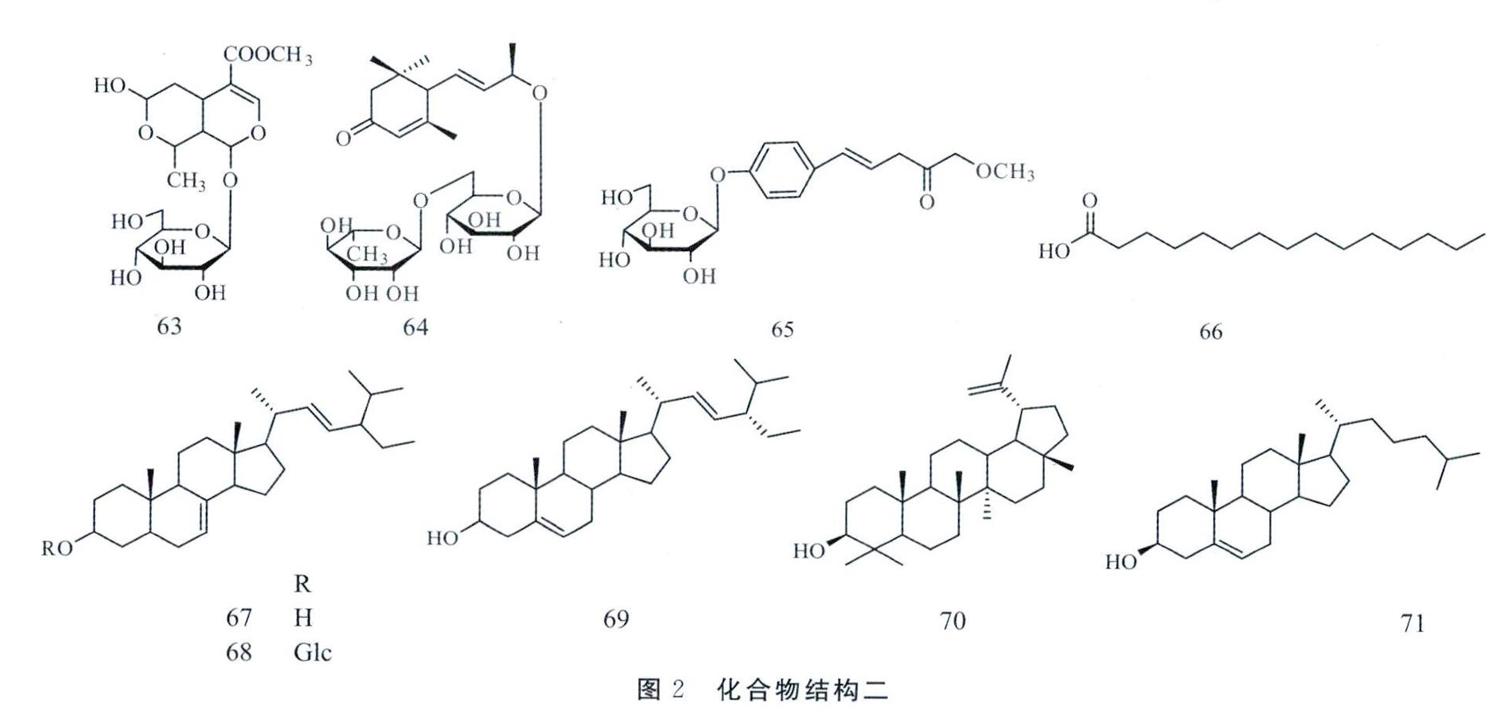
五環三萜皂苷是紅毛七中另一類主要的化學成分,并且具有良好生物活性,其中皂苷的基本母核都是五環三萜類,主要結構改變在于五環三萜骨架的23位和16位的變化,其次是3位和28位的糖鏈的改變,并且主要是由阿拉伯糖、鼠李糖、葡萄糖構成的糖鏈,所形成的的單糖鏈和雙糖鏈皂苷,23位甲基、醛基、亞甲氧基的變化,16位有無羥基結構。已經報道的皂苷主要齊墩果酸型皂苷、刺廊酸皂苷、常春藤皂苷、葳嚴仙皂苷等其他少量的皂苷。Y Matsuo等[11]分離得到一系列三萜皂昔:3β-[α-L-arabinopyranosyl)oxy]-23-oxo-olean-12-en-28-oic acid(25),3β-[(α-L-ara-binopyranosyl)oxyl-16。-hydroxy-23-oxo-olean-12-en-28-oic acid(26),3β-[(O-p-D-gluco-pyranosyl-(1→2)-α-L-arabinopyranosyl)oxy]-11α,12α-epoxy-13β,23-dihydroxyoleanan-28-oicacid γ-lactone(27),3β-[(α-L-arabinopyranosyl)oxyl-11α,12α-epoxy-13β,16a,23-trihydroxy-oleanan-28-oic acid γ-lactone(28),3β-[(α-L-arabinopyranosyl)oxy]-16α,23-dihydroxyoleana-11,13-then-28-oic acidC29),3β-[(O-β-D-glu-copyranosyl-(1→2)-α-L-arabinopyranosyl)oxy]-20α-hydroxyursan-28-oic acid(30),3β-[(O-β-D-glucopyranosyl-(1→2)-α-L-arabinopyranosyl)oxy]-20β-hydroxyursan-28-oic acid δ-lactone(31),3β-[(O-β-D-glucopyranosyl-(1→2)-α-L-arabinopyranosyl)oxy]-16α,23-dihydroxyolean-12-en-28-oic acid(32),3β-[(α-L-arabinopyr-anosyl)oxyl-16α,23-dihydroxyolean-12-en-28-oic acid β-D-glucopyranosyl ester(33),3β-[(α-L-arabinopyranosyl)oxy]-16α,23-dihydroxyolean-12-en-28-oic acid O-β-D-glucopyranosyl-(1→6)-β-D-glucopyranosyl ester(34),3β-[(α-L-arabinopyranosyl)-oxy]olean-12-en-28-oic acid(35),3β-[(α-L-arabinopyranosyl)oxy]-23-hydroxyolean-12-en-28-oic acid(36),3β-[(O-β-D-glucopyranosyl-(1→2)-α-L-arabinopyr-anosyl)oxyl olean-12-en-28-oic acid(37),3β-[(α-L-arabinopyranosyl)oxy]-16α-hydroxyolean-12-en-28-oic acid(38),3β-[(O-β-D-gluco-pyranosyl-(1→2)-α-L-arabinopyranosyl)oxy]-16α-hydroxyolean-12-en-28-oicacid(39),3β-[(α-L-arabinopyranosyl)oxyl-16α,23-dihydroxy-olean-12-en-28-oic acid(40),3β-[(α-L-ara-binopyranosyl)oxy]-23-hydroxyolean-12-en-28-oic acid O-α-L- rhamnopyranosyl-(1→4)-O-β-D-glucopyranosyl-(1→6)-β-D-glucopyranosylester(41),3β-[(α-L-arabinopyranosyl)oxy]-16α,23-dihydroxyolean-12-en-28-oic acid O-α-L-rhamnopyranosyl-(1→4)-O-β-D-glucopy-ranosyl-(1→6)-β-D-glucopyranosyl ester(42),3β-[(O-β-D-glucopyranosyl-(1→2)-α-L-ar-abinopyranosyl)oxy]olean-12-en-28-oic acid O-α-L-rhamnopyranosyl-(1→4)-O-β-D-glucopy-ranosyl-(1→6)-β-D-glucopyranosyl ester(43),3β-[(O-β-D-glucopyranosyl-(1→2)-α-L-ar-abinopyranosyl)oxy]-23-hydroxyolean-12-en-28-oic acid O-α-L- rhamnopyranosyl-(1→4)-O-β-D-glucopyranosyl-(1→6)-β-D-glucopyranosylester(44),3β,23-dihydroxyolean-12-en-28-oicacid O-α-L-rhamnopyranosyl-(1→4)-O-β-D-glucopyranosyl-(1→6)-β-D-glucopyranosyl es-ter(45),Ali Z等[12]從類葉牡丹中分離得到CaulosideH(46),Cauloside D(47),Cauloside G(48),CaulosideB(49)等一系列皂苷。Chetyrina N S等[13]分離得到兩個新的三萜皂苷Cauloside b(50)和Cauloside c(51),李國玉等[14]分離得到一個新的三萜皂苷3-O-β-D-glucopyranosyl-(1→3)-α-L-arabinopyranosyl-hederagenin 28-O-α-L-rhamnopyranosyl-(1→4)-β-D-glucopyranosyl(1→6)-β-D-glucopyrano-side(52),Jhoo J等[is]分離得到3-O-α-L-arabi-nopyranosyl-hederagenin 28-O-α-L-rhamnopyr-anosyl-(1→4)-β-D-glucopyranosyl(1→6)-β-D-glucopyranoside(53),馬養民等[16]從紅毛七中分離得到16α,23,28-三羥基-齊墩果-12-烯-3-O-α-L-阿拉伯毗喃糖昔(54),李國玉等[17]在類葉牡丹中分離得到-系列皂苷3-O-α-L-arabinopyrano-syl-hederagenin-28-O-β-D-glucopyranosyl-(1→6)-β-D-glucopyranoside(55),ciwujianosides Al(56),Leonticin F(57),3-O-β-D-glucopyranosyl-(1→3)[β-D-glucopyranosyl-(1→2)]α-L-ara-binopyranosyl-echinocystic acid-28-O-α-L-rh-amnopyranosyl-(1→4)-β-D-glucopyranosyl-(1→6)-β-D-glucopyranoside(58),Leonticin A(59),王玉梅等[18]從紅毛七中分離得到3-O-β-D-glucopy-ranosyl(1→2)-α-L-arabinopyranosyl-hederagenin-28-O-β-D-glucopyranosyl ester(60),3-O-β-D-glucopyranosyl-hederagenin-28-O-α-L-rhamnopyranosyl-(1→2)[β-D-xylopyranosyl(1→6)]-β-D-glucopyranosyl ester(61),3-O-α-L-arabinopyranosyl-gypsogenin-28-O-α-L-rham-nopyranosyl-(1→4)-β-D-glucopyranosyl-(1→6)-β-D-glucopyranosyl ester(62)。
紅毛七水提多糖、紅毛七乙醇提取物和不同極性萃取部位的抗氧化實驗:多糖經過一系列純化,去除雜質,運用化學反應方法,測定反應后溶液的吸光度,來對比各個部分的抗氧化能力,對DPPH、-OH、O2、NO2具有較強的清除能力,其中乙醇提取物顯示出一定活性,而正丁醇層部分與乙酸乙酯極性部位顯示出中等強度的抗氧化活性[31]。Wang X L[32]對紅毛七生物堿的抗氧化研究表明,caulophylline A-D對DPPH沒有很好的清除作用,但是caulophylline E對于DPPH有很好的清除作用,其IC50值為12.1μg/mL。楊赟[33]在幾種藥用植物的抗氧化活性篩選實驗得出,紅毛七的乙醇提取物的氯仿萃取部位有很好的清除DPPH的作用,其IC50值為79.45mg/L。
3.4 抗動脈粥樣硬化和抗心肌缺血作用
高琨對紅毛七的總提取物進行了系統的成分分離和其化合物的活性篩選、驗證,并且建立血管CMC模型,研究結果表明芴酮生物堿成分Caulophine具有一定的血管舒張作用[34]。林蓉采用H2O2造成大鼠血管內皮細胞損傷,經過活性研究實驗發現芴酮生物堿Caulo-phine在一定劑量內能夠降低大鼠內皮細胞的死亡;通過WB檢測方法發現,CaulophineE3s]還通過促進Hz OZ損傷的血管內皮細胞內NO、一氧化氮合酶ONOS)等因子的釋放和抑制核轉錄因子NF-κB(p-65)和p-p65的表達,起到保護內皮細胞,抗動脈粥樣硬化的作用。紅毛七芴酮生物堿為紅毛新堿,其中化合物CaulophineB在離體蛙心灌流試驗、大鼠離體主動脈環的離體器官和抗心肌缺血試驗中,均發揮了較好的抗心肌缺血作用[35]。
3.5 抗腫瘤作用
Itokawa H[37]經過細胞毒性(MTT)試驗,計算得到Taspine對于(人口腔表皮樣癌細胞)細胞和(倉鼠肺癌細胞)細胞的IC50值為0.39μg/mL和0.17μg/mL,實驗結果表明Taspine對兩種腫瘤細胞有明顯的毒性作用,說明其具有一定的抗腫瘤活性的作用。Zhang YM[38]試驗表明Taspine對于小鼠S180肉瘤的抑制活性有很好的計量依賴關系。其作用機制可能與微血管密度和相關蛋白表達有關,通過WB檢測的結果看來,其作用機制與Bcl-2、Bax等因子的降低有關。ZhanY[39]表明Taspine對于乳腺癌體內移植能夠提升雌激素受體激動劑。并且Taspine能改變細胞周期和誘導細胞凋亡,能降低雌激素和孕激素在組織細胞中的表達,同時也能減少兩種受體的mRNA的表達。
建立肺腺癌A549腫瘤移植瘤模型[20],對紅毛七中塔斯品堿的藥理作用進行詳細的研究,實驗內容包括檢測CAM血管結構、腫瘤組織的生長情況、形態學變化及腫瘤組織內新生分布等幾個方面,運用ELISA,免疫蛋白印記(WB)和RT-RCR等分子生物學實驗方法,證明了Taspine有明顯的抗腫瘤血管生成的藥理活性。
Anisimov M M在培養環境在pH值為7.4的條件下,顯微鏡下觀察葳嚴仙皂苷C作用于癌細胞的細胞膜,使之產生破痕,但是并不會導致細胞死亡,而且這種細胞仍然具有增殖能力,在弱酸性條件下,環境作用不影響苷C的分布,且其主要集中存在于原生質體膜中,從而導致溶酶體膜的滲透性被破壞,進一步使其繁殖能力喪失。該研究結果驗證了苷A和苷C能阻止癌細胞生長,細胞毒性(CCK-8)實驗得到它們具細胞毒作用[30]。
3.6 降壓作用
采用Magnoflorine靜注或灌胃的方法,對不麻醉大鼠、全麻醉狗和腎性高血壓犬等進行給藥,驗證其降壓作用,發現均有明顯降低血壓的作用,尤其是在舒張血管方面作用較為顯著。然而其具體的作用機制還沒有清晰的闡明Magnoflorine對于神經突觸不具有阻斷作用,對乙酞膽堿反應系統的神經節均有顯著阻斷作用,與六烴季銨(陽性藥)比較,效果稍弱,主要是有微弱的筒箭毒堿樣作用,木蘭堿的毒性效價是筒箭毒的0.5%,但是對機體的腎上腺素的升壓反應無影響Mag-notlorine的降低血壓作用主要與突觸神經節阻斷作用密切相關[40]。
3.7 抗乙酰膽堿醋酶活性
Si K W藥理學試驗中,證明了Taspine作為潛在的抗ACNE藥物,具體的相關分子機制得到清晰的證明,結果顯示Taspine比臨床用藥加蘭他敏表現出更好的抗ACNE效果,并且其IC50值為0.12μg/mL,同時結果表明Taspine是一個潛在的抗AD的藥物[41]。
參考文獻:
[1]中國科學院.中國植物志[M].北京:科學出版社,2001;304.
[2]Xia Y G,Li G Y,Liang J,et al.Genus caulophyllum:an over-view of chemistry and bioactivity.[J].Evidence-based comple-mentary and alternative medicine:eCAM,2014,2014(2):684508.
[3]Madgula V L,Ali Z,Smillie T,et al.Alkaloids and saponins ascytochromeP450 inhibitors from blue cohosh(Caulophyllum thal-ictroides)in an in vitro assay [J].Planta Medica,2009,75(4):329~332.
[4]Flom M S,Doskotch R W,Beal J L.Isolation and characteriza-tion of alkaloids from Caulophyllum thalictroides.[J].Journal ofPharmaceutical Sciences,1967,56(11):1515.
[5]Kennelly E J,Flynn T J,Mazzola E P,et al.Detecting potentialteratogenic alkaloids from blue cohosh rhizomes using an in vitrorat embryo culture.[J].Journal of Natural Products,1999,62(10):1385~1389.
[6]Li Y.Hu Z,He L.An approach to develop binary chromato-graphic fingerprints of the total alkaloids from Caulophyllum ro-bustum by high performance liquid chromatograph y/diode arraydetector and gas chromatography/mass spectrometry [J].Journalof Phar maceutical&Biomedical Analysis,2007,43(5):1667~72.
[7]Ali Z,Khan I A.Alkaloids and saponins from blue cohosh [J].Phytochemistry,2008,69(4):1037~1042.
[8]Wang S.Wen B,Wang N,et al.Fluorenone alkaloid from Caulo-phyllum robustum Maxim.with anti-myocardial ischemia activi-ty.[J].Archives of Pharmacal Research,2009,32(4):521~526.
[9]Wang X L,Liu B R,Chen C K,et al.Four new fluorenone alka-loids and one new dihydroazafluoranthene alkaloid from Caulo-phyllum robustum Maxim [J].Fitoterapia.2011,82(6):793~797.
[10]王倩,陸云陽,邱瑞桂,等.太白產紅毛七生物堿成分的研究[J].中南藥學,2016(2):134~137.
[11]Matsuo Y,Watanabe K,Mimaki Y.Triterpene glycosidesfrom theunderground parts of Caulophyllum thalictroides [J].Journal ofNatural Products,2009,72(6):1155~1160,2009.
[12]Ali Z,Khan I A.Alkaloids and saponins from blue cohosh.[J].Phytochemistry,2008,69(4):1037~1042.
[13]Chetyrina N S,Kalinovskii A I.Triterpene glycosides ofCauliphyllum robustum.The structures of caulosides B and C[J].Chemistry of Natural Compounds,1979,15(2):146~148.
[14]LiGY,XiaYG,Liang J,et al.Simultaneous determination offive triterpenoid saponins in the root of Caulophyllum Robustummaxim by HPLC-ELSD[J].Fuel& Energy Abstracts,2013,43(4):247.
[15]Jboo J W,Sang S,He K,et al.Characterization of the triter-pene saponins of the roots and rhizomes of blue cohosh(Caulo-phyllum thalictroides)[J].Journal of Agricultural&FoodChemistry,2001,49(12):5969~74.
[16]馬養民,邢華,劉建軍,等.太白七藥紅毛七化學成分研究[J].安徽農業科學,2012,40(2):745~747.
[17]李國玉.徐娜,劉曉燕,等.類葉牡丹化學成分的研究[J].中草藥,2015,46(10):1431~1436.
[18]王玉梅,王倩,張倩,等.紅毛七的皂苷成分研究[J].中南藥學,2016(1):12~15.
[19]李國玉.類葉牡丹抗風濕有效部位的化學成分研究[D].哈爾濱:黑龍江中醫藥大學,2006:16-22
[20]但飛君,蔡正軍,田瑛.等.紅毛七化學成分的研究[J].中成藥,2011,33(6):1011~1014.
[21]米盈盈,薛娟,孫宜春.等.類葉牡丹揮發油成分GC-MS分析[J].化學工程師,2015,29(8):19~21.
[22]楊蘋,陳森州,楊紅要,等.三種紅毛七提取物的抗炎鎮痛作用實驗研究[J].中國實用醫藥,2007, 2(32):1~3.
[23]焦淑萍,于鐵力,姜虹,等.類葉牡丹根莖水煎劑抗炎作用研究[J].北華大學學報(自然),1997(1):8~9.
[24]姜虹,焦淑萍,任慶林,等.類葉牡丹根莖水煎劑鎮痛作用研究[J].北華大學學報(自然),1997(2):8~9.
[25]楊秀芳,馬養民,邢華,等.紅毛七中三萜皂苷類化學成分生物活性研究[J].陜西科技大學學報,2013,31(2):62~65.
[26]Perdue G P,Blomster R N,Blake D A,et al.South Americanplants 1I:taspine isolation and anti—inflammatory activity[J].Journal of Pharmaceutical Sciences.1979,68(1):124~126.
[27]Yeonju L,Jae—Chul J,Zulfiqar A,et al.Anti—InflammatoryEffect of Triterpene Saponins Isolated from Blue Cohosh(Caulo-phyllum thalictroides).[J].Evidence-based complementary andalternative medicine:eCAM,2012,2012(3):798192.
[28]李國玉.類葉牡丹抗風濕有效部位的化學成分研究[D].哈爾濱:黑龍江中醫藥大學,2006:27~87.
[29]蔡正軍,但飛君,陳國華,等.紅毛七體外抗菌作用的研究[C]//中國化學會.中國化學會第26屆學術年會化學生物分會場論文集.北京:中國化學會,2008.
[30]Anisimov M M,Strigina L I,Baranova S I,et al.The antimicro-bial activity of the triterpene glycosides of Caulophyllum robust-um maxim.[J].Antibiotiki,1972,17(9):834.
[31]但飛君,鄢文芳,褚立軍,等.紅毛七乙醇提取物和不同極性部位抗氧化活性的研究[J].食品工業科技,2011(1):68~70.
[32]Wang X L,Liu B R,Chen C K,et al.Four new fluorenone alka-loids and one new dihydroazafluoranthene alkaloid from Caulo-phyllum robustum Maxim.[J3.Fitoterapia,2011,82(6):793~797.
[33]楊贊,劉敏,李建,等.藥用植物中乙酰膽堿酯酶抑制活性和抗氧化活性的篩選[J].中國實驗方劑學雜志,2013,19(2):213~218.
[34]林蓉,劉俊田,賀浪沖,等.紅毛七提取物對H2O2損傷內皮細胞核轉錄因子NF-κB的表達和NO生成的影響[J].中國藥學雜志,2004,39(11):826~828.
[35]高琨,賀浪沖,楊廣德.用細胞膜色譜法篩選研究紅毛七中的有效成分[J].中國藥學雜志,2003.38(1):14~16.
[36]Si K W,Liu J T,He LC,et al.Effects of Caulophine on Caffe-ine—induced Cellular Injury and Calcium Homeostasis in RatCardiomyocytes[J].Basic&Clinical Pharmacology&Toxicolo-gy,2010,107(6):976~981.
[37]Itokawa H,Ichihara Y,Mochizuki M,et al.A cytotoxic sub-stance from Sangre de Grado.[J].Chemical&PharmaceuticalBulletin,1991,39(4):1041~1042.
[38]Zhang Y M,He L C,Wang H Y.Inhibitory effect of taspine onmouse S180 sarcoma and its mechanism.[J].China Journal ofChinese Materia Medica,2007,32(10):953~956.
[39]Zhan Y,Zhang Y,Chen Y,et al.Activity of taspine isolatedfrom Radix et Rhizoma Leonticis against estrogen-receptor-positive breast cancer.[J].Fitoterapia,2011,82(6):8 96.
[40]尉耀元,谷玉榮.紅毛七藥學研究概況[J].科技視界,2012(9):187~189.
[41]Si KW,Liu J T,HeLC,et al.Effects of Caulophine on Caffe-ine-induced Cellular Injury and Calcium Homeostasis in RatCardiomyocytes.[J].Basic&ClinicalPharmacology&Toxicolo-gy,2010,107(6):976~981.
收稿日期:2020-01-18
基金項目:湖北省教育廳科研項目(編號:B2017508)
作者簡介:覃彬華(1992-),男,土家族,助教,碩士,研究方向為中藥、民族藥的質量標準及有效成份。
通訊作者:張昌文(1970-),男,副教授,研究方向為中藥炮制及質量標準。

