蓋子環(huán)替換及定點(diǎn)突變提高菜豆環(huán)氧化物水解酶對(duì)鄰甲基苯基縮水甘油醚的催化性能
章晨,朱秀秀,李闖,鄔敏辰
(1 江南大學(xué)藥學(xué)院,江蘇無(wú)錫214122;2 江南大學(xué)生物工程學(xué)院,江蘇無(wú)錫214122;3 江南大學(xué)無(wú)錫醫(yī)學(xué)院,江蘇無(wú)錫214122)
手性環(huán)氧化物是一類(lèi)重要的藥物砌塊,廣泛運(yùn)用于醫(yī)藥、農(nóng)藥等領(lǐng)域[1]。如(S)-環(huán)氧苯乙烷是合成抗HIV 病毒藥、殺蟲(chóng)劑等的重要中間體[2];(R)-oMGE 是合成β1-腎上腺素受體拮抗劑的重要原材料[3]。目前主要是通過(guò)化學(xué)合成以及生物酶催化拆分外消旋(racemic,rac-)環(huán)氧化物來(lái)獲取單構(gòu)型的環(huán)氧化物。化學(xué)合成中會(huì)使用大量的重金屬,不僅在生產(chǎn)中毒害大,也會(huì)對(duì)環(huán)境造成極大的破壞。相比之下,生物酶法由于其低毒性和經(jīng)濟(jì)性,被廣泛接受[4]。如環(huán)氧化物水解酶(epoxide hydrolases,EH,EC 3.3.2.-),能夠催化外消旋環(huán)氧化物對(duì)映或歸一性水解為相應(yīng)的鄰二醇,且廣泛存在于植物、動(dòng)物以及微生物體內(nèi)[5]。
近年來(lái),環(huán)氧化物水解酶的挖掘及改造已成為研究熱點(diǎn)。如許建和團(tuán)隊(duì)[6-7]從綠豆中擴(kuò)增出2條編碼EH 的基因,并導(dǎo)入大腸桿菌(Escherchia coli,E.coli),成功地實(shí)現(xiàn)了植物來(lái)源環(huán)氧化物的異源表達(dá),所得的重組酶VrEH1和VrEH2能對(duì)映歸一性水解對(duì)硝基環(huán)氧苯乙烷,生成的(R)-對(duì)硝基苯乙二醇的對(duì)映體過(guò)量值(enantiomeric excess,ee)分別為70.0%和84.8%。又如朱勍團(tuán)隊(duì)[8]從蘋(píng)果輪紋病菌中挖掘出一種EH,能夠動(dòng)力學(xué)拆分苯基縮水甘油醚類(lèi)環(huán)氧化物,其中,對(duì)rac-oMGE對(duì)映體比率(enantiomeric ratio,E)達(dá)到48.6。但目前發(fā)現(xiàn)的大多數(shù)野生EH因?yàn)镋、ee或活性低等原因,無(wú)法滿足工業(yè)生產(chǎn)的需求。隨著蛋白質(zhì)分子改造技術(shù)的日益成熟,改造EH 從而改善其性質(zhì)的研究也屢見(jiàn)報(bào)道。如Reetz等[9]通過(guò)定點(diǎn)飽和突變技術(shù)將一種黑曲霉EH 對(duì)rac-oMGE的E值由4.6提高到160。
實(shí)驗(yàn)室前期從菜豆中挖掘出兩種菜豆環(huán)氧化物水解酶PvEH1和PvEH2,均能對(duì)映選擇性水解racoMGE[9]。現(xiàn)擬通過(guò)分子改造提高PvEH2 的催化性能,使其水解rac-oMGE 時(shí)既能保留單構(gòu)型環(huán)氧化物,又能生成較純的單構(gòu)型鄰二醇。先同源模擬PvEH1 和PvEH2 的三維結(jié)構(gòu),然后替換PvEH2 分子結(jié)構(gòu)中的蓋子環(huán)區(qū)域,再利用分子對(duì)接技術(shù)選取距離底物8?(1?=0.1nm)以內(nèi)的非保守氨基酸,將其全部突變?yōu)楸彼幔玫搅艘粋€(gè)最優(yōu)突變子Pv2Pv1K176A,并采用分子對(duì)接模擬分析其區(qū)域選擇性提高的原因,最后用E. coli/pv2pv1K176A催化高濃度rac-oMGE。
1 實(shí)驗(yàn)材料與方法
1.1 菌株與質(zhì)粒
E. coli BL(DE3)和E. coli JM109,保存于本實(shí)驗(yàn)室;克隆質(zhì)粒pUCm-T,上海Sangon公司;表達(dá)質(zhì)粒pCold Ⅱ,美國(guó)Novagen公司。
1.2 試劑與儀器
1L LB 培養(yǎng)基:胰蛋白胨10g、酵母提取物5g和NaCl 10g(固體培養(yǎng)基另加20g 瓊脂粉),pH 調(diào)至7.0。質(zhì)粒提取試劑盒(無(wú)錫康為世紀(jì)公司)。rac-oMGE(上海TCI 公司)。全溫?fù)u瓶柜HYG-A(江蘇太倉(cāng)實(shí)驗(yàn)設(shè)備廠);高速冷凍離心機(jī)5804R(德國(guó)Eppendorf 公司);實(shí)驗(yàn)所用酶均購(gòu)于上海Sangon生物技術(shù)有限公司。液相色譜OD-H手性柱(250mm×4.6mm×5μm)購(gòu)自大賽璐藥物手性技術(shù)(上海)有限公司。
1.3 PvEH2的結(jié)構(gòu)分析
在Swiss-Prot Protein 數(shù)據(jù)庫(kù)(http://www.ebi.ac.uk/swissprot/)中搜索與PvEH2 同源性最高且結(jié)構(gòu)和功能已知的蛋白分子,以此蛋白三維結(jié)構(gòu)為模板在SWISS-MODEL 網(wǎng) 站(https://swissmodel.expasy.org/)中模擬出PvEH1和PvEH2的三維結(jié)構(gòu)。利用PyMOL軟件(https://pymol.org/2/)對(duì)它們的三維結(jié)構(gòu)進(jìn)行可視化分析。
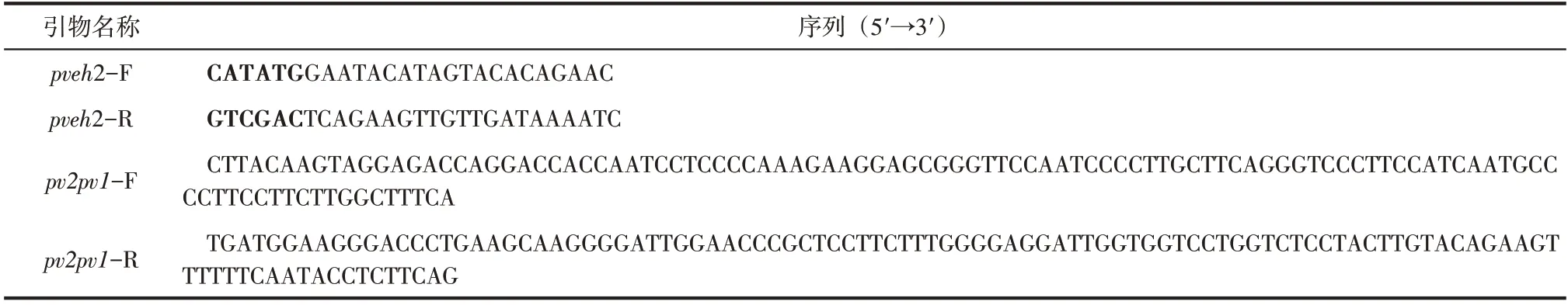
表1 FPCR所用引物
1.4 PvEH2的蓋子環(huán)替換
本節(jié)所用引物如表1所示,由無(wú)錫亦欣生物公司合成。提取含有PvEH2 編碼基因的大腸桿菌轉(zhuǎn)化子質(zhì)粒(pCold Ⅱ-pveh2),并作為模板,通過(guò)三輪融合聚合酶鏈?zhǔn)椒磻?yīng)(FPCR)獲得目的基因pv2pv1。第一輪以pveh2-F 和pv1pv2-R 作為引物,在DNA聚合酶PrimerSTAR HS DNA polymerase作用下進(jìn)行PCR:98℃變性3min,30 個(gè)循環(huán)(98℃,30s;50℃,30s和72℃,40s),72℃充分延伸10min,對(duì)PCR產(chǎn)物進(jìn)行瓊脂糖凝膠電泳檢測(cè)并割膠回收。再以回收產(chǎn)物為模板,pveh2-R 和pv2pv1-F 為第二輪引物,其他條件不變進(jìn)行擴(kuò)增、檢測(cè)和割膠。最后以第一輪和第二輪產(chǎn)物作為第三輪PCR 的上下模板,pveh2-F和pveh2-R為引物,其他條件不變,獲得蓋子環(huán)被替換的EH 編碼基因pv2pv1。連接pUCm-T 載體,轉(zhuǎn)化E. coli JM109 并用氨芐西林(Amp)篩選陽(yáng)性克隆子送至上海Sangon 生物技術(shù)有限公司進(jìn)行DNA 測(cè)序驗(yàn)證,測(cè)序成功的轉(zhuǎn)化子命名為pUCm-T-pv2pv1,用Nde I 和Sal I 雙酶切,最終連接至pCold Ⅱ,轉(zhuǎn)入E. coli BL21(DE3),經(jīng)Amp 抗性篩選、驗(yàn)證并且測(cè)序正確的重組菌株命名為E.coli/pv2pv1。
1.5 全細(xì)胞酶的誘導(dǎo)及催化特性分析
將獲得的菌接種(接種量為1%)于2mL含0.1μg/L Amp 的LB 培養(yǎng)基中,于37℃、220r/min 條件下培養(yǎng)過(guò)夜;取2mL 培養(yǎng)液轉(zhuǎn)接于100mL 含0.1μg/L Amp 的LB 培養(yǎng)基中,培養(yǎng)至OD600(在600nm 波長(zhǎng)處的吸光值)為0.6~0.8時(shí),加入0.1mL 500mmol/L的異丙基硫代半乳糖苷(IPTG) 至終濃度為0.5mmol/L,14℃誘導(dǎo)16h后離心收集濕菌體。
稱(chēng)取0.1g 濕菌體懸浮于1mL 磷酸鈉緩沖液(100mmol/L,pH=7.0)中,取0.3mL 100g/L菌懸液加到含0.65mL磷酸鈉緩沖液的2mL 環(huán)氧樹(shù)脂(EP)管中,20℃孵育5min 后加入50μL rac-oMGE(200 mmol/L,溶劑為甲醇)至終濃度為10mmol/L,20℃恒溫震蕩反應(yīng)10min,取150μL 樣品用1mL 乙酸乙酯萃取,有機(jī)相經(jīng)無(wú)水硫酸鎂干燥。樣品采用高效液相色譜儀(Waterse2695)、手性液相色譜柱(OD-H)和紫外檢測(cè)器(Waters2489)進(jìn)行分析。高效液相色譜條件為:流動(dòng)相為正己烷∶異丙醇=80∶20(體積比),柱溫30℃,流速為0.8mL/min,檢測(cè)波長(zhǎng)為220nm。(R)-oMGE、(S)-oMGE、(R)-oTPD和(S)-oTPD 的保留時(shí)間分別為6.69min、8.03min、8.83min和9.82min。
在上述測(cè)定條件下,酶活單位(U)定義為每分鐘消耗1μmol 的rac-oMGE 所需的酶量。全細(xì)胞比活力(U/g)計(jì)算公式如活性=C0×v×c/(t×m)所示。其中c為全細(xì)胞催化rac-oMGE的轉(zhuǎn)化率,%;C0為底物初始濃度,mmol/L;t 為反應(yīng)時(shí)間,min;v 為反應(yīng)體積,mL;m為濕細(xì)胞質(zhì)量,g。
底物的ees=(RS-SS)/(RS+SS)×100% 和產(chǎn)物eep=(SP-RP)/(SP+RP)×100%。其中RS和SS分別代表(R)-oMGE和(S)-oMGE的峰面積;RP和SP表示(R)-oTPD和(S)-oTPD 的峰面積。酶的對(duì)映選擇性用E 來(lái)評(píng)價(jià),E=ln[(1-c)(1-ees)]/ln[(1-c)(1+ees)],E值越高,則對(duì)映選擇性越高[10]。
區(qū)域選擇性系數(shù)αS和βR(圖1)可由線性回歸方程eep=(βS-αR)×ees×(1-c)/c+αR+βS-1進(jìn)行計(jì)算[11]。eep和ees×(1-c)/c 定義為因變量和自變量。通過(guò)測(cè)定酶催化rac-oMGE 水解過(guò)程中不同時(shí)間點(diǎn)的c、ees和eep,對(duì)上述線性方程進(jìn)行擬合,從而算得αR,βS。
1.6 Pv2Pv1的丙氨酸突變
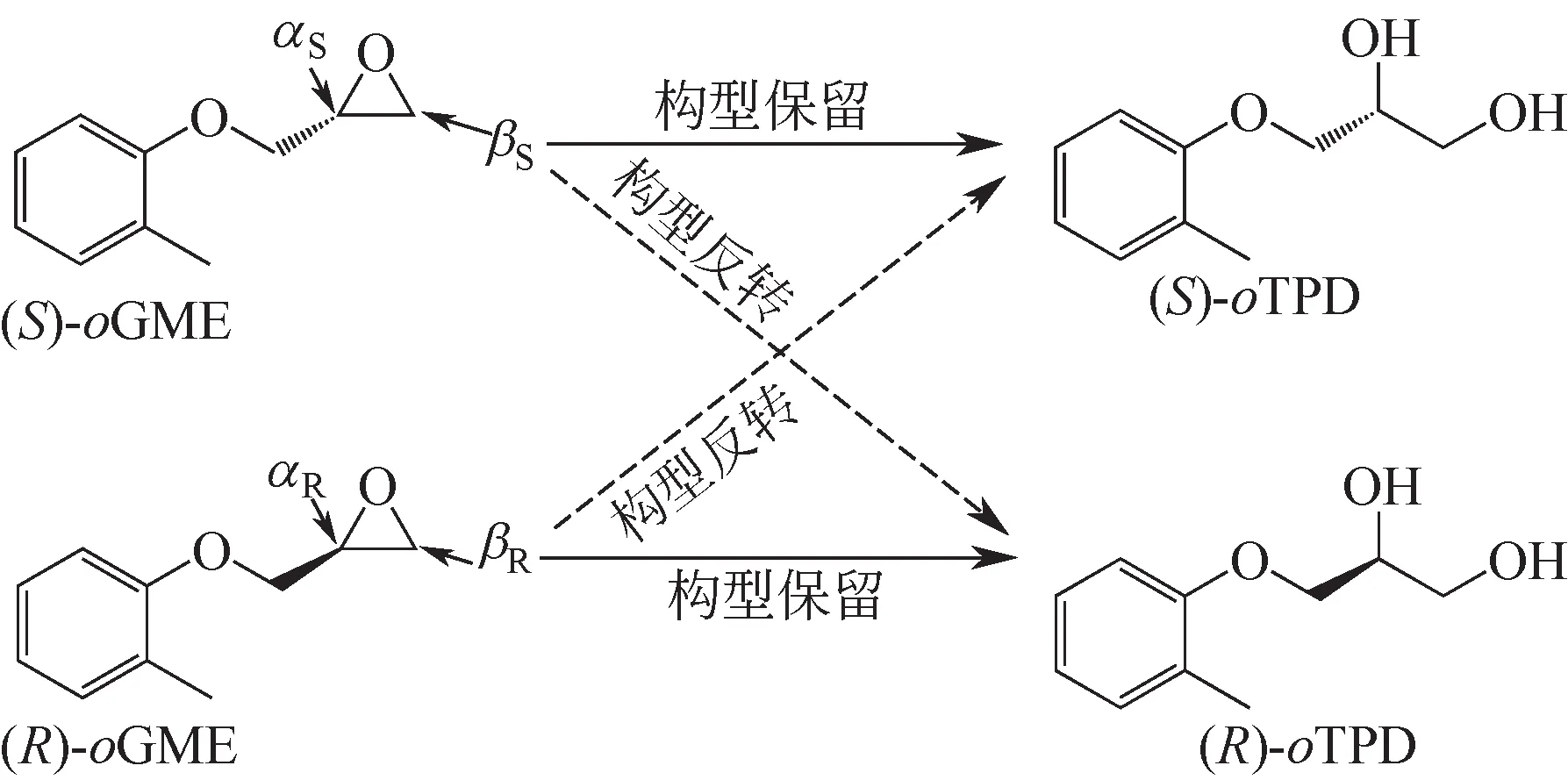
圖1 區(qū)域選擇性的示意圖
將Pv2Pv1 和另外4 種植物來(lái)源的EH 的一級(jí)結(jié)構(gòu)進(jìn)行同源序列比對(duì),找出非保守氨基酸(同源性≤60%)。根據(jù)1.3節(jié)方法對(duì)Pv2Pv1同源建模,再通過(guò)AutoDock4.2 軟 件(http://autodock.scripps.edu)進(jìn)行分子對(duì)接,用PyMOL 找出距離(R)-oMGE 8?以內(nèi)的非保守氨基酸,并通過(guò)兩輪全質(zhì)粒PCR 將這些氨基酸突變?yōu)楸彼幔ˋ)。根據(jù)相關(guān)文獻(xiàn)設(shè)計(jì)突變引物[10]。一輪PCR所用的上游引物為設(shè)計(jì)的突變引物,下游引物為通用引物pCold Ⅱ-R,預(yù)變性95℃,4min;變性98℃,10s;退火55℃,5s;延伸72℃,1min;從變性到延伸循環(huán)30 次,最后充分延伸,72℃,10min。二輪PCR 以一輪PCR 產(chǎn)物為引物,全質(zhì)粒為模板,除延伸時(shí)間變?yōu)?min,其他條件同第一輪。產(chǎn)物經(jīng)限制性內(nèi)切酶DpnI 消化后導(dǎo)入E. coli BL21(DE3),培養(yǎng)12h 后對(duì)轉(zhuǎn)化子進(jìn)行菌液PCR驗(yàn)證,并對(duì)陽(yáng)性轉(zhuǎn)化子進(jìn)行測(cè)序,將測(cè)序結(jié)果正確的轉(zhuǎn)化子命名為E.coli/pv2pv1突變位點(diǎn)。
1.7 分子對(duì)接分析
用ChemDraw Ultra 12.0 軟 件 (http://www.cambridgesoft.com/)構(gòu)建(R)-oMGE的三維結(jié)構(gòu)。參照1.3 節(jié)方法模擬Pv2Pv1 和Pv2Pv1K76A的三維結(jié)構(gòu)模 型。采 用AutoDock 4.2 將PvEH2、Pv2Pv1 和Pv2Pv1K76A分別與(R)-oMGE 進(jìn)行分子對(duì)接,通過(guò)Gromacs(http://www.gromacs.org/)進(jìn)行分子動(dòng)力學(xué)模擬,將生成的結(jié)合能最低的構(gòu)象作為最佳構(gòu)象,用PyMOL分析所得構(gòu)象。
1.8 E.coli/pv2pv1K76A水解高濃度rac-oMGE
為了確定E.coli/pv2pv1K76A水解動(dòng)力學(xué)拆分racoMGE的最大濃度,在10mL EP管中,用200mg/mL的E.coli/pv2pv1K76A催化不同濃度(80~180mmol/L)的rac-oMGE,反應(yīng)體系2mL,25℃反應(yīng)2~8h。測(cè)定ees、eep、YP和YS。在確定最大反應(yīng)濃度后,放大反應(yīng)體系至10mL,在25℃條件下用200mg/mL的E.coli/pv2pv1K76A水解150mmol/L 的rac-oMGE,定時(shí)進(jìn)行取樣監(jiān)測(cè),參照方法1.5用HPLC測(cè)定殘余的(R)-oMGE、(S)-oMGE 及生成的(R)-oTPD、(S)-oTPD 的濃度,并計(jì)算ees、eep、YP和YS,繪制反應(yīng)進(jìn)程曲線,同時(shí)計(jì)算時(shí)空產(chǎn)率[space-time yield, STY,表示在一定的反應(yīng)條件下,單位體積單位時(shí)間獲得目的產(chǎn)物總量,g/(L·h)[11]]。
2 實(shí)驗(yàn)結(jié)果與討論
2.1 PvEH2和PvEH1的三維結(jié)構(gòu)分析
實(shí)驗(yàn)室前期挖掘了兩種菜豆環(huán)氧化物水解酶,PvEH1 和PvEH2,它們均能對(duì)映選擇性水解racoMGE,優(yōu)先水解S構(gòu)型,保留R構(gòu)型。當(dāng)S構(gòu)型的底物水解完全時(shí)(ees>99%),所生成的(S)-oTPD的eep僅有8.3%和53.6%,其中全細(xì)胞酶E. coli/pveh1 對(duì)rac-oMGE 的活性為157.2U/g,遠(yuǎn)遠(yuǎn)高于E.coli/pveh2的4.1U/g[12-13]。
以PvEH2一級(jí)結(jié)構(gòu)為模板,在SWISS-MODEL網(wǎng)站找到一個(gè)同源性最高(80.06%)且功能已知的綠豆環(huán)氧化物水解酶(VrEH1,PDB∶5XMD.2),并以它為模板模擬PvEH2、PvEH1的三維結(jié)構(gòu)。結(jié)果顯示,PvEH2 和PvEH1 均屬于α/β 水解酶家族,催化三聯(lián)體為Asp-His-Asp 和兩個(gè)Tyr 質(zhì)子供體分別位于中心結(jié)構(gòu)域和蓋子結(jié)構(gòu)域(圖2)。其中蓋子環(huán)是蓋子結(jié)構(gòu)域中的一段可變環(huán),在不同的EH中,它的結(jié)構(gòu)差異很大,因而對(duì)EH的催化性質(zhì)影響很大[14]。PvEH2和PvEH1的蓋子環(huán)在結(jié)構(gòu)上有很大的差異,如圖2(b)。基于全細(xì)胞酶E.coli/pveh1的高酶活,期望通過(guò)蓋子環(huán)替換改善E.coli/pveh2 的酶活及其他催化性質(zhì)。

圖2 PvEH1和PvEH2的三維模擬結(jié)構(gòu)比對(duì)

表2 E.coli/pveh2及/pveh2cl1的相關(guān)催化性質(zhì)
2.2 Pv2Pv1的催化性質(zhì)分析
按1.4 節(jié)方法獲得了重組菌E. coli/pv2pv1,誘導(dǎo)表達(dá)收菌后,按1.5 節(jié)方法對(duì)其相關(guān)催化性質(zhì)進(jìn)行分析,其活性幾乎沒(méi)有發(fā)生變化,E值由23.0下降到15.1,當(dāng)?shù)孜锏膃es>99%時(shí),其產(chǎn)物(S)-oTPD的eep由E. coli/pveh2 的58.3%提高到75.5%,通過(guò)對(duì)區(qū)域選擇性系數(shù)的分析發(fā)現(xiàn),出現(xiàn)該現(xiàn)象的原因是αR由3.8%提升至42.4%。保留的(R)-oMGE 的產(chǎn)率(Ys) 有所降低,但是產(chǎn)物(S)-oTPD 的產(chǎn)率(Yp)由42.9%提高至58.4%(表2)。表明蓋子環(huán)替換后的Pv2Pv1,有一定的能力使(R)-oMGE 翻轉(zhuǎn)生成(S)-oTPD。
2.3 丙氨酸突變位點(diǎn)的選擇
運(yùn) 用AutoDock 4.2 對(duì)Pv2Pv1 和(R)-oMGE 進(jìn) 行分子對(duì)接,其結(jié)果如圖3(a)所示。距離底物8? 以內(nèi)的氨基酸殘基共計(jì)有32個(gè)[圖3(c)中“*”表示]。與其他4 種植物來(lái)源的EH 序列比對(duì),除去包括催化三聯(lián)體和兩個(gè)質(zhì)子供體在內(nèi)的17個(gè)保守位點(diǎn)和4個(gè)相對(duì)保守位點(diǎn),一共有11 個(gè)非保守氨基酸位點(diǎn):
I105、W129、P137、K175、L176A、N179、L187、P203、I238、S266 和M273[圖3(b)]。據(jù)報(bào)道,突變EH中的非保守氨基酸,能很好地改善其催化性質(zhì),如Li等[14]通過(guò)突變PvEH3中的非保守氨基酸,將產(chǎn)物對(duì)氯苯基乙二醇的eep由85.1%提高至93.2%,Kong等[15]通過(guò)在BmEH的催化活性中心附近進(jìn)行丙氨酸突變,大大地提高了其對(duì)α-萘基縮水甘油醚的活性和對(duì)映選擇性。因此,本研究選擇將以上11個(gè)非保守氨基酸突變?yōu)楸彼帷?/p>
2.4 丙氨酸突變子的催化特性分析
按1.6節(jié)方法獲得11個(gè)丙氨酸突變子,用全細(xì)胞催化反應(yīng),按1.5 節(jié)方法測(cè)定各突變子對(duì)racoMGE 的催化特性。如表3 所示,11 個(gè)突變子中,E.coli/pv2pv1K176A的催化性能綜合表現(xiàn)最為優(yōu)越,與E.coli/pv2pv1 相比,催化性能得到明顯提升,活性由4.2U/g提高至8.7U/g,提高了2.1倍。當(dāng)S構(gòu)型的底物剛好反應(yīng)完全時(shí),R 構(gòu)型的鄰二醇的eep由75.5% 提高至80.3%,產(chǎn)率也由58.4% 提高至61.9%。經(jīng)測(cè)定,區(qū)域選擇性系數(shù)βS=4.6%,αR=52.2%,αR相對(duì)于Pv2Pv1提高了9.8%。

表3 丙氨酸突變子對(duì)rac-oMGE的催化特性分析
2.5 分子對(duì)接分析區(qū)域選擇性提高原理
為了從分子水平了解Pv2Pv1及Pv2Pv1K176A區(qū)域選擇性系數(shù)αR提高的原理,運(yùn)用AutoDock 4.2 將PvEH2、Pv2Pv1、Pv2Pv1K176A與(R)-oMGE 進(jìn) 行 對(duì)接,對(duì)接后的局部放大圖如圖4。根據(jù)Reetz等[16-17]關(guān)于EH催化機(jī)理的研究:位于活性中心的天冬氨酸的O原子通過(guò)攻擊環(huán)氧環(huán)上的C原子,從而使環(huán)氧環(huán)斷開(kāi),其中,天冬氨酸中的氧到環(huán)氧環(huán)中Cα原子的空間距離dα是一個(gè)關(guān)鍵參數(shù),dα越短,Cα越容易受到O 原子的攻擊,其αR值越大。PvEH2 的dα=4.5?,經(jīng)過(guò)蓋子環(huán)的替換后,dα變?yōu)?.1?,在上述的實(shí)驗(yàn)檢測(cè)中,其對(duì)應(yīng)的αR值由3.8%提高到42.4%,丙氨酸突變后dα進(jìn)一步縮短為2.9?,αR進(jìn)一步變?yōu)?2.2%。對(duì)接分析結(jié)果和實(shí)驗(yàn)測(cè)量結(jié)果相符。
2.6 E.coli/pv2pv1K176A水解高濃度rac-oMGE
為確定E.coli/pv2pv1K176A能水解rac-oMGE 的最大濃度,使用200mg/mL菌懸液分別拆分80mmol/L、100mmol/L、120mmol/L、150mmol/L 和180mmol/L的rac-oMGE。當(dāng)E. coli/pv2pv1K176A水解150mmol/L的rac-oMGE時(shí),5.0h水解完全,得到(R)-oMGE和(S)-oTPD 的產(chǎn)率YS和YP分別為32.5%和59.1%,相應(yīng)對(duì)應(yīng)體純度ees>99%,eep=80.9%。由于EH 存在底物或產(chǎn)物抑制的現(xiàn)象[4],當(dāng)rac-oMGE 的濃度達(dá)到180mmol/L 時(shí),即使反應(yīng)時(shí)間延長(zhǎng)至8.0h,ees仍然僅為70.3%。因此,確定E. coli/pv2pv1K176A水解rac-oMGE的最大底物濃度為150mmol/L。

圖3 Pv2Pv1與4種植物EH一級(jí)結(jié)構(gòu)的多序列比對(duì)

圖4 PvEH2、Pv2Pv1和Pv2Pv1K176AL與(R)-oMGE的分子對(duì)接模擬(1?=0.1nm)
用200mg/mL E. coli/pv2pv1K176A在10mL 體系中水解150mmol/L rac-oMGE。其水解反應(yīng)進(jìn)程圖5所示。在反應(yīng)5.0h 后,(S)-oMGE 完全水解完(ees>99%),得到(R)-oMGE的產(chǎn)率為32.5%,高于AnEH的29%,但低于TlEH 的40%,得到(R)-oMGE 的產(chǎn)率為32.7%,高于AnEH的29%,但低于TlEH的40%,STY為1.6g/(L·h),分別是AnEH和TlEH的6.7和2.4倍。(S)-oTPD 的產(chǎn)率為60.1%,eep為80.4%,均高于TlEH,STY為3.3g/(L·h),是TlEH的3.5倍[18-19]。

圖5 200mg/mL E.coli/pv2pv1K176A水解150mmol/L rac-oMGE的進(jìn)程圖
3 結(jié)論
(1)本研究通過(guò)FPCR,構(gòu)建了一種蓋子環(huán)替換的雜合酶Pv2Pv1,通過(guò)分析其催化性質(zhì),Pv2Pv1在水解rac-oMGE時(shí),當(dāng)S構(gòu)型的底物水解完全時(shí),得到的產(chǎn)物(S)-oTPD的產(chǎn)率和eep都有明顯升高。
(2)獲得11 個(gè)丙氨酸突變子,其中,E. coli/pv2pv1K176的酶活,(S)-oTPD的產(chǎn)率,eep都有進(jìn)一步的提升。通過(guò)分子對(duì)接分析發(fā)現(xiàn)相對(duì)于PvEH2 和Pv2Pv1,Pv2Pv1K176有著最短的dα,從而解釋了其區(qū)域選擇性系數(shù)αR提高的原因。
(3)用E.coli/pv2pv1K176水解高濃度rac-oMGE,發(fā)現(xiàn)其具有應(yīng)用于工業(yè)化生產(chǎn)的潛能,同時(shí)該酶也存在一定的缺陷,如酶活和產(chǎn)物(S)-oTPD 的eep還有進(jìn)一步的提升空間,今后可以通過(guò)定向進(jìn)化的手段對(duì)其催化性能進(jìn)行進(jìn)一步的優(yōu)化和改造。

