基于金屬標(biāo)記ICP-MS免疫分析的放大策略研究進(jìn)展
李祎璠 趙珍陽(yáng) 杜 康 孫傳強(qiáng) 龔子珊 張 勇 王世功 汪 曣*
(1.天津大學(xué) 精密儀器與光電子工程學(xué)院,天津 300072;2.山東東儀光電儀器有限公司,煙臺(tái) 264000)
1 引言
蛋白質(zhì)定量在生物學(xué)研究中具有重要意義,蛋白質(zhì)表達(dá)水平的變化控制著生物細(xì)胞或生物體中的許多特殊功能[1]。目前,基于抗體的免疫分析是特異性蛋白定量的主要手段。1959年,放射免疫分析法(RIA)由Yallow等[2]建立,通過(guò)放射性同位素標(biāo)記抗體,但該方法存在放射性健康危害、廢物處理等問(wèn)題。之后提出的一些非放射性免疫分析方法,在過(guò)去幾十年中已成功地應(yīng)用在分子檢測(cè)上,包括酶聯(lián)免疫分析法(ELISA)[3]、時(shí)間分辨熒光免疫分析(TRFIA)[4]、化學(xué)發(fā)光免疫分析(CLIA)[5]、和電化學(xué)發(fā)光免疫分析(ECLIA)[6]等,但這些方法在動(dòng)態(tài)范圍、靈敏度、分辨率等問(wèn)題上仍受到明顯的限制[7]。
電感耦合等離子體質(zhì)譜(ICP-MS)作為測(cè)定多種金屬和幾種非金屬最主要也最靈敏的商業(yè)化儀器[8],其優(yōu)點(diǎn)包括檢測(cè)限低、基質(zhì)效應(yīng)低、動(dòng)態(tài)范圍寬等[9]。因此,基于ICP-MS的免疫分析法[10]自2001年首次提出以來(lái),已成為免疫檢測(cè)領(lǐng)域一個(gè)快速發(fā)展的研究方向。該方法的優(yōu)點(diǎn)包括:(1)易于通過(guò)信號(hào)放大手段進(jìn)一步提高檢測(cè)靈敏度;(2)ICP-MS是對(duì)標(biāo)簽上的原子直接進(jìn)行檢測(cè),因此檢測(cè)與標(biāo)記物的光學(xué)、電學(xué)、磁性等性質(zhì)無(wú)關(guān);(3)ICP-MS在元素的檢測(cè)上的良好分辨率使其擁有了實(shí)現(xiàn)多組分同時(shí)檢測(cè)的可能。
目前已經(jīng)實(shí)現(xiàn)了小分子、蛋白質(zhì)、核酸以及單細(xì)胞等生物樣品的檢測(cè)[11]。本文綜述了ICP-MS免疫分析的主要發(fā)展和應(yīng)用,以各項(xiàng)技術(shù)的發(fā)展順序?yàn)榫€索,著重介紹其中的信號(hào)放大策略,并討論不同技術(shù)的優(yōu)點(diǎn)和局限性。
2 ICP-MS免疫分析方法的信號(hào)放大策略
2.1 基于ICP-MS的免疫分析方法簡(jiǎn)介
1980年,Houk等[12]首次采用將電感耦合等離子體作為離子源與質(zhì)譜技術(shù)結(jié)合,三年后誕生了第一臺(tái)商用電感耦合等離子體質(zhì)譜(ICP-MS)。如圖1所示,ICP-MS通常由進(jìn)樣系統(tǒng)、ICP源和質(zhì)量檢測(cè)器組成。樣品(通常為液體)被泵入進(jìn)樣系統(tǒng),形成氣溶膠,之后通過(guò)ICP炬管,在等離子體的不同加熱區(qū)被干燥、蒸發(fā)、霧化和電離。在此過(guò)程中高效的離子產(chǎn)生、提取和傳輸賦予了ICP-MS特有的超快檢測(cè)能力。典型的ICP-MS(配備四極桿質(zhì)量分析器)可以以高靈敏度同時(shí)檢測(cè)100多種同位素,分辨率在0.7~1.0個(gè)原子單位。
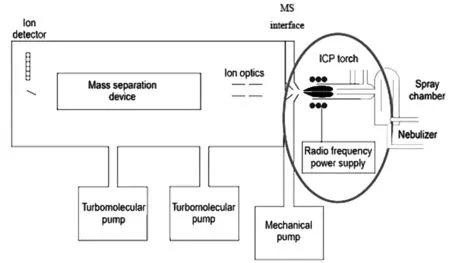
圖1 典型的ICP-MS系統(tǒng)示意圖[13]
為了獲得免疫分析的特異性,標(biāo)記試劑通常需要費(fèi)力的設(shè)計(jì)與合成,極大限制了其可用性,不僅價(jià)格高昂,而且難以維持穩(wěn)定性。并且,只有對(duì)大量的生物標(biāo)志物的綜合調(diào)查才能提供準(zhǔn)確的臨床診斷,因此迫切需要高靈敏度和同時(shí)多組分免疫分析的研究。
2.2 元素標(biāo)記結(jié)合ICP-MS免疫分析
抗體能被ICP-MS有效檢測(cè)的前提是在其上進(jìn)行元素標(biāo)記[14]。2001年,Zhang等開創(chuàng)性地報(bào)道了基于ICP-MS和元素標(biāo)記免疫分析聯(lián)用的方法,定量檢測(cè)抗促甲狀腺激素(TSH)[15]和總甲狀腺素(T4)[16](如圖2)。使用常用于TRFIA中的元素標(biāo)簽,通過(guò)ICP-MS檢測(cè),得到了與RIA和CLIA方法具有良好一致性的定量結(jié)果,證明了該方法在競(jìng)爭(zhēng)和夾心免疫體系中的有效性。
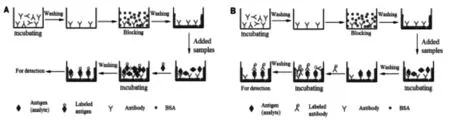
圖2 非均相免疫分析的兩種形式
與固相載體(如微孔板)相比,將磁納米顆粒作為反應(yīng)載體能夠進(jìn)一步的提高檢測(cè)靈敏度。免疫磁球由于其較大的比表面積、較快的反應(yīng)動(dòng)力學(xué)等特點(diǎn),適用于快速、靈敏的免疫反應(yīng)[17]。Peng等[18]提出了基于汞離子標(biāo)記磁性免疫分析的ICP-MS檢測(cè)方法,檢測(cè)人血清癌胚抗原(CEA),并使用體積排阻色譜(SEC)分離標(biāo)記汞離子的抗體和過(guò)量汞標(biāo)記,結(jié)果與CLIA具有一致性。
在ICP-MS細(xì)胞分析領(lǐng)域,質(zhì)譜流式細(xì)胞儀的出現(xiàn)具有重要意義。2009年,Bandura等開發(fā)了質(zhì)譜流式細(xì)胞儀ICP-TOF-MS(CyTOFFM,DVS公司),通過(guò)不同稀土元素標(biāo)記的抗體對(duì)白血病細(xì)胞株和白血病人單細(xì)胞表面20種抗原實(shí)現(xiàn)了同時(shí)檢測(cè)。
在數(shù)據(jù)處理和誤差補(bǔ)償方面,研究者們也做了大量工作。2018年,Zhang等[17]使用Sm和Y元素標(biāo)記建立了一種基于ICP-MS的競(jìng)爭(zhēng)免疫分析比值定量法,使用Y標(biāo)簽修飾抗體作為內(nèi)標(biāo),Sm結(jié)合抗原與待測(cè)β2-微球蛋白抗原競(jìng)爭(zhēng)性結(jié)合,取兩種元素的比值作為量化信號(hào),補(bǔ)償了操作過(guò)程中的粒子損失,提高了定量結(jié)果的精度,檢出限為0.17 μg/mL。
早期用于ICP-MS免疫分析方法的元素離子標(biāo)記物主要來(lái)自傳統(tǒng)的免疫測(cè)定方法,如表1所示,標(biāo)記元素應(yīng)對(duì)ICP-MS有高靈敏度,并具有低的同質(zhì)異位素干擾[19]。然而,大環(huán)化合物的高空間位阻、汞化合物的高毒性等問(wèn)題,需要通過(guò)研究針對(duì)ICP-MS免疫方法設(shè)計(jì)的特殊標(biāo)簽來(lái)解決。
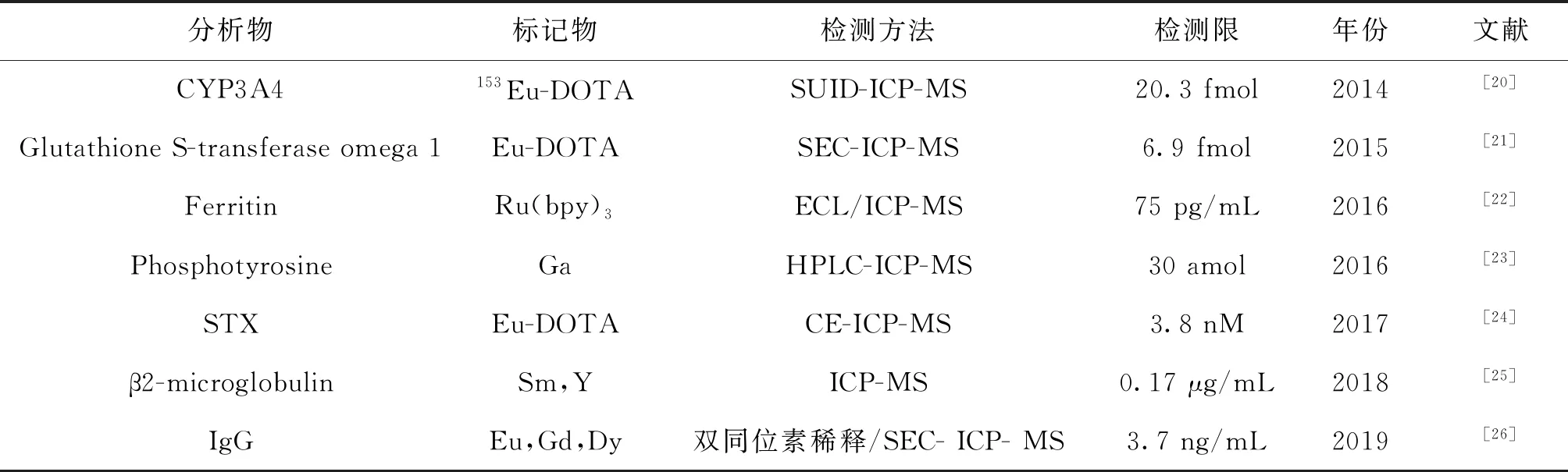
表1 元素標(biāo)記結(jié)合ICP-MS免疫分析的應(yīng)用
2.3 納米顆粒標(biāo)記結(jié)合ICP-MS免疫分析
使用納米粒子標(biāo)記放大檢測(cè)信號(hào)引起了許多學(xué)者的興趣,其優(yōu)點(diǎn)在于:每個(gè)納米顆粒6標(biāo)簽中包含大量可檢測(cè)原子(以金納米顆粒為例,10nm直徑的AuNPs中含有約30000個(gè)Au原子),易于進(jìn)一步提高抗體檢測(cè)的靈敏度。2002年,Zhang等[27]建立了膠體金納米顆粒標(biāo)記抗體應(yīng)用與夾心免疫反應(yīng)的方法,使用標(biāo)記過(guò)的羊抗兔免疫球蛋白G(IgG)測(cè)定兔抗人IgG,檢出限為0.4ng/mL。
同年,Quinn等[28, 29]使用金納米團(tuán)簇和Eu作為標(biāo)記,每個(gè)1.4nm的金團(tuán)簇包含大約70個(gè)金原子,將離心過(guò)濾、體積排阻凝膠過(guò)濾、蛋白質(zhì)瓊脂糖A親和色譜和酶聯(lián)免疫吸附分析四種方法與ICP-MS連用,實(shí)現(xiàn)了復(fù)雜生物基質(zhì)中兩種蛋白質(zhì)的同時(shí)檢測(cè)。作者指出,使用金納米顆粒的潛在缺點(diǎn)是金對(duì)典型的ICP-MS樣品引入系統(tǒng)具有較高的表面親和力,然而實(shí)驗(yàn)觀察到在樣品中存在蛋白質(zhì)時(shí)這種效應(yīng)顯著降低,可能是由于表面的絡(luò)合或鈍化作用。
將納米顆粒標(biāo)記與其他方法聯(lián)用可以在信號(hào)放大的同時(shí)獲得更好的信號(hào)穩(wěn)定性和靈敏度。如圖3所示,Ko等[30]使用金納米顆粒作為標(biāo)記物,使用摻雜有Cs和FITC的多核磁性納米顆粒(MMNP)用于磁分離,特異性的提取血清中的CA19-9,并且將摻雜的Cs用作標(biāo)記顆粒的比率測(cè)量的內(nèi)標(biāo)。這種比率法補(bǔ)償了磁分離中的顆粒損失,并抑制了信號(hào)波動(dòng),顯著提高了校準(zhǔn)線性度。該方法檢測(cè)限為0.02 U/mL,比使用元素標(biāo)記的ICP-MS報(bào)道方法的檢測(cè)限低300倍以上,與ELISA相比提高約500倍。Liu等[31, 32]使用銀增強(qiáng)-金納米離子標(biāo)記的方法,檢測(cè)人癌胚抗原CEA,檢出限低至0.03ng/mL,經(jīng)過(guò)15分鐘的信號(hào)放大程序,將檢測(cè)靈敏度提高了60倍。

圖3 量子點(diǎn)標(biāo)記免疫反應(yīng)示意圖[30]
使用傳統(tǒng)ICP-MS積分模式檢測(cè)方法來(lái)分析納米粒子只能實(shí)現(xiàn)單分子檢測(cè),不夠靈敏,而使用時(shí)間分辨模式(SP-ICP-MS)有望進(jìn)一步提高靈敏度。2009年,Zhang等[33, 34]首次證明了通過(guò)SP-ICP-MS可以實(shí)現(xiàn)單納米粒子標(biāo)記的免疫分析,并證明了該方法可以用于競(jìng)爭(zhēng)和非競(jìng)爭(zhēng)免疫分析(對(duì)AFP的檢出限達(dá)到了0.016ng/mL,對(duì)兔抗人IgG的檢出限達(dá)到了0.1ng/mL)。同時(shí),討論了不同直徑金納米顆粒的信號(hào)特征,與傳統(tǒng)積分模式進(jìn)行對(duì)比,證明了該方法可以實(shí)現(xiàn)更高靈敏度的免疫分析。
另外,量子點(diǎn)也可以作為ICP-MS免疫分析的標(biāo)記物。Hu等報(bào)道了使用CdSe NPs[35]和PbS NPs[36]標(biāo)簽用于ICP-MS免疫分析。提出了用CdSe NPs標(biāo)簽和微同心霧化器(MCN)ICP-MS結(jié)合免疫親和整體毛細(xì)管微萃取(CME)測(cè)定人血清中IgG的方法,給出基于Cd信號(hào)的檢出限為0.058 ng/mL,基于Se信號(hào)的檢出限為0.097 ng/mL。另外,在PbS NPs標(biāo)記后,采用微流控芯片磁性免疫分析法法結(jié)合電熱蒸發(fā)(ETV) ICP-MS法測(cè)定CEA,方法檢出限為0.058 ng/mL。研究表明[37],ICP-MS檢測(cè)方法能夠降低基質(zhì)效應(yīng),并減輕量子點(diǎn)表面非特異性吸附影響(表2)。

表2 納米粒子標(biāo)記結(jié)合ICP-MS免疫分析的應(yīng)用
2.4 金屬聚合物結(jié)合ICP-MS免疫分析
金屬聚合物標(biāo)簽可以包含多個(gè)給定離子,ICP-MS信號(hào)隨著給定元素原子的數(shù)量線性增加,極大地提高了免疫分析的靈敏度,并且動(dòng)態(tài)范圍廣、復(fù)雜基質(zhì)干擾小。2007年,Lou等[46]開發(fā)了一種帶有多種金屬螯合配體的水溶性聚合物作為標(biāo)記物,如圖4a所示,每條鏈帶有33個(gè)鑭系金屬離子,同時(shí)測(cè)定兩種細(xì)胞表面上的5種抗體,這些抗體的豐度相差超過(guò)兩個(gè)數(shù)量級(jí)。2010年,Majonis等[47]合成了用于抗體標(biāo)記的第二代金屬螯合聚合物,如圖4b所示,使用這種含有大量DTPA基團(tuán)和Mal的聚合物在小鼠抗人IgG上標(biāo)記了159Tb,ICP-MS檢測(cè)結(jié)果顯示每個(gè)抗體上含有161±4個(gè)159Tb,等溫滴定量熱法(ITC)結(jié)果顯示一個(gè)抗體上含有2.4±0.3個(gè)聚合物。將這種金屬螯合物用于11重單細(xì)胞分析,鑒定并豐富了人臍帶血中的不同細(xì)胞群。

圖4 圖名
2014年,Bruckner等[48]用DOTA標(biāo)記的氨基酸作為結(jié)構(gòu)單元,合成了多肽作為稀土元素探針。使用的固相多肽合成法(SPPS)是一種寡聚多肽的合成方法,其合成標(biāo)記物只有4個(gè)DOTA結(jié)構(gòu)單元。盡管探針數(shù)量相對(duì)較低,但SPPS方法能夠保證每個(gè)標(biāo)記物上可絡(luò)合確定數(shù)目的稀土離子,從而用于生物大分子的精準(zhǔn)定量(表3)。
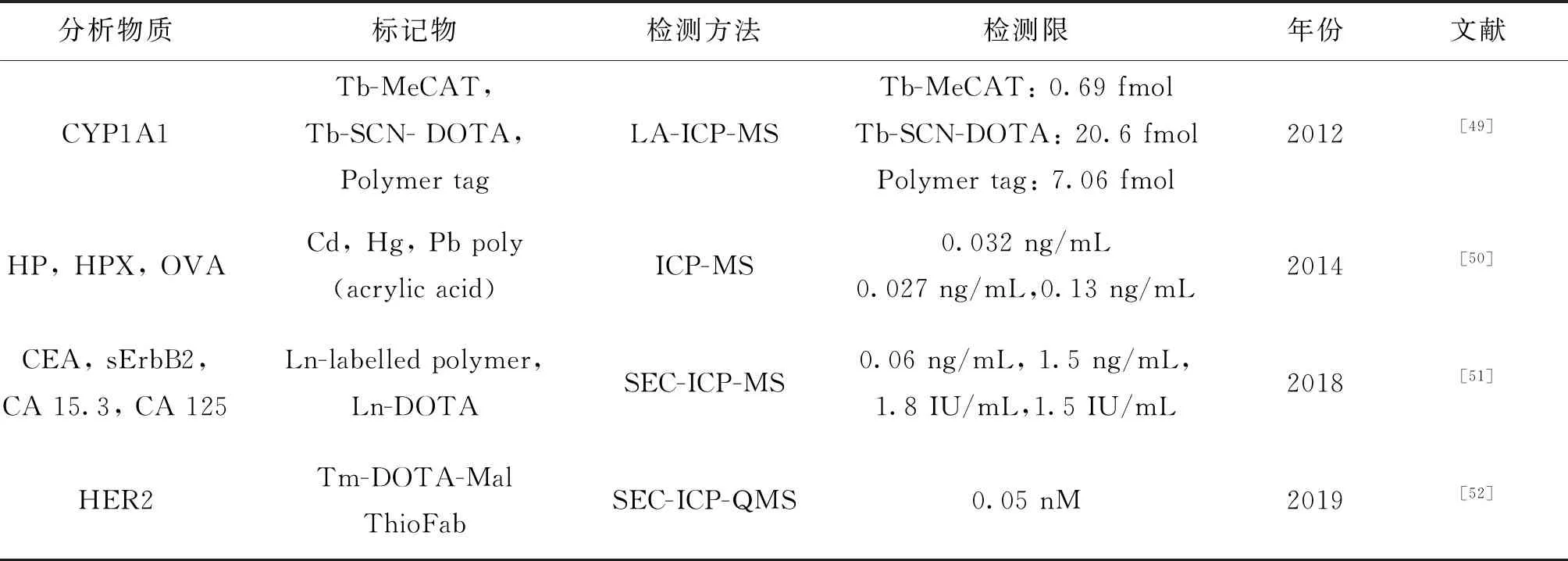
表3 金屬聚合物標(biāo)記結(jié)合ICP-MS免疫分析的應(yīng)用
2.5 擴(kuò)增技術(shù)結(jié)合ICP-MS免疫分析
傳統(tǒng)元素標(biāo)記方法結(jié)合DNA擴(kuò)增技術(shù)能夠很好的提高ICP-MS的檢測(cè)靈敏度。最為普遍的放大反應(yīng)包括聚合酶鏈?zhǔn)椒磻?yīng)(PCR)、滾環(huán)擴(kuò)增反應(yīng)(RCA)、雜交鏈?zhǔn)椒磻?yīng)(HCR)等,都已有基于ICP-MS的分析方法報(bào)道[53]。
2014年,Brukner等[55]使用DNA連接酶擴(kuò)增和磁性微球分離,利用Tb標(biāo)記DNA探針,對(duì)DNA的檢出限達(dá)到2.6 amol,與傳統(tǒng)無(wú)擴(kuò)增DNA檢測(cè)法的靈敏度提高了6000倍。2018年,Zhang等[54]提出了基于禽流感病毒(AIV)表面上凝集素ConA和糖蛋白之間的選擇性識(shí)別和雜交鏈?zhǔn)椒磻?yīng)(HCR)信號(hào)放大的ICP-MS病毒粒子分析方法,如圖5所示,以H9N2為模型,由于AuNPs和HCR的雙重?cái)U(kuò)增效應(yīng),檢出限降至0.12 ng/mL,與ELISA方法相比,檢出限提高了兩個(gè)數(shù)量級(jí),并且避免了耗時(shí)的病毒裂解和蛋白質(zhì)或核酸提取程序。2019年,Li等[56]報(bào)道了一種用于計(jì)數(shù)循環(huán)腫瘤細(xì)胞(CTC)的方法,通過(guò)結(jié)合滾環(huán)擴(kuò)增(RCA)和金納米顆粒(Au NPs)標(biāo)記,利用ICP-MS及雙重放大策略實(shí)現(xiàn)了3HepG2細(xì)胞(15 細(xì)胞/mL)的最低檢測(cè)限,與不使用RCA的Au NPs標(biāo)記方法相比,靈敏度提高了756倍(表4)。
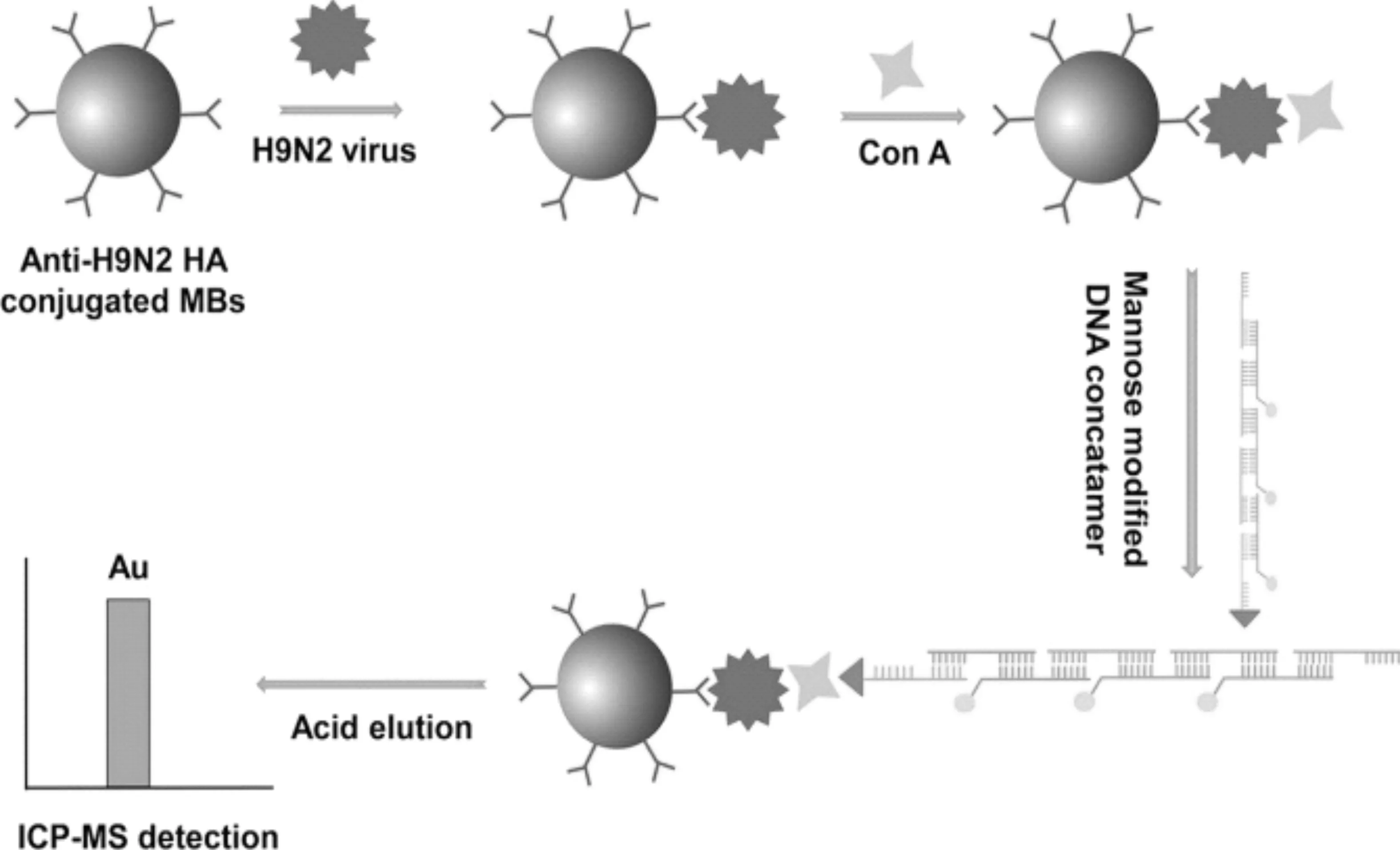
圖5 H9N2病毒免疫分析示意圖[54]

表4 擴(kuò)增技術(shù)結(jié)合ICP-MS免疫分析的應(yīng)用
3 總結(jié)與展望
縱觀ICP-MS的免疫分析技術(shù)的發(fā)展歷程,從放射元素、金屬螯合物到骨架聚合物、再到納米粒子標(biāo)記,同時(shí)伴有單顆粒檢測(cè)模式以及擴(kuò)增方法的引入,始終不變的前進(jìn)方向是放大檢測(cè)信號(hào)、提高檢測(cè)方法靈敏度。在這幾種方法中,最容易實(shí)現(xiàn)的是納米顆粒標(biāo)記法,在其他免疫分析手段中常用的標(biāo)記物如納米金、納米銀、氧化物納米顆粒、量子點(diǎn)等,即使不針對(duì)ICP-MS進(jìn)行優(yōu)化也可以取得更好的檢測(cè)靈敏度,并且通過(guò)單顆粒檢測(cè)模式(SP-ICP-MS)可以克服粒徑不均一和溶解元素干擾測(cè)定的問(wèn)題。聚合物標(biāo)記物的主要優(yōu)點(diǎn)在于放大倍數(shù)精確可控、結(jié)構(gòu)穩(wěn)定、基質(zhì)效應(yīng)低,但總的放大倍數(shù)不如其他方法高。擴(kuò)增技術(shù)在核酸和細(xì)胞檢測(cè)領(lǐng)域具有重要的應(yīng)用價(jià)值,且方法較為成熟,目前是發(fā)展最快的一個(gè)方向。
對(duì)于生物分析來(lái)說(shuō),高敏分析方法的進(jìn)步更有助于闡明微觀水平(單個(gè)細(xì)胞或亞細(xì)胞水平甚至單分子水平[61])上的生命活動(dòng)過(guò)程和機(jī)制,因此不斷開發(fā)出靈敏度更高的分析方法具有重要的意義。基于ICP-MS的高靈敏度免疫分析可以降低對(duì)樣本量的要求,實(shí)現(xiàn)微量樣本的檢測(cè),對(duì)于臨床疾病的預(yù)防和診斷也有著重要的作用。

