富勒烯在納米生物醫學領域中的應用
邵磊厚 劉珊珊 黃雯雯 張 梅 劉偉麗 馬博凱
(北京市理化分析測試中心,有機材料檢測技術與質量評價北京市重點實驗室,北京 100089)
富勒烯是由Kroto 等人于1985年首次發現,三位科學家也因此榮獲1996年諾貝爾化學獎,它的發現也極大地促進了納米技術的發展[1]。富勒烯的結構特點賦予其獨特的物理化學性能,使其在催化、環境、能源和生物醫藥等領域展現出巨大的應用潛力。富勒烯作為碳納米材料家族的同素異形體之一,是由sp2雜化的碳原子構成,具有高度的對稱性、獨特的表面特性和不同的尺寸特征(C60、C76等)[2]。其中,C60是合成和研究最多的富勒烯材料,具有球形32面體結構,由包含C-C單鍵(12個五邊形)和C-C雙鍵(20個六邊形)的60個碳原子組成[3-5]。富勒烯具有抗氧化活性、抗菌活性、光動力活性和細胞保護作用等多種生物學效應,可以作為藥物載體用于藥物遞送,作為良好的光敏劑用于光動力治療,在納米生物醫學領域發揮了重要作用。本文著重綜述了近年來富勒烯在納米生物醫學領域中的應用進展,并對其未來發展進行了展望。
1 藥物載體
惡性腫瘤是人類健康的主要威脅之一,是由體內變異細胞無限增值導致的一種疾病[6]。惡性腫瘤的治療方式主要有:外科手術、放射治療和化學治療。其中,化學治療主要是通過口服或者注射給藥的方式利用化學藥物治療惡性腫瘤一種治療手段。化學治療面臨的一大挑戰就是缺乏特異性,容易造成明顯的毒副作用。其次,腫瘤細胞的耐藥性,需要更大劑量的藥物或者更多種類的藥物,這進一步增加了化學治療的毒副作用。納米技術的發展為克服化學藥物治療的局限性提供了新的思路,可以顯著提高藥物的遞送效率,減小毒副作用[7]。富勒烯材料獨特的碳籠結構特征使其有望成為良好的藥物載體用于藥物遞送。腫瘤組織增強的滲透和滯留效應(enhanced permeability and retention,EPR)使得納米藥物載體可以通過被動靶向的方式相比于化學藥物分子更好的在腫瘤部位累積。其次,富勒烯的表面結構可以通過連接多種基團進行功能化改性,不僅可以實現主動靶向給藥的目的,進一步提高藥物遞送效率,而且可以改善富勒烯的生物相容性[8]。
富勒烯作為藥物載體,不僅可以通過非共價鍵相互作用對藥物分子進行負載,也可以通過共價鍵連接負載藥物分子。化學治療藥物阿霉素(doxorubicin)作為臨床常用的廣譜抗癌藥物之一,對乳腺癌、卵巢癌等多種癌癥都具有一定的治療效果。但是,其使用過程中會造成明顯的毒副作用,例如心臟毒性。Grebinyk等[9]將富勒烯與阿霉素通過非共價鍵的方式結合制備得到一種基于富勒烯的納米藥物復合物(圖1a)。實驗結果表明,這種納米藥物復合物具有良好的穩定性,富勒烯可以高效的將阿霉素遞送到腫瘤細胞中,促進腫瘤細胞對于阿霉素的攝取,并可以在腫瘤細胞中實現很好的藥物釋放,實現高效的治療效果,從而可以顯著降低藥物的毒副作用。另一項研究工作中,Zakharian等[10]將天然抗癌藥物分子紫杉醇(paclitaxel)通過共價連接的方式與富勒烯組合成一種新型納米藥物復合物(圖1b)。實驗結果表明,這種納米藥物復合物具有酶響應以及緩釋的釋放行為,并且針對肺癌細胞顯示出高效的治療效果。
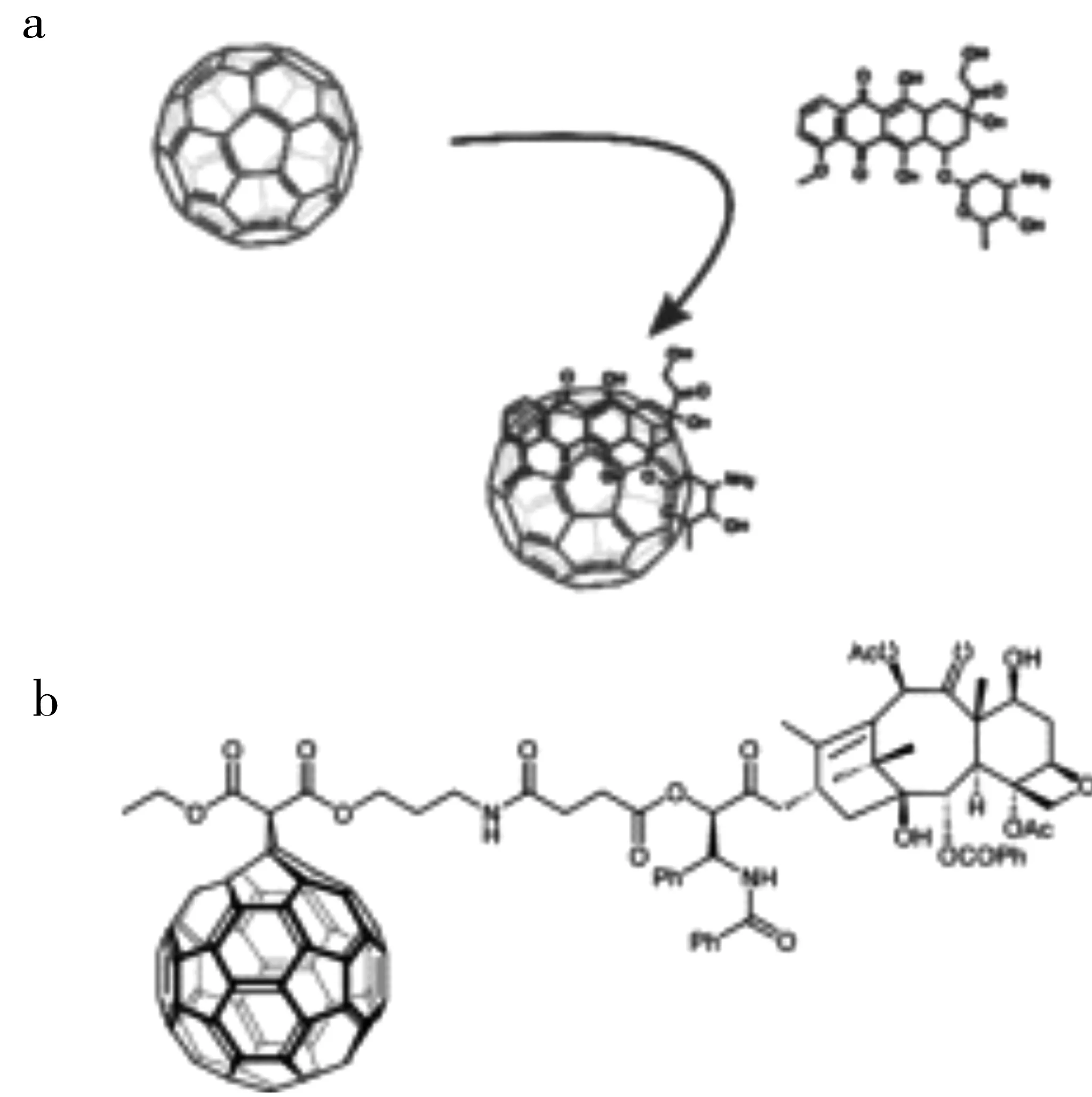
圖1 富勒烯負載阿霉素[9]和紫杉醇[10]示意圖
此外,富勒烯進行表面共價基團連接還可以實現主動靶向的功能。主動靶向是基于配體和受體的特異性結合,從而實現特定部位靶向給藥的目的。透明質酸的受體CD44在多種腫瘤細胞中高表達,因此經透明質酸修飾后的藥物載體可以與高表達CD44的腫瘤細胞特異性結合,從而實現主動靶向的功能。Kwag等[11]通過共價連接的方式制備得到一種透明質酸化的富勒烯材料,具有優異的水溶性、光敏性、近紅外熒光性質和腫瘤特異靶向性(圖2a)。體內熒光成像實驗結果表明,接種有CD44高表達腫瘤的小鼠(CD44+)靜脈注射透明質酸化的富勒烯材料4 h后可以檢測到強烈的熒光信號,且信號強度隨著時間的延長逐漸增加,與之對比,另一組小鼠(CD44-)的腫瘤部位則顯示出較弱的熒光信號,說明相對于依靠EPR效應被動靶向累積至腫瘤組織來說,通過與腫瘤細胞表面CD44受體特異性結合的主動靶向給藥方式可以使得納米藥物復合物更有效地積聚到腫瘤組織中。Shi等[12]通過共價連接的方式修飾上靶向分子葉酸,隨后進一步通過非共價相互作用負載藥物分子多西他賽(DTX),得到一種具有主動靶向功能的納米藥物遞送體系(圖2b)。多種腫瘤細胞都高表達葉酸受體,因此葉酸修飾后的藥物載體可以特異性識別腫瘤細胞高表達的葉酸受體。實驗結果表明,與裸藥DTX相比,這種納米藥物遞送體系可以更好的被腫瘤細胞所攝取,誘導更多的腫瘤細胞的死亡。進一步的體內實驗表明,DTX經藥物載體負載可以有效的延長血液循環時間,實現更高效的腫瘤部位的累積,保證高療效的同時對小鼠正常器官沒有造成明顯的毒副作用。

圖2 透明質酸[11]和葉酸[12]功能化的富勒烯示意圖
血腦屏障(blood-brain barrier,BBB)是由內皮緊密連接組成的物理屏障,可以阻止有害物質通過血液到達腦組織,也是中樞神經系統(central nervous system,CNS)給藥面臨的最大挑戰[13]。有研究指出,富勒烯材料可以跨過血腦屏障進入到大腦組織,這使其在中樞神經系統藥物遞送中具有巨大的應用潛力[14,15]。Piotrovskiy等[16]制備了基于富勒烯的六甲銨藥物復合物。單獨的六甲銨分子對于中樞神經系統的滲透能力有限,所以需要在比較高的給藥劑量下才能取得理想的治療效果。與單獨的六甲銨藥物治療組對比發現,在相同的給藥劑量下,富勒烯與六甲銨藥物復合物的療效大約提高了40倍,說明藥物復合物可以實現高效的中樞神經系統遞送效率。Hsieh等[17]制備了多種不同表面官能團改性的水溶性富勒烯衍生物。體內實驗表明,這些水溶性的富勒烯衍生物可以有效地穿越小鼠的血腦屏障,可以作為藥物載體用于大腦組織的藥物遞送(圖3a)。進一步的研究表明,不同的表面官能團改性決定了富勒烯的性質以及與中樞神經細胞和神經膠質瘤細胞的相互作用,產生神經保護或者抗腫瘤作用,從而可以用于治療中樞神經系統相關疾病(圖3b)。
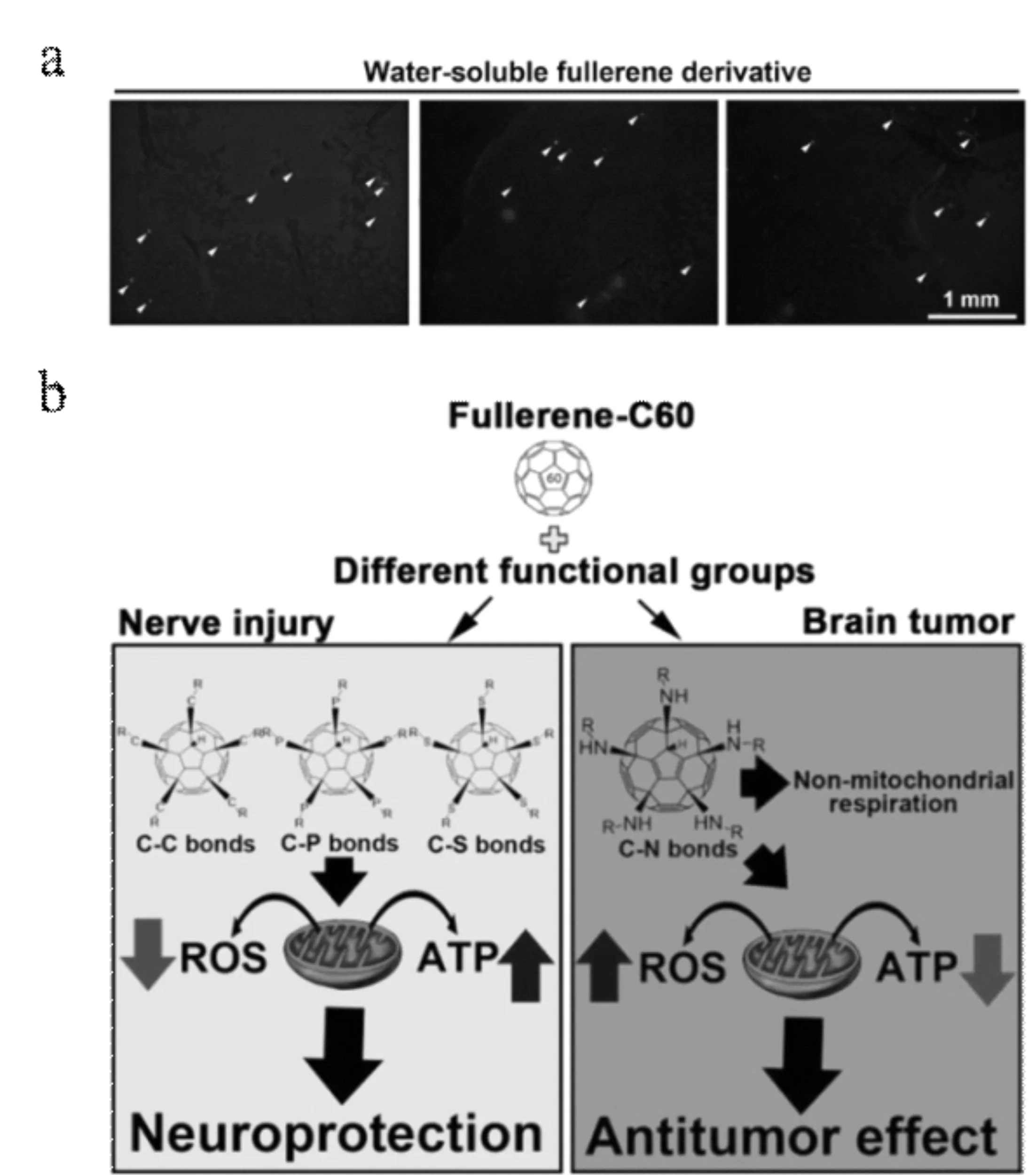
圖3 富勒烯穿越血腦屏障及其在中樞神經系統疾病中的應用示意圖[17]
2 光動力活性
光動力治療(photodynamic therapy,PDT)是一種依賴氧誘導細胞和組織效應的治療方式,基于目標組織中對于光敏劑(photosensitizer,PS)的吸收,特定波長的激光照射激活,光敏劑將光中的能量轉移至分子氧,進而產生活性氧(reactive oxygen species,ROS),隨后引起細胞凋亡和組織破壞[18,19]。這些反應只會發生在吸收有光敏劑的組織部位,對于光敏劑的生物學響應也只會在激光照射的組織特定區域發生。光動力治療以其安全可靠的療效,已經成為腫瘤治療的重要手段,在納米生物醫學領域發揮越來越重要的作用。基態富勒烯可以吸收光子能量,躍遷至壽命較短的激發單重態,激發單重態可以通過系間竄越的方式生成壽命較長的激發三重態。激發三重態的富勒烯可以通過發出磷光回到基態,也可以與基態的三線態氧(3O2)進行能量轉移從而生成單線態氧(1O2)或者通過電子轉移反應形成HO·、超氧化物和過氧化氫。這些ROS會破壞脂質、蛋白質和DNA,從而有效殺死腫瘤細胞和破壞腫瘤組織(圖4)[20-22]。與已有報道的光敏劑相比,富勒烯具有更高的量子產率,更加適用于光動力治療[23]。Tokuyama等[24]首次報道了在光照下,富勒烯材料能夠對腫瘤細胞的生長產生抑制作用。Tabata等[25]第一次研究了體內富勒烯材料的腫瘤光動力學治療效果。為了提高富勒烯的水溶性,對富勒烯進行了表面聚乙二醇(polyethylene glycol,PEG)功能化修飾(C60-PEG)。C60-PEG通過靜脈注射給藥的方式注射到接種有移植瘤的小鼠體內。實驗結果表明,相比于正常組織,C60-PEG可以更好的富集至腫瘤部位,并且具有較長的滯留時間。腫瘤部位經過可見光照射后,注射有C60-PEG的小鼠的腫瘤生長得到明顯抑制,并且對于上皮組織沒有造成損傷。
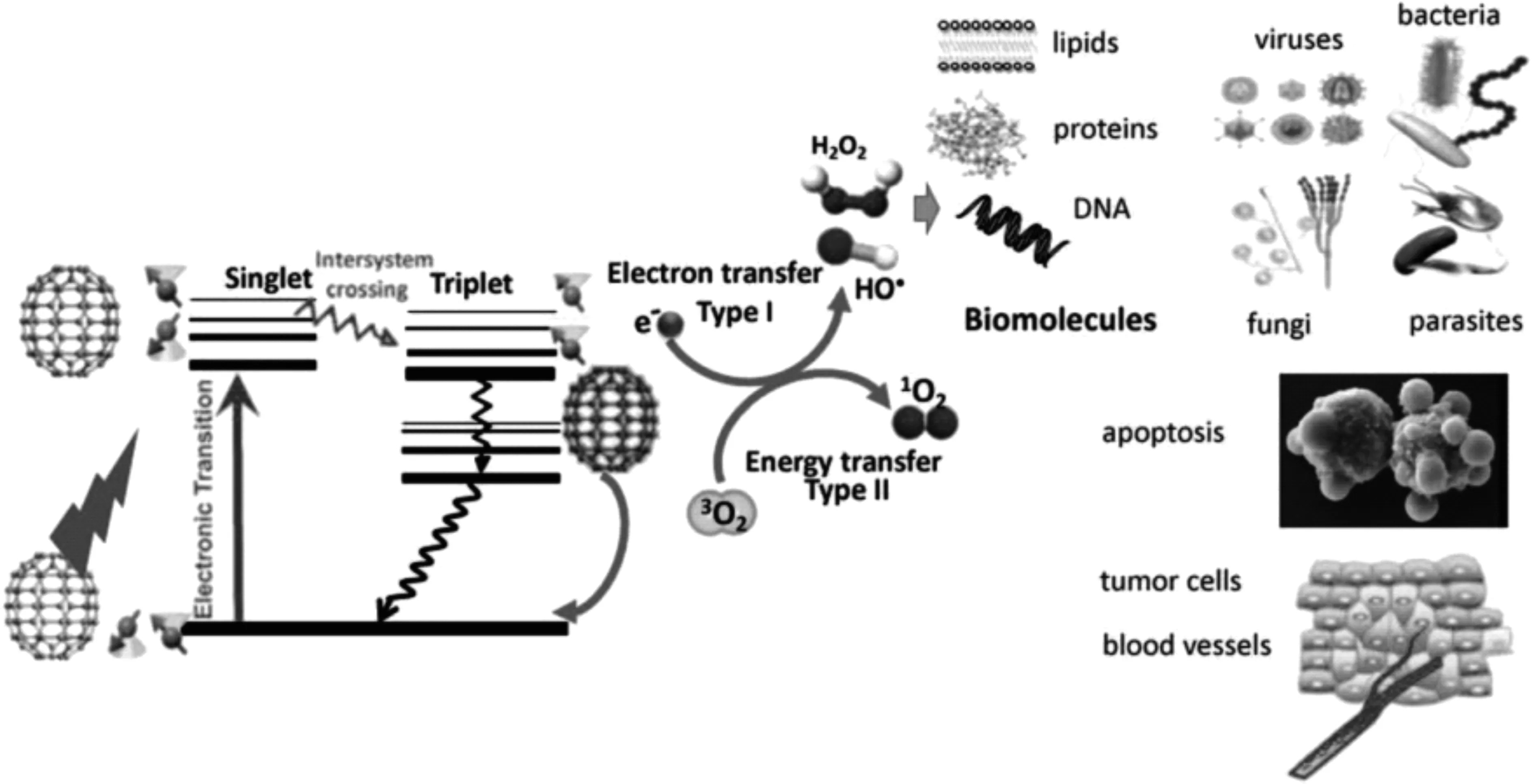
圖4 富勒烯材料的光動力活性[22]
富勒烯材料作為光動力療法的光敏劑在抗腫瘤領域得到廣泛的研究,通過與腫瘤診斷和其他治療手段結合,可以實現更高效的治療效果,顯示出其在腫瘤診療中的巨大應用潛力。Tang等[26]開發了一種基于富勒烯-羅丹明B的具有腫瘤微環境pH響應可見光吸收、熒光成像以及光動力治療效果的新型光敏劑復合物材料(圖5)。在酸性條件下,新型光敏劑復合物材料可以實現可見光吸收增強、熒光開啟和激發三重態的產生。細胞實驗表明,光敏劑可以很好的被腫瘤細胞攝取和具有溶酶體(pH 4.5~5.0)激活的特性,熒光開啟的同時可以有效的產生ROS,實現高效的光動力治療效果。
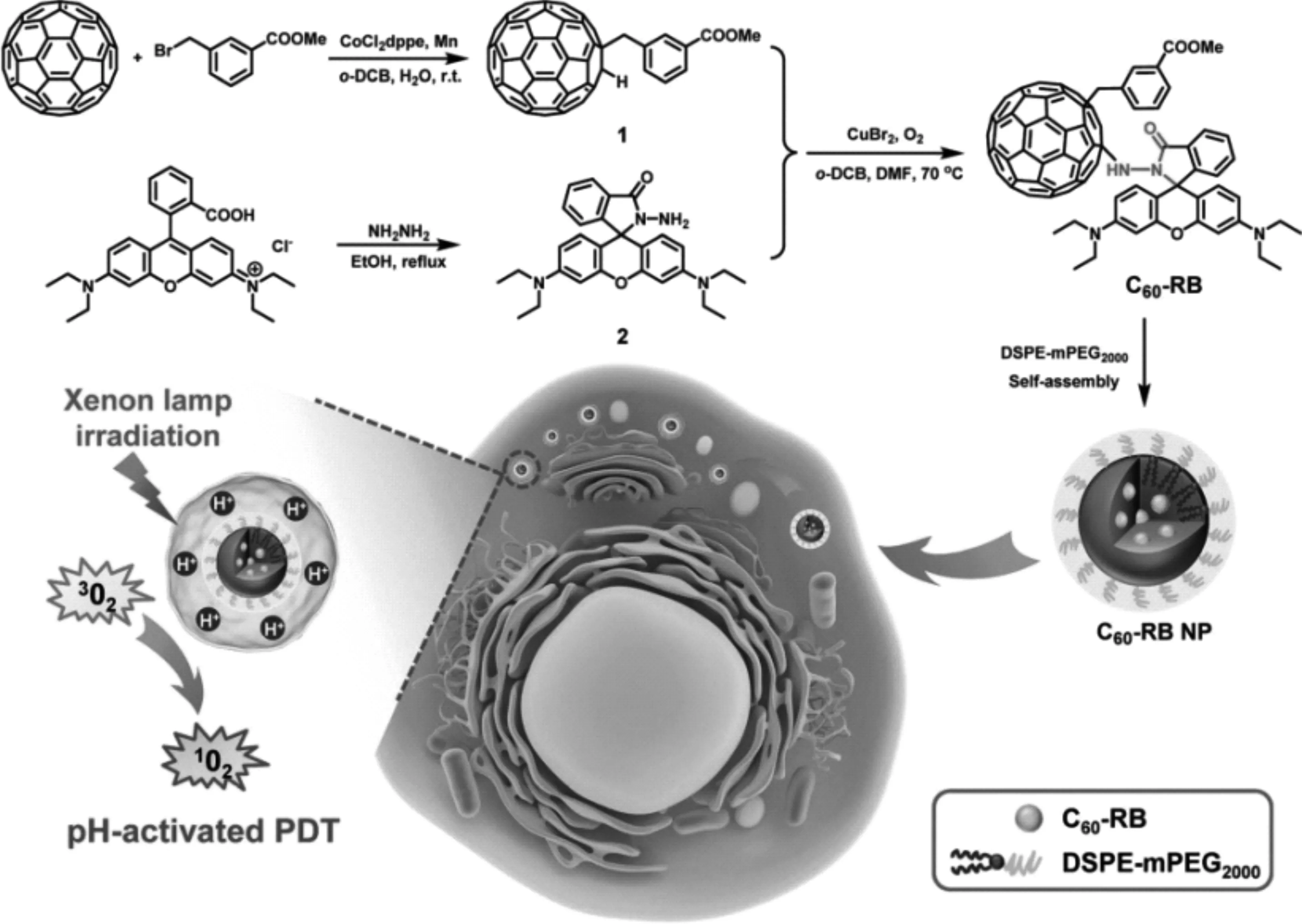
圖5 基于富勒烯的具有光動力治療效果的復合材料示意圖[26]
此外,富勒烯還可以通過聯合其他治療手段,實現比單一治療方式更高效的聯合治療。Fan等[27]基于富勒烯材料通過共價連接抗癌藥物阿霉素(DOX)和特異性靶向配體葉酸(FA)開發了一種具有主動靶向、pH響應化療和光動力治療(PDT)特性的新型多功能抗癌前藥體系(圖6)。該前藥可以特異性靶向葉酸受體高表達的腫瘤細胞,通過胞內pH響應性藥物釋放殺死腫瘤細胞。此外,富勒烯材料具有光動力活性,該前藥經過光照后產生活性氧,使得對于葉酸受體高表達的腫瘤細胞的毒性進一步增加,實現相對于單一化療和光動力治療更高效的治療效果。由于富勒烯材料具有較強的電子接收能力,化療藥物分子DOX共價偶聯到富勒烯表面會使得DOX的熒光被富勒烯淬滅掉,而DOX從富勒烯中釋放出來后,熒光就會恢復。因此,這種熒光淬滅-恢復的特性可用于示蹤胞內DOX的釋放過程。
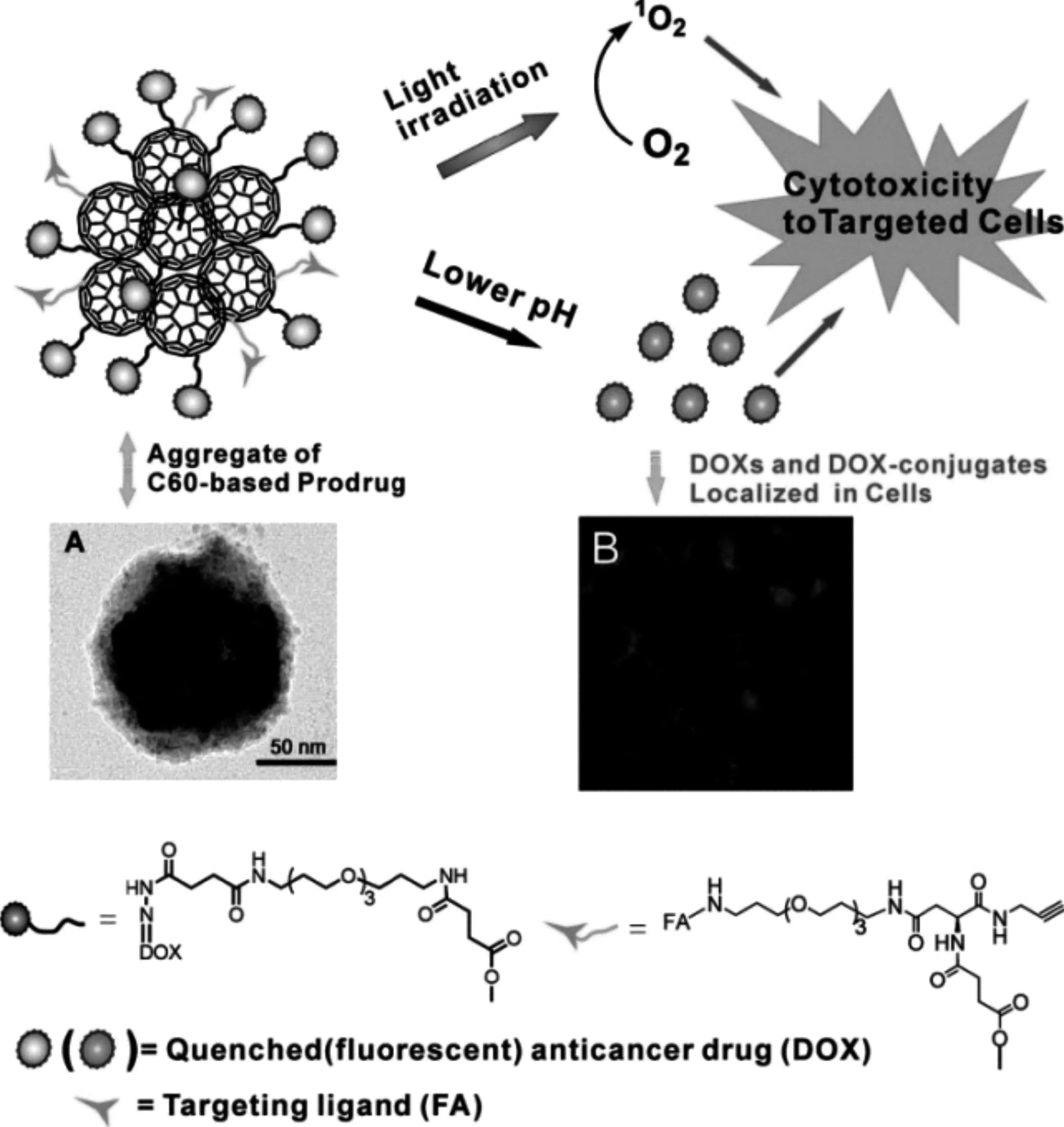
圖6 基于富勒烯的多功能抗癌前藥示意圖[27]
3 抗氧化活性
生物體內氧化和抗氧化作用的平衡在維持機體生物系統的安全性中起到重要作用,化療藥物、外界輻射、細胞代謝以及細胞的異常反應導致產生的大量活性氧,比如超氧自由基陰離子、羥基自由基、單線態氧和過氧化氫等,使得氧化和抗氧化作用的失衡,進而誘導的氧化應激與許多急性和慢性疾病的發生機制密切相關,包括癌癥、心血管疾病和許多神經退行性疾病等。因此,有效清除活性氧對于保持機體健康以及預防由自由基過多引起的疾病具有重要意義[28]。大量的研究指出,富勒烯不僅可以作為光敏劑在激光照射下產生ROS用于腫瘤治療,還具有抗氧化活性,作為生物抗氧化劑用于清除ROS。富勒烯的抗氧化活性基于其擁有大量的共軛雙鍵和低空位的LUMO軌道,容易吸收電子與自由基發生反應,清除自由基的同時本身并不被消耗。因此,富勒烯也被認為是最有效的自由基清除劑,被稱為“自由基海綿”[29,30]。富勒烯作為醫學抗氧化劑最大的優勢就是可以進入到細胞病變時產生大量自由基的線粒體部位或者細胞內其他部位。Gharbi等[31]對大鼠進行的一項實驗證實了富勒烯良好的抗氧化活性。實驗結果表明,不使用任何極性有機溶劑制備的富勒烯水性懸浮液不僅對嚙齒動物沒有造成急性或亞急性毒性,而且還表現出一種劑量依賴性地保護肝臟免受自由基損害的作用。因此,富勒烯被認為是一種有效的肝臟保護劑。
此外,富勒烯經極性基團功能化后形成的富勒烯衍生物,比如羥基化后形成的富勒醇(fullerenol),具有更好的水溶性以及穿過細胞膜定位于線粒體的能力,依然保持其優異的抗氧化活性。Yin等[32]制備了3種不同功能化的水溶性富勒烯材料,羧基富勒烯(C60(C(COOH)2)2)、富勒醇(C60(OH)22)和金屬富勒醇(Gd@C82(OH)22),研究了它們在清除活性氧和保護細胞方面的潛力(圖7)。實驗結果表明,這3種不同類型的富勒烯衍生物都可以有效清除活性氧(ROS),超氧自由基,單線態氧和羥基等不同類型的自由基,并且還可以有效抑制脂質過氧化,可以作為活性氧抑制劑(抗氧化劑和自由基清除劑)用于細胞保護。體外通過使用人肺腺癌細胞系A549和大鼠腦毛細血管內皮細胞系rBCECs在過氧化氫誘導的氧化損傷條件下,對于3種富勒烯衍生物對細胞的保護作用進行評價。細胞實驗結果表明,3種富勒烯衍生物都可以保護細胞免受過氧化氫誘導的氧化損傷,穩定線粒體膜電位并減少細胞內ROS的產生,3種富勒烯衍生物的清除自由基能力也存在一定的差異,相對來說,金屬富勒醇(Gd@C82(OH)22)對細胞線粒體的氧化損傷具有更好的保護作用。這些差異性可能是由于經不同基團功能化的富勒烯具有不同的化學性質(例如表面化學性質不同引起的電子親和力的差異)和物理性質(例如聚集程度)從而導致了不同的生物和生物醫學活性。另一項研究工作中,Andrade等[33]利用理論研究對金屬富勒烯(銅,銀和金)的穩定性和自由基清除劑的能力進行了評價。理論研究表明,金屬的存在大大提高了富勒烯的抗自由基能力,這些研究為解釋金屬富勒烯更好的抗氧化能力以及富勒烯基抗氧化劑的設計提供了理論支撐。
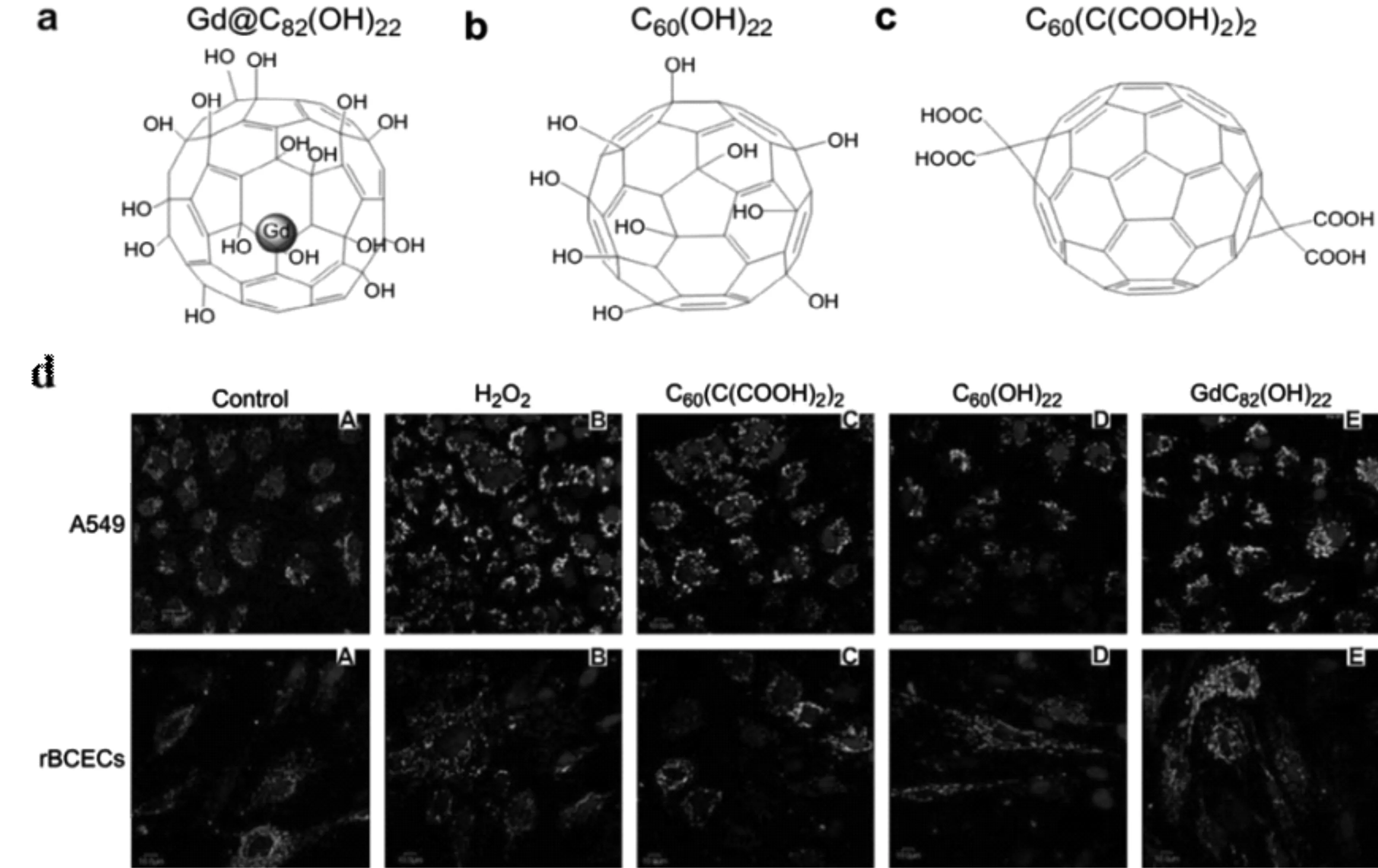
圖7 3種富勒烯材料的結構
4 抗菌活性
富勒烯的抑菌活性早有研究,早在90年代,對富勒烯的抗菌活性評估結果表明,富勒烯有希望用于實現對于包括枯草芽孢桿菌、白色念珠菌和大腸桿菌等細菌的抑制作用[34,35]。對羧基富勒烯的研究表明,它可以作為抑菌劑用來抑制A群鏈球菌感染。對羧基富勒烯對釀膿鏈球菌感染的抗菌活性進行了評價。體外實驗表明,該衍生物可以抑制釀膿鏈球菌的生長,對小鼠給藥后可保護33%的小鼠幸免于感染死亡[36]。另一項工作中,Tsao等[37]研究了羧基富勒烯對二十種細菌菌株的抗菌活性。結果表明,該富勒烯衍生物對于革蘭氏陽性細菌具有較強的抑制作用,而對于革蘭氏陰性細菌并沒有抑制作用。富勒烯的抗菌活性可能是由于細菌將富勒烯納米顆粒內在化后,納米顆粒抑制了細菌的能量代謝[38,39]。也有一部分研究者認為富勒烯是通過破壞細菌的呼吸鏈從而抑制細菌的生長[40,41]。起初,在富勒烯及其衍生物的濃度較低時,細菌的攝氧量減少,隨后攝氧量增加,并伴隨著過氧化氫產物的增加。另一種富勒烯抑菌作用的機理是富勒烯可以破壞細胞膜。富勒烯的疏水表面很容易與膜脂相互作用,并嵌入其中誘導細胞膜的破壞,進而實現抑菌作用[38,40,41]。
此外,PDT由于對抗生素的耐藥性較低,是一種新興的對多抗生素耐藥細菌的有前途的治療方法。富勒烯具有較高的PDT效率和優異的化學穩定性,已被提出作為細菌光動力滅活的有效光敏劑用于抗菌作用[30]。在激光照射下,水溶性良好的富勒烯衍生物對于革蘭氏陽性細菌和革蘭氏陰性細菌都具有抗菌活性[42]。為了克服富勒烯材料有限的水溶性和較強的聚集傾向,Zhang等[43]開發了一種基于富勒烯的肽調節的自組裝雜合超分子水凝膠用于靶向和持續光動力抗菌療法(圖8)。水凝膠中富勒烯的聚集趨勢通過肽和富勒烯之間的非共價相互作用而被大大抑制。因此,與未處理的富勒烯相比,肽-富勒烯水凝膠的PDT效率得到了極大的提高。富勒烯的摻雜也極大地改善了水凝膠的機械性能,使得這種雜合水凝膠稱為更好的可注射制劑用于生物醫學領域。體外和體內抗菌結果表明,肽-富勒烯水凝膠可有效抑制耐多種抗生素的金黃色釀膿葡萄球菌,并促進傷口愈合。
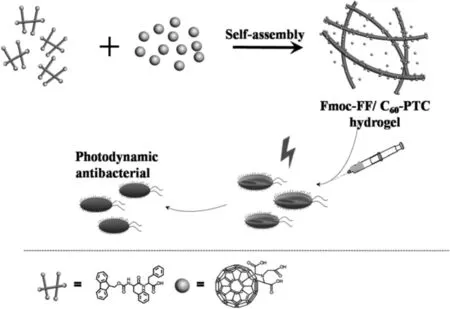
圖8 基于富勒烯的超分子水凝膠抗菌應用示意圖[43]
5 總結與展望
在過去的幾十年中,富勒烯已經成為一種在不同健康相關領域都具有巨大應用價值的碳納米材料。隨著富勒烯材料更多應用領域的開發與拓展,對于富勒烯的需求也將大大增加。富勒烯具有的抗氧化活性、抗菌活性、光動力活性和細胞保護作用等多種生物學效應,使其在納米生物醫學領域發揮著重要作用。
本文綜述了有關國內外研究學者對富勒烯在納米生物醫學領域中的應用研究。富勒烯在納米生物醫學領域應用中具有諸多優勢,各種不同功能化的富勒烯被開發出來以提高其水溶性、生物相容性和賦予其靶向性等,但是富勒烯材料正式應用于臨床依然面臨著一些挑戰。首先,這些研究工作集中在體外細胞以及體內動物水平的研究,這些臨床前實驗可能與人體中的作用機制存在一定的相似之處,但是人體畢竟不同于其他生物體,生物學行為與動物實驗中收集的數據有所不同。再者,影響富勒烯材料臨床轉化最大的挑戰之一就是對于富勒烯的毒性問題存在著爭議[44]。已有研究工作指出,富勒烯在實驗模型中具有良好的生物安全性,但要完全理解此類納米材料的實際性能和功能還有很長的路要走[2]。雖然仍有許多問題需要克服,但富勒烯在納米生物醫學領域的應用無疑將擁有廣闊前景。

