芽菜中高效降解亞硝酸鹽菌株的分離鑒定
黃雪芹,左勇,2*,張強*,楊建飛,徐佳,秦世蓉,何頌捷
(1.四川輕化工大學 生物工程學院,四川 宜賓 643000;2.四川師范大學生命科學學院,成都 610101)
宜賓芽菜是中國“四大特色醬菜”之一[1],歷史悠久、風味獨特,含有豐富的氨基酸、蛋白質、維生素等營養成分。在腌制過程中,由于微生物的作用,發酵產生有機酸、醇類、酯類等風味物質,使芽菜香、脆、甜、嫩、美味可口,深受消費者喜歡。
芽菜原料是芥菜的嫩莖,新鮮芥菜中亞硝酸鹽主要來源于土壤中固有氮和氮肥,經芥菜吸取后以硝酸鹽的形式儲存,在大腸桿菌、副大腸桿菌等有害菌產生的硝酸還原酶作用下,被還原成亞硝酸鹽。亞硝酸鹽具有很強的毒性,一般人體攝入0.3~0.5 g就會引起中毒[2,3],我國國標GB/T 5009.33-2003中規定醬腌菜中亞硝酸鹽小于20 mg/kg[4]。醬腌菜中亞硝酸鹽的降解,主要方法有物理(合理降低氮肥使用量)、化學(花色苷、抗壞血酸等對亞硝酸鹽的清除作用)和微生物降解。目前,研究最多的是利用可降解亞硝酸鹽的微生物或其產生的亞硝酸還原酶(NiRs)來降低亞硝酸鹽[5,6]。
芽菜中主要的功能菌是細菌,包括產酸類細菌、嗜鹽類、乳酸菌類、芽孢桿菌屬等[7-9]。芽菜在發酵期間的亞硝酸鹽含量先增加達到亞硝峰后再降低,發酵后熟階段含量遠低于國家標準[10],這可能與芽菜中富含高效降解亞硝酸鹽菌株有關,但是關于這些菌株卻鮮有報道。本研究采用微生物方法從發酵芽菜中分離、篩選具有亞硝酸鹽高效降解的菌株,以期豐富醬腌菜中降解亞硝酸鹽的微生物類型,同時為后期研究制作醬腌菜中亞硝酸鹽發酵菌劑提供了理論菌種基礎。
1 材料與方法
1.1 樣品與試劑
芽菜:取自某芽菜食品有限公司。
主要試劑:DP336細菌試劑盒、硝酸鉀、亞硝酸鈉、鹽酸萘乙二胺、對氨基苯磺酸、革蘭氏染色劑。
1.2 培養基[11]
分離培養基:MRS培養基、牛肉膏蛋白胨瓊脂培養基、PDA培養基。
種子培養基:相應的液體分離培養基。
基礎產酶培養基:含亞硝酸鈉(作為亞硝酸還原酶的誘導物)的液體分離培養基。
1.3 試驗方法
1.3.1 亞硝酸鹽的測定及標準曲線的制作
鹽酸萘乙二胺分光光度法[12]。
1.3.2 菌株的分離純化
從芽菜廠取樣并真空保存,樣品取回后在無菌條件下稱取芽菜10 g,加入90 mL無菌生理鹽水(NaCl 0.85%)中,(37±1) ℃,100 r/min恒溫培育過夜后,制備成10-1~10-6的稀釋液,各取0.1 mL均勻涂布于含亞硝酸鹽的3種分離培養基上,每一梯度樣品做3個平行,(37±1) ℃下于恒溫箱中培養至長出明顯菌落后,挑取單菌落,再用平板劃線法純化,在相應的固體培養基斜面上于4 ℃冰箱保存。
1.3.3 亞硝酸鹽降解菌初篩
將分離純化得到的菌株制成種子菌懸液,按1%(V/V)接種量接種于濃度為200 μg/mL NaNO2的液體培養基(裝液量50 mL/250 mL)中,(37±1) ℃恒溫培養24 h,培養結束后取1 mL培養液進行顯色反應[13],觀察顏色變化,以不加菌種的試管為顏色對照(CK)。
由于在弱酸條件下,亞硝酸鹽與對氨基苯磺酸重氮化后,再與鹽酸萘乙二胺耦合形成紫紅色染料,故選擇顏色較淺的進行復篩。
1.3.4 亞硝酸鹽降解菌復篩
將初篩得到的菌株制成種子菌懸液,以接種量為1%(V/V)接種于濃度為400 μg/mL NaNO2的液體培養基(裝液量100 mL/250 mL)中,(37±1) ℃搖床振蕩培養,在培養時間為12,24,36,48,60,72 h時取樣,于12000 r/min離心1 min除去菌體,取上清液在波長538 nm處檢測亞硝酸鹽剩余量(NE,μg/mL)[14],計算剩余亞硝酸鹽含量和降解率。以含200 μg/mL NaNO2未接種的培養基為對照(CK)(NC,μg/mL)。
降解率=(NC-NE)/NC×100%。
1.4 菌株的鑒定
1.4.1 菌體形態學鑒定
菌體、菌落形態觀察[15]:將菌株接種于培養基上,于37 ℃培養箱中培養24 h后觀察并記錄菌落的生長情況、顏色和大小、形態、表面、邊緣、隆起形狀、透明度等。
革蘭氏染色[16]:挑取單菌落進行革蘭氏染色,細胞保留初染劑(藍紫色)的細菌為革蘭氏陽性菌,細胞中初染劑被脫色劑洗脫而染上復染劑的顏色(紅色)的細菌為革蘭氏陰性菌。
1.4.2 分子鑒定
細菌采用16S rDNA分子鑒定[17]:液體培養基,37 ℃、180 r/min 條件下振蕩培養16 h,收集菌液,細菌總DNA提取按照DP336試劑盒所提供的提取方法進行。以提取得到的基因組DNA作為PCR擴增模板。反應體系50 μL,將PCR擴增后的產物進行瓊脂糖凝膠電泳,結束后用凝膠成像儀觀察條帶,將觀察到的目的條帶進行切膠處理,用DNA膠回收試劑盒進行切膠回收。
細菌通用引物(27F:GAGAGTTTGATCCTGGCT,1492R:TACGGCTACCTTGTTACGAC),以細菌的總DNA為模板進行PCR擴增。
真菌采用核糖體ITS rDNA區的通用引物ITS1:5′-TCCGTAGGTGAACCTGCGG-3′和ITS4:5′-TCCTCCGCTTATTGATATGC-3′,以菌株的總DNA為模板進行PCR擴增[18]。
反應體系(50 μL):DNA 模板為1 μL,PF(10P)1 μL,PR(10P)1 μL,Mix酶25 μL,ddH2O補加至50 μL。擴增程序:98 ℃變性3 min;98 ℃10 s;55 ℃15 s;72 ℃ 20 s,39個循環;72 ℃延伸5 min,保持4 ℃。
PCR產物經切膠回收后,送至專業檢測機構(擎科生物技術有限公司)進行測序。
1.4.3 DNA測序和系統發育樹的構建
將測得的16S rDNA序列在NCBI 網站(https://www.ncbi.nlm.nih.gov/)上使用BLAST程序在GenBank基因庫上進行同源性分析,選擇相似性較高的序列,采用MEGA 6.0軟件構建系統發育樹[19]。
2 結果與分析
2.1 亞硝酸鹽降解菌初篩
采用3種不同的培養基,挑選5個不同發酵階段的芽菜樣品進行菌株篩選,共選出53個能在含亞硝酸鹽培養基上生長的單個菌落,經過初篩的顯色反應,篩選出顏色較深的菌株33株,較淺的菌株共20株,部分菌株的顯色結果見圖1,說明這些菌株都具有降解亞硝酸鹽的能力,只是強弱不同,且部分顏色較淺的菌株具有較強的降解能力。

圖1 顯色反應顏色深淺對比圖Fig.1 Color contrast diagrams of chromogenic reaction
2.2 亞硝酸鹽降解菌株復篩
2.2.1 亞硝酸鹽標準曲線的制作
為定量檢測亞硝酸鹽的含量,以亞硝酸鹽的濃度為橫坐標,以波長538 nm處的吸光度OD值為縱坐標作圖,繪制亞硝酸鹽濃度標準曲線,見圖2。
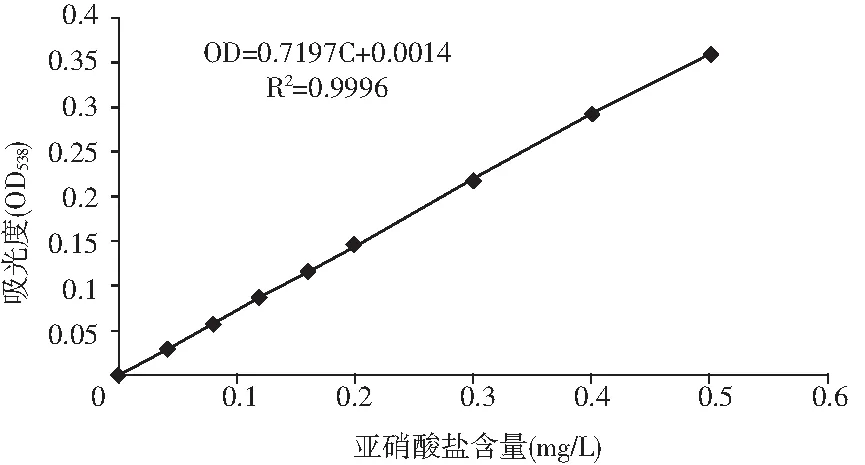
圖2 亞硝酸鹽濃度標準曲線Fig.2 The standard curve of nitrite content
由圖2可知,在波長538 nm處,0~0.6 mg/L的濃度范圍內,亞硝酸鹽濃度C和吸光度OD值呈良好的線性關系,滿足方程OD=0.7197C+0.0014,R2=0.9996。
2.2.2 菌株降解亞硝酸鹽結果
對顯色較淺的20株菌進行亞硝酸鹽72 h降解能力的測定,結果表明,有12株菌的降解率較高,亞硝酸鹽在72 h內各菌株的降解情況及降解率結果見圖3和圖4。
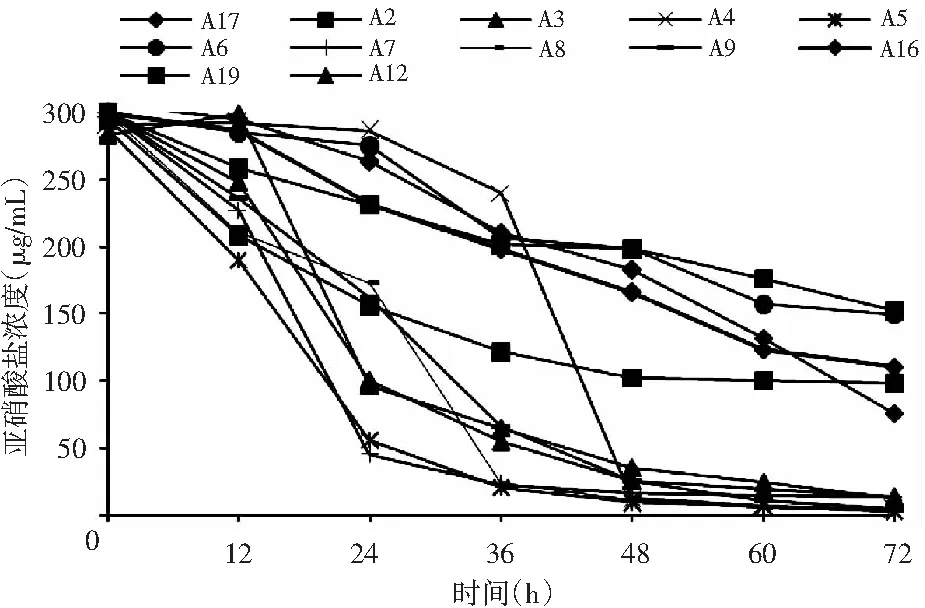
圖3 培養液中亞硝酸鈉濃度隨培養時間變化趨勢Fig.3 The variation trend of sodium nitrite concentration in culture solution with cultivation time
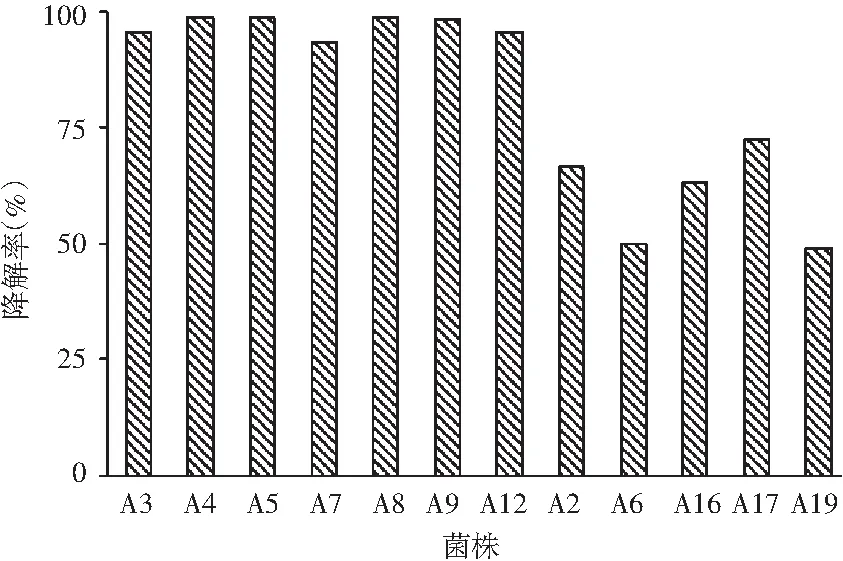
圖4 分離菌株對亞硝酸鹽降解率的比較Fig.4 The comparison of isolated strains on degradation rates of nitrite
由圖3和圖4可知,篩選得到亞硝酸鹽降解率很高的7株菌株A3、A4、A5、A7、A8、A9、A12,在培養72 h后的降解率均達到95%以上。其中A5、A7在濃度為400 μg/mL NaNO2的液體培養基中培養24 h時降解率最快,且在培養72 h后降解率接近100%。
2.3 菌落形態及菌體特征
通過分離、純化、篩選,將從芽菜中篩選出的亞硝酸鹽降解能力較強的7株菌株進行菌落形態學特征鑒定、革蘭氏染色,結果見表1。
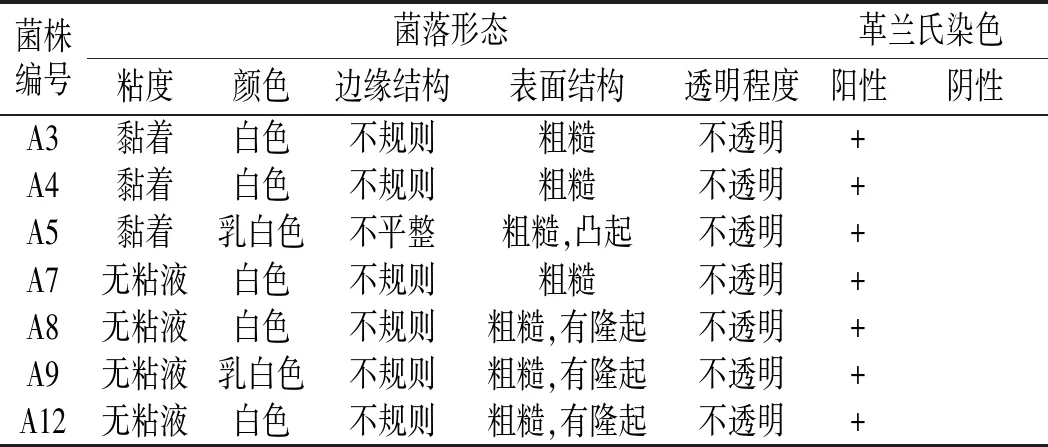
表1 菌落形態和革蘭氏染色鑒定表Table 1 The identification results of colony morphology and gram staining
各菌株稀釋10-6倍后,第2天在培養基上開始生長出單菌落,初步判斷菌株能在含亞硝酸鹽培養基上生長。A3、A4的單菌落形態特征基本相同,白色菌落,表面粗糙,黏著,不規則;A5、A7菌落形態不同(見圖5)。A8、A9、A12單菌落形態特征基本相同,乳白色,表面粗糙,隆起,不規則。結合菌落形態和革蘭氏染色結果都為陽性,初步判斷7株菌皆為細菌。
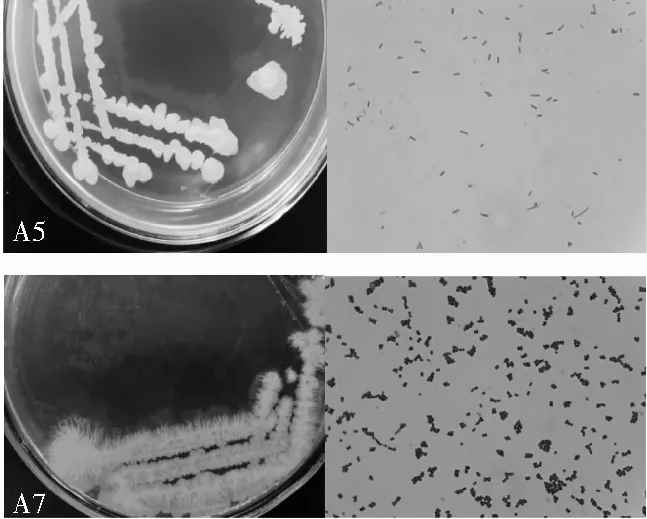
圖5 A5(上)與A7(下)菌株在平板上的培養特征及顯微形態Fig.5 Culture characteristics and microscopic morphology of strains A5(up) and A7(down) at the plate
2.4 系統發育分析和分子生物學點鑒定結果
2.4.1 亞硝酸鹽還原菌株16S rDNA的PCR擴增
將降解能力最強的7株菌株進行16S rDNA擴增,經擴增后的PCR產物進行1%瓊脂糖凝膠電泳(150 V、100 mA、20 min),電泳結果見圖6(電泳圖M:DL2000 DNA Ladder)。
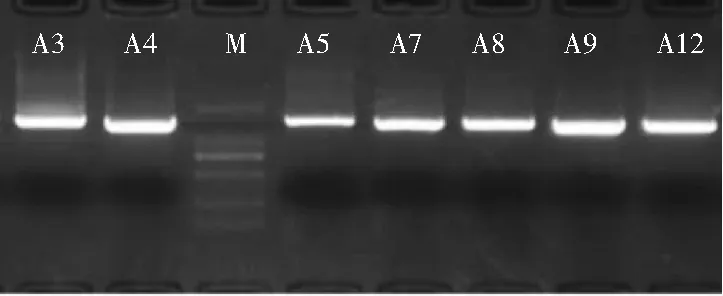
圖6 亞硝酸鹽還原菌株16S rDNA PCR產物瓊脂糖凝膠電泳Fig.6 Agarose gel electrophoresis of nitrite-reducing bacteria 16S rDNA PCR products
由圖6可知,經1%瓊脂糖凝膠電泳后,各菌株得到的特異性條帶片段大小均在1000~2000 bp之間。
2.4.2 亞硝酸鹽還原菌系統發育樹構建
將7株菌株的PCR產物送至擎科生物技術有限公司進行測序,將16S rDNA測序結果在NCBI GenBank基因文庫中進行比對,選擇相似性不小于99%的序列,使用MEGA 6.0構建系統發育樹,結果見圖7。

圖7 菌株進化樹Fig.7 Phylogenetic tree of bacterial strains
經過序列的BLAST比對顯示,7株菌株均屬于芽孢桿菌屬的一個種。利用MEGA 6.0軟件構建系統發育樹,并結合形態特征,確定菌株A3、A4同為芽孢桿菌(Bacillussp.);A5為枯草芽孢桿菌(Bacillussubtilis);A7為貝萊斯芽孢桿菌(Bacillusvelezensis);A8、A9、A12同為解淀粉芽孢桿菌(Bacillusamyloliquefaciens)。
3 結論
本研究通過菌株降解能力測定,從幾個不同發酵階段的芽菜中分離、篩選具有高效降解亞硝酸鹽能力的菌,并通過形態學和分子生物學鑒定,結果顯示篩選得到的高效降解亞硝酸鹽的菌株皆為芽孢桿菌屬。且培養72 h后7株菌的降解率都接近99%。
芽孢桿菌是一種具有豐富酶系、除氮能力的異養型細菌,能快速高效地分解外界環境中的污染物、蛋白質及水溶性有機物。關于芽孢桿菌降解亞硝酸鹽,報道最多的是應用于水體養殖和水污染治理等方面。但本試驗從芽菜中篩選出高效降解亞硝酸鹽的芽孢桿菌屬,說明在醬腌菜的發酵生產中芽孢桿菌在降解亞硝酸鹽方面具有很大的作用。為后期研究利用菌株產亞硝酸還原酶降解醬腌菜中的亞硝酸鹽提供了可行性菌種。

