對氨基苯甲酸合成實驗的改進*
謝 珺
(貴州醫科大學藥學院,貴州 貴陽 550004)
有機化學實驗是化學學科重要的基礎課,實驗開設的目的是培養學生掌握有機化學的基本技能和基礎知識,驗證和加深有機化學的基礎理論、有機化合物和有機反應的理解,培養學生正確選擇有機化合物的合成、分離與鑒別的方法,培養學生的創新思維和能力,培養學生理論聯系實際、實事求是、細致嚴謹的科學態度和良好的工作作風。藥學專業畢業的大部分學生將進入制藥行業,無論哪家制藥企業都要求學生具有較強的實踐能力和藥學背景知識。學生在校期間獲得較為系統的有機化學實驗的培訓,主要通過課堂教學來實現的,所以實驗的內容和方法的改進對培養學生的實踐能力和創新精神是很有幫助的。
對氨基苯甲酸的合成是大學有機化學的經典實驗,對氨基苯甲酸是合成局部麻醉劑苯佐卡因的重要中間體,以對氨基苯胺為原料,經酰化、氧化、水解、酯化一系列的反應后可以的目標化合物。原料易得,操作方便,適合實驗室的小量制備。以簡單的原料合成復雜的分子是有機化合物最重要的任務之一,也是有機化學最有活力的領域,科研離不開合成,完成有機合成,除了制定合理的路線,嫻熟的實驗操作也是必不可少的條件。對氨基苯甲酸的實驗一般是安排在實驗課最后才開設的實驗內容,學生掌握一些最基本的操作后,從原料開始,經過幾步,合成復雜的分子,培養學生有機合成的基本功[1]。
有機合成中多步驟反應,各步反應對總產率都有累加的影響,對氨基苯甲酸的合成涉及三個反應。第一個反應是將對甲苯胺用乙酸酐處理轉變為相應的酰胺,目的保護氨基;第二步是對甲基乙酰苯胺中的甲基用高錳酸鉀氧化為相應的羧酸;最后一步是酰胺的水解,除去保護作用的乙酰基。對氨基苯甲酸的實驗提供給學生將一個產物用于隨后步驟的經驗,從簡單易得的原料合成有用的藥物或中間體,其目的在于激發學生的興趣,同時強調實驗中的嚴謹的科學態度和良好的實驗技能對獲得目標產物的重要性。
1 實驗原理
對氨基苯甲酸的合成路線如下:
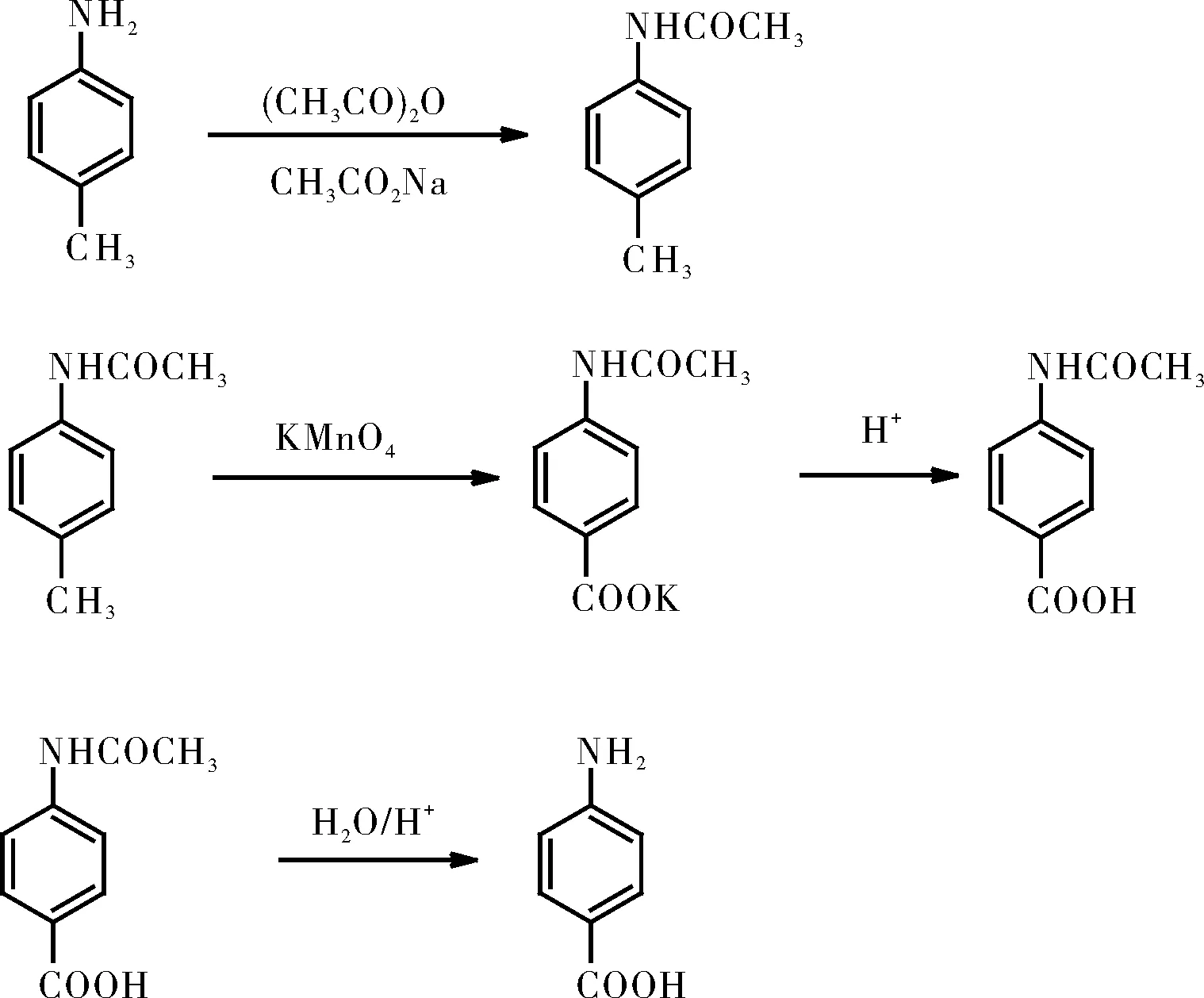
2 實驗教學中存在的問題
在多年的教學的實踐中,發現學生操作第二步甲基的氧化和第三步水解保護氨基的乙酰基反應存在很大的問題。
第二步甲基的氧化,實驗教材中對氨基乙酰苯胺約3.5 g,高錳酸鉀的用量是10.3 g,按照對甲基乙酰胺苯胺和高錳酸鉀的摩爾比是1∶2計算,計算出高錳酸鉀的用量6.3 g,實驗教材中高錳酸鉀的量是實際計算量的一倍,如果學生按教材的用量,就會發現在加完高錳酸鉀后,攪拌15 min,反應液依然是紫色,按照實驗教材的描述,需要加乙醇煮沸直至紫色消失,教材乙醇的用量是1~1.5 mL,但是僅僅加1.5 mL的乙醇是不夠。因為高錳酸鉀過量在學生實際操作的時候,剩余大量的高錳酸鉀沒有完成溶解,造成比較的浪費。高錳酸鉀的還原產物二氧化錳在后處理的時候需要用濾紙抽濾,學生在這步操作為了得到無色濾液需要重復3~5次,濾紙的用量按實驗教材的介紹用兩層達不到抽濾的效果,因為二氧化錳的顆粒太細了,通常學生用五層,抽濾效果會比較理想。由于高錳酸鉀的過量,導致了乙醇和濾紙的過量使用。
第三步水解保護氨基的乙酰基,實驗教材是加鹽酸回流后,“待反應液冷卻后,加入15 mL冷水,然后加10%氨水中和,使反應液混合物對石蕊試紙恰成堿性,切勿使氨水過量。每30 mL最終液體加1 mL冰醋酸,充分搖振后置于冰浴中驟冷以引發結晶,必要時用玻璃棒摩擦瓶壁或者放人晶種引發結晶[1]。”按教材操作很多同學得不到最終產物,最主要的原因之一用石蕊試紙判斷恰好到堿性,當石蕊試紙變藍的時候,溶液的pH值已經過來對氨基苯甲酸的等電點,有的同學在操作中發現在滴加氨水的過程中,有白色固體出現,但石蕊試紙沒有變藍,于是繼續滴加氨水,白色固體消失,繼續滴加氨水直到石蕊試紙變藍的時候,實際操作氨水已經過量了。再以每30 mL最終液體加1 mL冰醋酸,最后大部分同學很難結晶得到目標產物。分析原因有兩方面,一方面石蕊試紙的變色從粉色到粉藍色變化不是很明顯不利于判斷:另一方面同學的操作經常是氨水過量用酸調,酸過量又用氨水調反反復復,溶液太多很難結晶。
3 實驗教學的改進
第二步甲基的氧化,在實際教學中,高錳酸鉀的用量應該減半,因為學生在第一步對甲基乙酰苯胺的制備,由于多種原因不可能得到實驗教材給的參考值3.5 g。高錳酸鉀即使按教材量減半,也還有部分同學在抽濾時,濾液是紫色,說明同學在合成對氨基乙酰苯胺時,產率不高,消耗不了理論計算需要的高錳酸鉀。另外在抽濾二氧化錳的時候濾紙可以增加到用五張濾紙,抽濾效果比較好,可以減少抽濾的重復操作,縮短實時間,提高效率。
第三步水解保護氨基的乙酰基,對氨基苯甲酸是既有羧基也有氨基的兩性物質,其等電點PI=4.7~4.9[2],等電點是每一種氨基酸的特定常數,在等電點時,氨基酸的水溶性最小。對氨基苯甲酸在等電點時,溶解度最小,利用這一性質進行分離提純。通過實驗我們發現用pH試紙代替石蕊試紙,直接調pH=5,就可以有固體析出得到產物[2]。pH試紙的顏色變化明顯,學生容易判斷酸堿的變化,一般情況,當pH=5時,就會出現白色固體,如果沒有固體生成,用玻璃棒摩擦燒杯內壁,也會出現白色固體,提高了實驗的成功率。
4 實驗步驟
(1)對氨基乙酸苯胺的合成
在250 mL燒杯中,加入3.8 g(0.035 mol)對甲苯胺,90 mL水和3.8 mL濃鹽酸,水浴上溶解,加4.2 mL(0.043 mol)醋酸酐和6 g結晶醋酸鈉的水溶液,充分攪拌后將混合物冷卻,析出白色固體。抽濾,用少量冷水洗滌,干燥后稱重。
(2)對乙酰氨基苯甲酸的合成
在250 mL燒杯中,加入對氨基乙酰苯胺約3.5 g、10 g七水合結晶硫酸鎂和175 mL水,將化合物在水浴上加熱到約85 ℃,同時將5 g高錳酸鉀溶于20 mL沸水中。充分攪拌下,將熱的高錳酸鉀溶液在30 min內分批加到對氨基乙酰苯胺的混合物中,避免局部濃度過高破壞產物。
加完后,在85 ℃繼續攪拌15 min,混合物顏色變深棕色,用五層濾紙趁熱過濾,除去二氧化錳。若濾液呈紫色,需要加入乙醇煮沸,直至紫色消失。將濾液反復抽濾,直到濾液為無色。
無色濾液中加入20%硫酸酸化至溶液呈酸性,有白色固體生成,抽濾,壓干,干燥,稱重得白色固體約2 g。
(3)對氨基苯甲酸的合成
稱量上步的產品對乙酰氨基苯甲酸,每克濕重產物用5 mL 18%鹽酸水解。反應物置于圓底燒瓶中,電爐小火加熱緩緩回流30 min,反應物冷卻后,用氨水調到pH=5,白色固體析出。抽濾、干燥、稱重、測熔點。
5 結 語
我們在開設2016級藥學,2017級藥學和2018級藥學有機化學實驗時,已經改變了實驗方法。在2017級藥學班我們嘗試同一實驗室的同學,部分學生按實驗教材的方法實驗,部分同學按改進后的方法。我們發現產率并沒有太大的區別,但是避免高錳酸鉀的浪費,最后的結晶直接用氨水調pH值的同學可以比較快的得到產品。
減少高錳酸鉀的用量對實驗室的管理和避免浪費都是有益的,因為在實驗過程中如果按教材給的量進行反應,會有很多同學剩余大量高錳酸鉀,沒有及時回收,即使回收后期處理也比較麻煩。該實驗的改進也是將綠色化學的理念[3-4]貫穿于有機實驗,綠色化學指在制造和應用化學產品時應有效利用原料,消除廢物和避免使用有毒的和危險的試劑和溶劑。減少高錳酸鉀試劑的用量,源頭上減少對環境的污染。讓同學們身體力行的感受綠色化學不僅僅是一個概念,可以在實踐中體會綠色化學的含義。
最后一步直接用氨水調節pH值的。利用對氨基苯甲酸的等電點來分離提純化合物,可以將有機化學理論課講過的氨基酸等電點基本概念在實驗課上得到應用,枯燥的有機理論可以指導實驗的操作,理論課和實驗課是相輔相成的關系。通過實驗的改進,同學們可以體會到實踐才是檢驗的標準,不同的方法可以得到相同的實驗結果,優化實驗條件也是有機合成是很重要的一部分。
有機化學是藥學、醫學、化工等專業的基礎,實驗課的開設對有機化學的學習非常重要,按照實驗教材完成基本內容、基礎操作,有利于培養學生的有機化學的基本功,但是改變固定思維,培養具有創新性的人才是時代的要求。對氨基苯甲酸實驗的改進,是在學生的實踐的基礎上,根據實際操作合理的調整試劑的用量,結合有機化學的理論改進實驗方法。該實驗的改進,有利于擴展學生的思路,提高綜合素質[5]。

