新情境下電極反應方程式的書寫
◇ 陜西 文政民
電化學知識是中學化學理論的重要組成部分,是歷年來高考命題的重點,幾乎每年在各個省份的化學試題中都有所涉及.近幾年,高考題都側重于用新型化學電源來考查學生運用電化學理論、氧化還原反應、元素化合物等相關理論知識解決實際問題的能力.
1 理論依據
書寫電極反應式要遵循元素守恒和電荷守恒定律,因此,只要能在給定的新情境下判斷出電極參與氧化或還原反應的反應物和產物,再根據價態變化判斷并寫出得失電子數,最后根據溶液的酸堿環境、氫氧元素守恒、電荷守恒,在電極反應方程式的兩邊分別補上H+、OH-、H2O 即可得到某一電極的電極反應式.
2 書寫原則及步驟
書寫電極反應式時,無論是原電池還是電解池均可按照以下四步直接寫出.
1)寫:依據信息及物質所含元素價態變化寫出氧化劑(還原劑)及還原產物.
2)標:依據物質所含原子數及化合價升降數標出氧化劑(還原劑)得到(或失去)的電子數.
3)配:依據反應介質酸堿環境及電荷守恒配平離子.
4)補:依據質量守恒及反應體系補充物質.
3 典型示例
3.1 新型化學電源電極反應式的書寫
例1某科研小組用電化學方法使NH4HS變廢為寶(硫酸銨化肥),設計方案如圖1所示,寫出該電池負極的電極反應式.
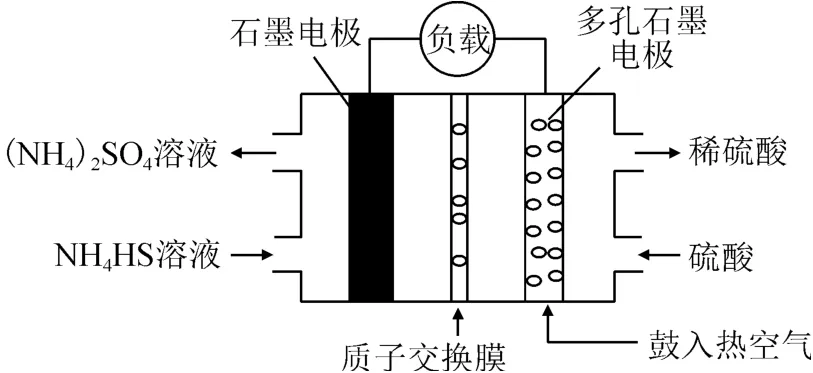
圖1
解析
該題以新型化學電源考查原電池電極反應式的書寫,根據題中信息,四步書寫模式如下.
1)寫:原電池負極發生氧化反應,物質所含元素化合價升高,據裝置寫出:
2)標:根據硫元素化合價變化標出失去的電子數,HS-和中硫元素的化合價分別為-2和+6,故失去電子數為8,即
3)配:題中信息出現有質子交換膜,間接說明了電解質溶液為酸性環境,故可在方程式右邊補上H+使左右兩邊電荷相等,即
4)補:根據元素守恒定律,需要補上水,并將箭頭變為等號,即
3.2 燃料電池電極反應式的書寫
例2如圖2所示,裝置Ⅰ為甲烷燃料電池(電解質溶液為KOH),通過裝置Ⅱ實現在鐵棒上鍍銅.
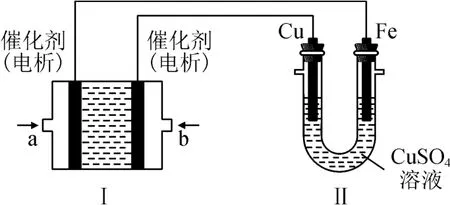
圖2
解析
該題考查燃料電池電極反應式的書寫,根據題中“通過裝置Ⅱ實現在鐵棒上鍍銅”可知,Fe電極為電解池的陰極,則a為燃料電池負極,通入CH4,b為正極,通入O2.a 極電極反應式分步書寫如下.
1)寫:負極CH4發生氧化反應,因為是堿性介質,所以氧化產物為,即.
2)標:根據化合價標出失去的電子數,CH4和中碳元素化合價分別為-4和+4,故失去電子數為8,即
3)配:電解質溶液為KOH 溶液,說明電解質溶液為堿性環境,故補上OH-使左右兩邊電荷數相等,即
4)補:根據元素守恒定律,需要補上水,并將箭頭變為等號,即
4 結語
本文通過對電池電極反應式的書寫方法進行程序化合理編排,建立和形成了一種行之有效的書寫方法,對于學生正確、快速地解題具有一定的指導意義,同時,也為本模塊的教學實踐提供了一種新的思路.

