木瓜蛋白酶水解大豆蛋白制備啤酒糖漿復配液的研究
羅建勇,史一白,劉澤瑾,吳晨孛,錢 芳,,郭 峰,黃立新
(1.廣州雙橋股份有限公司,廣東廣州 510280;2.華南理工大學食品科學與工程學院,廣東廣州 510640)
木瓜蛋白酶是由212個氨基酸單元組成的巰基蛋白酶,具有較寬的底物特異性;分子量約23 400,等電點8.75,最適pH值6~7,最適溫度55~65℃,耐熱性強,在90℃時也不完全失活;受氧化劑抑制,還原性物質(zhì)激活。木瓜蛋白酶商品是由番木瓜(Carica papya L.)的果汁和葉子分離而得的蛋白酶混合物的酶制劑,包含蛋白酶、凝乳蛋白酶、溶菌酶等,多呈淡褐色無定形粉末或顆粒,微吸濕,微有硫化氫臭味[1],在國內(nèi)有廣泛的來源。
木瓜蛋白酶具有酶活高、熱穩(wěn)定性好、天然衛(wèi)生安全等優(yōu)點,即使在食品領(lǐng)域,應用也非常廣,比如用于酶解動物蛋白[2-5],以及花生[6]、玉米[7]、核桃[8]、米糠[9]和大豆[10-14]等的植物蛋白,用于改性蛋白,作為保健和藥物功能配料,都具有非常好的效果。
在前期研究基礎(chǔ)上,采用木瓜蛋白酶在不同的水解條件下酶解大豆蛋白,研究測定其大豆蛋白酶解液的蛋白質(zhì)回收率、水解度、隆丁(Lundin)區(qū)分變化及SDS-PAGE凝膠電泳,探討水解制備大豆蛋白酶解發(fā)酵液的條件,使之接近或者相當于麥芽汁隆丁區(qū)分的一般要求:高分子含氮物質(zhì)占25%,中分子含氮物質(zhì)占15%,低分子含氮物質(zhì)占60%,有豐富的有機氮元素和良好風味,作為發(fā)酵的氮源與啤酒用麥芽糖漿復配使用,能夠更適于啤酒的釀造。
1 材料與方法
1.1 材料
大豆蛋白,山東香馳豆業(yè)科技有限公司提供;木瓜蛋白酶(酶活力60萬U/g),廣州日日香酶制劑有限公司提供。
三氯乙酸、高嶺土、濃硫酸、濃鹽酸等試劑,均為分析純;無水碳酸鈉、鄰苯二甲酸氫鉀為基準純;L-酪氨酸、甘氨酸、干酪素為生化試劑;丙烯酰氨、N,N'-甲叉雙丙烯酰氨、三羥甲基氨基甲烷Tris、四甲基乙二胺TEMED、考馬斯亮藍R-250、十二烷基硫酸鈉和電泳標準蛋白樣品都為電泳純。
根據(jù)待測蛋白質(zhì)相對分子量的大小,選擇相對分子質(zhì)量在6 200~66 200 Da的Marker標準蛋白。
標準蛋白樣品各組分成分見表1。
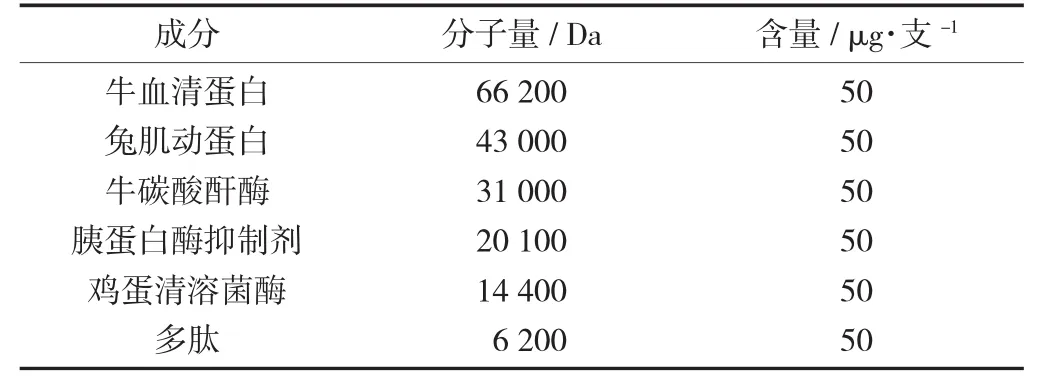
表1 標準蛋白樣品各組分成分
1.2 儀器設(shè)備
PHS-3C型pH計、FA1004電子分析天平、KHW-D-1型電熱恒溫水浴渦、79-3型恒溫磁力攪拌器、JJ-1型增力電動攪拌器、KDN-2C型凱氏定氮儀、KDN型消化爐、TDL-5-A型低速臺式離心機、DYCG-30型電泳槽等。
1.3 大豆蛋白酶解液的制備
1.3.1 步驟
準確稱量大豆蛋白,加入一定量蒸餾水,攪拌均勻,在80±2℃條件下處理15 min,冷卻至預定溫度后恒溫水浴,調(diào)節(jié)pH值至設(shè)定值。加入一定量的酶粉(液),配制成設(shè)定底物質(zhì)量分數(shù)的反應液,緩慢攪拌,反應過程用濃度為0.5 mol/L的NaOH溶液滴定維持體系在預定的pH值。反應到預定時間后,立即放入85℃或100℃水浴中加熱15 min鈍化蛋白酶,冷卻后以轉(zhuǎn)速4 800 r/min離心20 min,取上清液,置于冰箱冷藏。采用pH-state法測定大豆蛋白酶解過程的水解度[15]。
1.3.2 裝置圖
制備大豆蛋白酶解液的試驗裝置簡圖見圖1。
1.4 測定方法
1.4.1 干固物[16]
1.4.2 蛋白質(zhì)
參照GB 5009.5標準檢測測定,換算系數(shù)為5.71。
1.4.3 可溶蛋白質(zhì)回收率(NR)
大豆蛋白原料酶解后,稱量酶解離心后上清液的質(zhì)量,準確稱取約1.000 g的蛋白酶解液,用凱氏定氮法消化、定氮,測定上清液中蛋白質(zhì)含量,為:
1.4.4 α-氨基氮含量[17]
1.4.5 隆丁區(qū)分的測定[17]
1.4.6 SDS-PAGE凝膠電泳[18]
標準蛋白樣和未知樣品在同一塊凝膠上進行電泳,用標準蛋白的遷移率與相對分子質(zhì)量的對數(shù)作圖,可以獲得一條mR-lgMr標準曲線,根據(jù)未知蛋白的遷移率,可得到未知樣品的相對分子質(zhì)量。
2 結(jié)果與分析
2.1 酶用量對大豆蛋白水解產(chǎn)物的影響
底物質(zhì)量分數(shù)6%,酶解溫度60℃,pH值6.0,酶用量分別在6 000,8 000,10 000 U/g下進行酶解。隨著酶解的進行,pH值逐漸下降,過程滴加濃度為0.5 mol/L的NaOH溶液保持pH值在6.0。取不同時間段的酶解液,測量其NR、DH,以及酶解液Lundin分布和電泳后的分子量分布。
酶用量對可溶蛋白回收率和水解度的影響見圖2,酶用量對Lundin A、B和C區(qū)分分布的影響見圖3,酶用量隨反應時間變化所得酶解液的SDS-PAGE凝膠圖譜見圖4。
由圖2可見,酶用量對NR、DH的影響很大。酶解初期DH增加很快,反應60~80 min后逐漸停滯,酶用量越高,快速酶解期越長,可達到的DH越大。酶解1~3 h,NR隨酶解時間增長而增大,隨后輕微變小,應該是酶解后期體系中小多肽數(shù)量濃度增大,自聚導致NR有所減小。
由圖3可見,木瓜蛋白酶的單位用量遠遠大于Alcalase、Protamex 2種蛋白酶,但是對大豆蛋白的酶解效果不如它們,其A、B區(qū)分的含量比例在相同的水解時間下,較前2種的酶解液多,與酶的酶解特性有關(guān)。Alcalase為微生物來源的蛋白酶,其中含有堿肽酶,其酶解的特異性較寬,對蛋白質(zhì)酶解效果往往優(yōu)于植物來源的琉基蛋白酶——木瓜蛋白酶。隨著酶用量和酶解時間的增加,A區(qū)分的含量比例迅速變少,然后逐漸變小;4~6 h時,此時A區(qū)分的含量都較為接近,約10%,屬于較難于再被木瓜蛋白酶水解的高分子的部分。C區(qū)分在酶解2 h之后,其含量比例都超過60%,酶解6 h,甚至70%~80%。
2.4 療效評估 患者應當在拔除尿管之后的4~6周復診,以評價治療反應和不良事件。如果患者的癥狀得以緩解且無不良事件,則沒有必要進行進一步評估。在4~6周后隨訪時建議進行以下檢測:IPSS、QOL、尿流率和殘余尿測定。
隨著酶用量和酶解時間的增加,B區(qū)分的含量變化顯示一定的規(guī)律。酶用量6 000 U/g時,1~2 h階段,B區(qū)分含量接近約23%,4 h時降至17.5%,6 h時又升高到19%,B區(qū)分保持相對高的含量。酶用量為8 000 U/g時,B區(qū)分的含量隨酶解時間的增加總體呈下降趨勢,但在2~4 h階段,其B區(qū)分含量接近約13%,6 h時又下降到11%。酶用量為10 000 U/g時,B區(qū)分的含量隨著酶解時間的增加也呈下降的趨勢,但在4~6 h階段,B區(qū)分的含量已經(jīng)下降到趨于穩(wěn)定,約為10.5%。
由圖4可見,在反應1 h時,隨著酶用量的增加,酶解液中的分子量分布,由6 000 U/g時分子量最大的接近43 000 Da,變?yōu)? 000 U/g時的31 000 Da左右。
酶用量為10 000 U/g時,與8 000 U/g時比較相近。當反應至2 h后,分子量約31 000 Da的蛋白質(zhì)幾乎不存在。由此可見,為了得到適合分子量分布的酶解液,同時考慮NR、DH等經(jīng)濟因素,選擇酶用量為8 000 U/g較為適合。從B區(qū)分分布上也可見,在酶用量為8 000 U/g時,可以得到中分子量蛋白(12 000~40 000 Da) 含量在15%左右。
2.2 酶解pH值對大豆蛋白酶解產(chǎn)物的影響
底物質(zhì)量分數(shù)6%,反應溫度60℃,酶用量8 000 U/g,pH值分別在5.0,6.0,7.0下進行酶解,過程滴加濃度為0.5 mol/L的NaOH溶液保持pH值在6.0。取不同時間段的酶解液,測量其NR、DH,以及酶解液Lundin分布和電泳后的分子量分布。
酶解pH值對蛋白質(zhì)回收率和水解度的影響見圖5,酶解pH值對Lundin A、B和C區(qū)分分布的影響見圖6,不同pH值條件下隨反應時間所得的酶解液的SDS-PAGE電泳圖譜見圖7。
由圖5可見,酶解pH值對NR影響較大。當pH值為6.0時,酶解液中的NR值最大,DH也相對
較高,pH值6.0為最佳的酶解pH值。與Alcalase,Protamex 2種蛋白酶的酶解相比,可能與木瓜蛋白酶 本身的酶解性質(zhì)有關(guān),其所得的NR、DH均較小,沒有前面2種Alcalase,Protamex 2種蛋白酶的酶解效果那么好。
由圖6可見,反應pH值為5.0時,A、B區(qū)分的含量隨酶解時間的增長而呈下降趨勢,C區(qū)分的含量則呈現(xiàn)增加的趨勢,酶解1 h,C區(qū)分的含量已經(jīng)接近60%。
反應pH值為6.0時,A、B區(qū)分的含量隨酶解時間的增長,總體呈下降趨勢。酶解4~6 h,A區(qū)分的含量接近,約8.5%;酶解2~4 h,B區(qū)分的含量接近,約14%;酶解1 h時,C區(qū)分的含量已經(jīng)接近60%,之后逐漸增大。
反應為pH值7.0時,酶解4 h之時,其A區(qū)分的含量最小,為10.1%;酶解6h,A區(qū)分的含量反而升高到12.5%;在4~6 h的酶解階段,C區(qū)分含量比較接近,B區(qū)分的含量則下降,可認為中分子的B區(qū)分在4~6 h的酶解階段,應該有部分多肽重新聚集又轉(zhuǎn)化成為了高分子的A區(qū)分的部分。
由圖7可見,3個pH值條件下酶解所得的酶解液分子量分布的變化比較小,主要分子量分布在30 000,19 000,15 000,6 000 Da。綜合圖 5~ 圖 7的結(jié)果,選取反應pH值為6.0。
2.3 溫度對大豆蛋白酶解產(chǎn)物的影響
底物質(zhì)量分數(shù)6%,酶用量8 000 U/g,pH值6.0,分別在55,60,65℃下對大豆蛋白酶解,過程滴加濃度為0.5 mol/L的NaOH溶液保持pH值在6.0。取不同時間段的酶解液,測量其NR、DH,以及酶解液Lundin分布和電泳后的分子量分布。
酶解溫度對蛋白質(zhì)回收率和水解度的影響見圖8,溫度對酶解液Lundin A、B和C區(qū)分分布的影響見圖9,不同溫度條件下隨反應時間所得酶解液的SDS-PAGE電泳圖譜見圖10。
由圖8可見,隨反應時間的延長,溫度對NR、DH的變化影響基本一致。酶解1~3 h,NR增大,隨后NR下降。酶解初期(50~70 min之前),DH增長很快,80 min之后增加變緩。酶解溫度為60℃時,在相同的反應時間時,其酶解液的NR、DH都為最大,酶解的效果最好。
由圖9可見,反應溫度對木瓜蛋白酶的酶解反應及其Lundin分布的影響較大。隨著酶解反應的進行,基本呈現(xiàn)A、B區(qū)分的含量逐漸降低,C區(qū)分不斷升高的趨勢。酶解2 h后,C區(qū)分含量都在60%或60%以上,其中60℃的酶解溫度,C區(qū)分的含量最大,表明60℃下木瓜蛋白酶的酶解效果較突出。
在65℃,1~6 h的階段,其A區(qū)分的含量都比反應溫度55,60℃的大,表明在65℃的酶解,酶活力降低,酶解大分子蛋白的能力較差。
比較關(guān)注的B區(qū)分,對55,65℃的酶解溫度,在2~6 h階段,B區(qū)分保持在15%左右;60℃的酶解溫度,在2~4 h階段,B區(qū)分接近15%。
由圖10可見,當溫度增至65℃,反應1 h時出現(xiàn)了分子量大于43 000 Da的大分子多肽,表明此時酶的活力較弱,酶解大分子蛋白的能力較差,與圖9的Lundin分布圖上A區(qū)的變化情況一致(65℃時,其A區(qū)分的含量最大)。由此可見,要得到A區(qū)分分布較高的酶解液,可以通過提高反應溫度來實現(xiàn),但是較高的反應溫度會使得酶活力降低,使得NR、DH降低,綜合B區(qū)分等因素,選擇反應溫度為 55~60 ℃。
2.4 底物質(zhì)量分數(shù)對大豆蛋白酶解產(chǎn)物的影響
酶用量8 000 U/g,酶解溫度60℃,pH值6.0,底物質(zhì)量分數(shù)分別在4%,5%,6%,7%進行反應,過程滴加濃度為0.5 mol/L的NaOH溶液保持pH值6.0。取不同時間段的酶解液,測量其NR、DH,以及酶解液Lundin分布和電泳后的分子量分布。
底物質(zhì)量分數(shù)對蛋白質(zhì)回收率和水解度的影響見圖11,不同底物質(zhì)量分數(shù)下隨反應時間所得的酶解液的SDS-PAGE電泳圖譜見圖12。
由圖11可見,隨著底物質(zhì)量分數(shù)的提高,DH輕微地降低,較高底物質(zhì)量分數(shù)使得酶解液黏度增大,影響木瓜蛋白酶擴散,降低水分活度,對酶解反應有抑制作用。隨著底物質(zhì)量分數(shù)的提高,NR先升高,到底物質(zhì)量分數(shù)為6%之時,NR最大;7%時,NR又變小。酶解3 h之前,NR都隨酶解的進行而不斷升高,隨后的3~6 h階段,NR都逐漸輕微地降低。
由圖12可見,底物質(zhì)量分數(shù)對水解產(chǎn)物的分子量變化有一定的影響。7%的質(zhì)量分數(shù)在水解初期,可見還存在分子量接近于43 000 Da的大分子多肽;酶解至2.5 h,就只存在分子量小于或等于20 100 Da的多肽組分了。4%的質(zhì)量分數(shù)在酶解初期,還可見存在分子量接近于31 000 Da和大于20 100 Da的諸多的多肽譜帶;酶解至2.5 h,就只存在分子量(遠)小于20 100 Da的多肽組分了。
底物質(zhì)量分數(shù)與酶用量、pH值、溫度等試驗的幾個因素相比,屬于較次要的影響因素。考慮NR和DH,底物質(zhì)量分數(shù)為5%~6%比較適宜,為獲得較高的原料利用率,選擇6%。
3 結(jié)論
(1)為了得到可以與糖漿復配、用于部分或全部替代麥汁的酶解液,所選取的酶解條件并不是得到最佳水解度的酶解條件。當反應時間為1~2 h時,所得到的酶解液的Lundin分布較為接近麥汁Lundin區(qū)分分布的要求,此時的NR值為52.2%。
(2)木瓜蛋白酶制取含氮糖漿復配酶解液的最佳條件為酶解溫度55~60℃,底物質(zhì)量分數(shù)6%,酶用量8 000 U/g,pH值6.0,反應時間1~2 h,所得的酶解液為淺黃色,外觀較好,與啤酒糖漿相容、易混,口味風味和諧,因此采用木瓜蛋白酶制取啤酒糖漿復配的蛋白氮源的酶解液是可行的。
(3) 試驗發(fā)現(xiàn),就單獨使用Alcalase、Protamex和木瓜蛋白酶中的任何一種酶,發(fā)現(xiàn)在一定的酶用量、pH值、溫度、底物質(zhì)量分數(shù)和酶解時間下,所得到的大豆蛋白酶解液的Lundin分布,要與麥汁Lundin區(qū)分分布的A區(qū)分含量25%、B區(qū)分含量15%和C區(qū)分含量60%的要求相同,是很難或者不可能實現(xiàn)的,實際運用時也沒有必要,接近或者相近即可。因此,采用單(蛋白) 酶在各自不同的條件下進行酶解,測定的酶解液的Lundin分布,依此計算,按一定的質(zhì)量比例將其混合,得到的(混合的) 大豆酶解液,其Lundin分布更容易滿足麥汁Lundin區(qū)分分布的A區(qū)分含量25%、B區(qū)分含量15%和C區(qū)分含量60%的要求,是今后研究工作的方向。比如,木瓜蛋白酶的酶解液雖然蛋白質(zhì)回收率較低,但是其中高分子可溶性蛋白含量要比Alcalase、Protamex 2種酶的酶解所得酶解液中的高分子蛋白的含量多。因此,采用木瓜蛋白酶制取的蛋白酶解液,主要側(cè)重于提高復配蛋白酶解液中高分子蛋白的含量。
(4) 對于Alcalase、Protamex和木瓜蛋白酶酶解的大豆蛋白酶解液,以及麥汁中的可溶蛋白質(zhì),雖然參考文獻[17]的方法,按其溶解特性和分子量的大小,將其分為A、B和C的3種區(qū)分。但是,不同來源和酶解方法得到的樣品或麥汁,可溶蛋白的A區(qū)分或B區(qū)分或C區(qū)分,只是代表這些多肽組分具有相同的化學溶液溶解特性,以及相同相近的范圍分子量大小,它們各自的蛋白分子的化學結(jié)構(gòu)是不同的。各個相同區(qū)分的多肽,對啤酒酵母來說,是分子量相同相近而化學結(jié)構(gòu)不同的有機氮源的營養(yǎng)成分。因此,即使它們的Lundin區(qū)分分布都是A區(qū)分含量25%、B區(qū)分含量15%和C區(qū)分含量60%,但各自的使用效果和終端發(fā)酵產(chǎn)品品質(zhì),也一定會存在輕微的差異不同。①葡萄糖、麥芽糖、蔗糖和低聚糖等糖類,已經(jīng)比較清楚其在啤酒釀造過程的作用,以及對啤酒產(chǎn)品品質(zhì)的影響,從而指導了啤酒用淀粉糖漿的開發(fā)、生產(chǎn)和應用。對于這些相同區(qū)分的不同化學結(jié)構(gòu)和來源的大豆多肽,其對啤酒釀造和產(chǎn)品品質(zhì)的影響機理及其結(jié)果,是一個值得深入研究的課題。②在①理論研究的基礎(chǔ)上,對使用大豆或其他新的有機氮源進行替代或部分替代,用于啤酒或其他傳統(tǒng)食品的發(fā)酵,這種差異不同也將孕育產(chǎn)生新的風味、口感和差異化產(chǎn)品的可能,也指導著課題下一階段的工作研究重點。

