PD-1/PD-L1抑制劑治療非小細胞肺癌的療效及預后觀察
呂厚寬,莊文輝,黃一桂,許玫莎
海口市第三人民醫院1藥劑科,2呼吸科,海口571100
2015年,中國新發肺癌73.3萬例,死亡61.0萬例,發病率和病死率均居所有惡性腫瘤之首[1]。多數患者被確診時已屬于晚期,手術效果較差,治療以放射治療和藥物化療為主,療效不甚理想[2]。隨著腫瘤基礎研究的深入,越來越多關于腫瘤增殖、免疫耐受及免疫逃逸的機制被闡明,新的免疫治療靶點被發現[3]。程序性死亡受體-1(programmed cell death 1,PDCD1,也稱PD-1)廣泛表達于活化的免疫細胞表面,參與自身免疫耐受,而其配體程序性死亡受體配體-1(programmed cell death 1 ligand 1,PDCD1LG1,也稱PD-L1)是一種負性免疫共刺激分子,高表達于多種腫瘤細胞表面,如非小細胞肺癌(non-small cell lung cancer,NSCLC)、黑色素瘤及卵巢癌等[4],與腫瘤細胞的免疫逃逸密切相關。本研究應用納武利尤單抗(nivolumab)對43例一線化療無效或復發的晚期NSCLC患者進行治療和隨訪,以期為臨床更好的治療提供參考,現報道如下。
1 對象與方法
1.1 研究對象
選擇2018年1—12月海口市第三人民醫院診治的86例晚期NSCLC患者作為研究對象。納入標準:①經病理檢查或細胞學檢查確診為NSCLC;②TNM分期[6]為ⅢB~Ⅳ期;③經過鉑類化療藥物為主的治療后疾病進展或復發。排除標準:①因任何原因要求退出研究者;②合并其他系統原發腫瘤;③美國東部腫瘤協作組(Eastern Cooperative Oncology Group,ECOG)[5]評分≥2分。將86例NSCLC患者分為對照組(43例)和研究組(43例),兩組患者年齡、性別、病理類型、TNM分期、ECOG評分等基線特征比較,差異均無統計學意義(P>0.05),具有可比性。本研究經醫院倫理委員會審批通過。
1.2 治療方案
對照組采用多西他賽治療,每次劑量為75 mg/m2靜脈滴注1 h,每3周用藥1次。研究組采用納武利尤單抗治療,每次劑量為3 mg/kg靜脈滴注1 h,每2周用藥1次,直到患者出現不耐受或疾病進展。所有患者出現不良反應時均給予相應的對癥治療。
1.3 評價標準
療效評價標準參考實體瘤療效評價標準(1.1版)[7],所有患者均在治療9周首次進行療效評價,然后每6周評價1次,其中病灶完全消失為完全緩解(CR),病灶最大直徑減少超過30%為部分緩解(PR),病灶最大直徑增加超過20%或出現新的病灶為疾病進展(PD),病情穩定(SD)指病灶緩解未達到PR而疾病進展未達到PD。總有效率=(CR+PR)例數/總例數×100%。患者不良反應參考WHO抗癌藥物不良反應標準[8],由責任醫師和護士在用藥期間負責嚴密觀察和報告。
1.4 隨訪方法
隨訪從患者接受治療開始,隨訪終點為患者死亡,患者出院后每2周進行1次電話或門診隨訪。最終隨訪0.6~13.1個月,截止時間為2019年4月20日。
1.5 統計學方法
采用SPSS 22.0軟件對數據進行統計分析,計數資料以例數及率(%)表示,組間比較采用χ2檢驗;等級資料的比較采用Mann-WhitneyU檢驗;采用Kaplan-Meier法繪制生存曲線,以Log-rank進行分析。以P<0.05為差異有統計學意義。
2 結果
2.1 療效的比較
對照組總有效率為9.30%(4/43),與研究組的20.93%(9/43)比較,差異無統計學意義(χ2=2.266,P=0.132)。但研究組患者的療效明顯優于對照組,差異有統計學意義(U=168.000,P<0.01)。(表1)
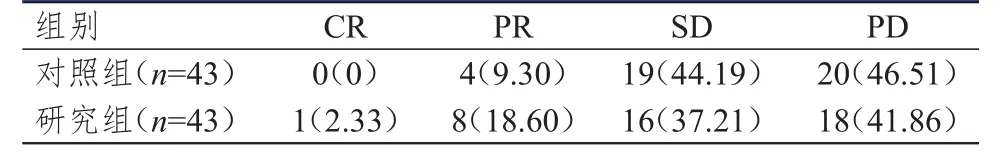
表1 兩組患者的療效[ n(%)]
2.2 不良反應的比較
研究組患者脫發、貧血、肌肉疼痛及中性粒細胞減少不良反應發生率均明顯低于對照組,差異均有統計學意義(P<0.01)。其中研究組患者肌肉疼痛和中性粒細胞減少發生率均為0。(表2)
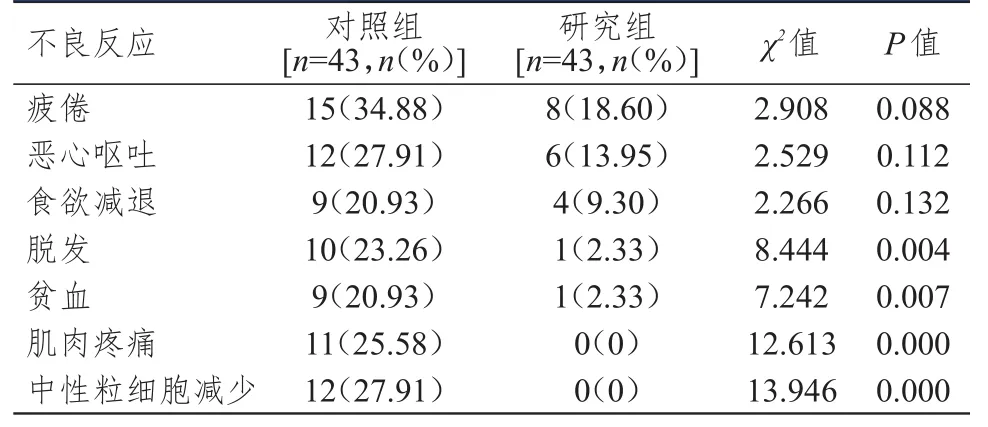
表2 兩組患者不良反應發生情況的比較
2.3 生存分析
隨訪0.6~13.1個月后,失訪0例。對照組患者中位生存時間為4.200個月(95%CI:2.787~5.613),1年累積生存率為6.98%;研究組患者中位生存時間為2.800個月(95%CI:2.029~3.571),1年累積生存率為18.60%。Log-rank檢驗顯示,兩組患者生存情況比較,差異無統計學意義(χ2=0.070,P=0.792)。(圖1)
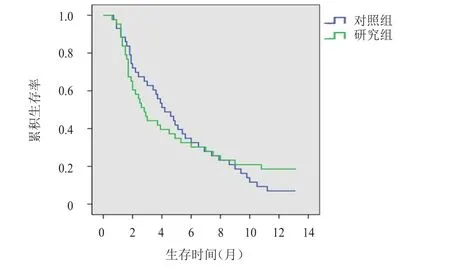
圖1 研究組(n=43)與對照組(n=43)患者的生存曲線
3 討論
多西他賽作為一線化療失敗或復發的晚期NSCLC患者的二線化療藥物,應用于臨床已經有20年[9]。楊罡和李勁[10]的Meta分析報道患者中位生存時間為5.6個月,1年總生存率僅為3.6%,因此多西他賽對這類患者預后改善效果仍然較差。近年來,免疫治療成為腫瘤研究的熱點領域,新的機制及新的作用靶點不斷被發現[11]。
免疫逃逸是腫瘤細胞難以被清除的重要原因[12]。Konishi等[13]研究發現,PD-L1廣泛表達于NSCLC細胞表面,通過多種機制參與了腫瘤細胞的免疫逃逸。Chen等[14]研究發現,PD-L1表達上調增加了白細胞介素-10(interleukin-10,IL-10)的分泌,而后者可介導細胞毒性T淋巴細胞(cytotoxicity T lymphocyte,CTL)的凋亡。Cao等[15]研究指出,PD-L1表達上調會下調鈣黏蛋白(calcium adhesion protein,CAP)的表達,對腫瘤細胞的上皮-間充質轉化及免疫逃逸起到了促進作用。此外,PD-1/PD-L1還可以影響T細胞能量代謝,導致CTL能量耗竭而提前凋亡[16]。
本研究結果顯示,對照組總有效率為9.30%,與以往文獻報道[17]結果接近,研究組總有效率為20.93%,兩組患者療效比較,差異有統計學意義(P<0.01)。而對照組與研究組患者1年生存率比較,差異無統計學意義(χ2=0.070,P=0.792)。提示整體上納武利尤單抗是能夠使NSCLC患者獲益的,但有效率仍然較低。因此,有學者指出,臨床上可以通過免疫組化技術篩選PD-L1表達水平高的患者,以提高患者對納武利尤單抗的有效率[18]。但是,由于腫瘤具有異質性,尤其是晚期NSCLC或經過化療的患者,目前的方法仍難以反映患者腫瘤細胞整體的PD-L1表達水平,無法實現標準化檢測,從而預測患者對納武利尤單抗的反應性[19]。
由于本研究所選取患者均經過了鉑類一線化療方案的治療,患者免疫功能可能低于常人,CTL對PD-L1表達下調腫瘤細胞的細胞毒作用可能較低[20]。生存分析結果顯示,對照組中位生存時間(4.20個月)長于研究組(2.80個月),但差異無統計學意義(χ2=0.070,P=0.792)。因此,研究治療NSCLC的納武利尤單抗聯合用藥同樣重要,對于免疫功能較差的患者,多西他賽等細胞毒性藥物在短期內對控制腫瘤細胞增殖仍然是有效,甚至優于PD-L1抑制劑。Hellmann等[21]研究發現,納武利尤單抗聯合厄洛替尼治療晚期NSCLC的客觀有效率可達47.37%(18/38)。
納武利尤單抗為人源化單克隆抗體,同其他治療型單克隆抗體藥物一樣,毒性遠小于普通化療藥物,更容易被患者接受。本研究結果顯示,研究組脫發、貧血、肌肉疼痛及中性粒細胞減少不良反應發生率均明顯低于對照組,差異均有統計學意義(P<0.01),提示納武利尤單抗安全性較好。
綜上所述,納武利尤單抗安全性較好,可使一線化療失敗或復發的晚期NSCLC患者獲益。

