硝酸甘油片參比制劑與仿制制劑的體外質(zhì)量一致性評價
孫婷 姜建國 張菁 張西如 徐艷梅 王柳 蔣凝


中圖分類號 R927.1 文獻標志碼 A 文章編號 1001-0408(2020)05-0586-05
DOI 10.6039/j.issn.1001-0408.2020.05.16
摘 要 目的:考察國內(nèi)硝酸甘油片仿制制劑與參比制劑(原研藥)的體外質(zhì)量一致性。方法:參照硝酸甘油片進口藥品注冊標準JX20010267測定硝酸甘油片1批參比制劑(A廠家)和4批仿制制劑(B、C、D、E廠家)中硝酸甘油和有關(guān)物質(zhì)的含量。采用溶出度測定方法中的槳法,轉(zhuǎn)速為50 r/min,以高效液相色譜法測定上述5批制劑在4種不同溶出介質(zhì)(pH 1.2鹽酸溶液、pH 4.0醋酸鹽緩沖液、pH 6.8磷酸鹽緩沖液、水)中10 min內(nèi)的溶出量,計算累積溶出度,繪制溶出曲線,并以2、5、8 min時的累積溶出度計算相似因子(f2),評價溶出曲線的相似性。結(jié)果:A、B、C、D、E廠家制劑中硝酸甘油含量分別為99.8%、98.3%、94.0%、93.3%、96.7%(n=2),有關(guān)物質(zhì)含量分別為0.46%、0.55%、0.63%、0.72%、0.49%(n=2)。以A廠家參比制劑為對照,在pH 1.2鹽酸溶液中B、C、D、E廠家仿制制劑的f2分別為74、28、25、67,在pH 4.0醋酸鹽緩沖液中的f2分別為76、26、28、84,在pH 6.8磷酸鹽緩沖液中的f2分別為79、39、35、71,在水中的f2分別為69、32、37、62。結(jié)論:本方法適用于硝酸甘油片仿制制劑的體外質(zhì)量一致性評價。與參比制劑比較,C、D廠家的仿制制劑主藥含量較低,體外溶出曲線不具有相似性。
關(guān)鍵詞 硝酸甘油片;仿制制劑;參比制劑;溶出介質(zhì);溶出曲線;相似性;體外質(zhì)量;一致性評價
Consistency Evaluation of in vitro Quality of Nitroglycerin Tablet Reference Preparation and Imitative Preparation
SUN Ting,JIANG Jianguo,ZHANG Jing,ZHANG Xiru,XU Yanmei,WANG Liu,JIANG Ning(Hebei Institute for Drug Control, Shijiazhuang 050011, China)
ABSTRACT? ?OBJECTIVE: To investigate the in vitro quality consistency of domestic Nitroglycerin tablet imitative preparation and reference preparation (original drug). METHODS: The contents of nitroglycerin and related substances in 1 batch of Nitroglycerin tablet reference preparation (manufacturer A) and 4 batches of imitative preparation (manufacturer B, C, D, E) were determined according to Nitroglycerin Tablet Import Drugs Registration Standard JX20010267. The paddle method of dissolution determination method was adopted, with the rotating speed of 50 r/min. HPLC method was adopted to determine the dissolution amount of 5 batches of above preparations in 4 kinds of dissolution mediums (pH 1.2 hydrochloric acid solution, pH 4.0 acetate buffer solution, pH 6.8 phosphate buffer solution, water) within 10 min.The accumulative dissolution rate was calculated, and dissolution curves of samples were drawn.The similarity of the dissolution curves was evaluated by calculating similarity factor (f2) of 2, 5, 8 min accumulative dissolution rate. RESULTS: The contents of nitroglycerin in the preparations from manufacturer A, B, C, D, E were 99.8%, 98.3%, 94.0%, 93.3%, 96.7%, respectively (n=2); the contents of related substance were 0.46%, 0.55%, 0.63%, 0.72%, 0.49%, respectively (n=2). Using reference preparation of manufacturer A as control, f2 of imitative preparation from manufacturer B, C, D, E were 74, 28, 25, 67 in pH 1.2 hydrochloric acid solution; 76, 26, 28, 84 in pH 4.0 acetate buffer solution; 79, 39, 35, 71 in pH 6.8 phosphate buffer solution; 69, 32, 37, 62 in water, respectively. CONCLUSIONS: The method is suitable for in vitro quality consistency evaluation of Nitroglycerin table timitative preparation. Compared with reference preparation, the contents of main components in the imitative preparations from manufacturer C, D are lower; in vitro dissolution curves of those imitative preparation are not similar to reference preparation.
KEYWORDS? ?Nitroglycerin tablet; Imitative preparation; Reference preparation; Dissolution media; Dissolution curve; Similarity; in vitro quality; Consistency evaluation
硝酸甘油是一種用來治療心絞痛、心力衰竭和心肌梗死的硝基類血管擴張藥[1]。治療急性心絞痛時,硝酸甘油以舌下含服、舌下噴霧或口腔含服的形式給藥,這些給藥方式均能快速地發(fā)揮療效,并且能快速地緩解疼痛[1]。硝酸甘油片已列入《國家基本藥物目錄》2012年版,屬于生物藥劑學(xué)分類系統(tǒng)(BCS)中的Ⅰ類藥物,目前,2015年版《中國藥典》(二部)[2]、《美國藥典》41版[3]等國內(nèi)外藥典均收載了該品種。為了考察國產(chǎn)硝酸甘油片仿制制劑與原研制劑在質(zhì)量上是否一致,本研究以國家藥品監(jiān)督管理局(NMPA)公布的第一批參比制劑目錄里美國輝瑞制藥有限公司生產(chǎn)的舌下含服硝酸甘油片為參比制劑,比較其與國產(chǎn)硝酸甘油片仿制制劑中硝酸甘油的含量及有關(guān)物質(zhì),同時通過考察溶出曲線相似性對兩者的體外溶出行為進行一致性評價,從而為硝酸甘油片的仿制藥質(zhì)量與療效一致性評價工作提供技術(shù)支持,為該品種質(zhì)量標準的提高提供參考。
1 材料
1.1 儀器
Aglient 1260型高效液相色譜儀(美國Aglient公司);UDT-812型智能溶出度試驗儀(美國Logan公司); EDT-14Lx型智能試驗溶出儀(上海儀真分析儀器有限公司); PB-10型酸度計、XS205 型電子分析天平[梅特勒-托利多國際貿(mào)易(上海)有限公司]; FAVD-25型真空脫氣儀(上海富科思分析儀器有限公司)。
1.2 藥品與試劑
硝酸甘油溶液標準物質(zhì)[中國食品藥品檢定研究院,批號:100236-201702,標示量:0.963%(m/m)];硝酸甘油片(參比制劑廠家A,批號:N30287,規(guī)格:0.6 mg; 仿制制劑廠家B、C、D、E,批號分別為:B0701、C0702、D0703、E0704,規(guī)格:均為0.6 mg);鹽酸、冰醋酸、醋酸鈉、磷酸二氫鉀、氫氧化鈉(國藥集團化學(xué)試劑有限公司,批號分別為:20180102、20160118、20170521、20170822、20170323,分析純);甲醇為色譜純;水為純化水。
2 方法與結(jié)果
2.1 含量測定與有關(guān)物質(zhì)檢查
按照硝酸甘油片進口藥品注冊標準JX20010267[4]對收集到的1批參比制劑和4個廠家的各1批仿制制劑進行含量測定和有關(guān)物質(zhì)檢查,結(jié)果見表1。
表1 參比制劑和仿制制劑中硝酸甘油及有關(guān)物質(zhì)含量測定結(jié)果(n=2,%)
2.2 溶出度試驗條件的確定
2.2.1 溶出方法和轉(zhuǎn)速的選擇 經(jīng)查閱美國FDA溶出曲線庫中的方法(https://www.accessdata.fda.gov/scripts/cder/daf/#apphist)和硝酸甘油片進口藥品注冊標準JX20010267[4],其中溶出方法均選擇槳法,轉(zhuǎn)速均為50? r/min。另有文獻研究表明,對于片劑,建議采用槳法、轉(zhuǎn)速為50 r/min進行溶出試驗,因為通常認為 50 r/min 與中老年人體內(nèi)胃腸道蠕動強度基本一致[5]。因此,本研究所采用的溶出方法為槳法,轉(zhuǎn)速為50 r/min。
2.2.2 溶出介質(zhì)和溶出體積的選擇 硝酸甘油屬于酯類藥物[6],通過測定其酸度系數(shù)(pKa),結(jié)果為9.13(當(dāng)pKa>3.0時可看作為堿性藥物)[5]。依據(jù)硝酸甘油的基本特性,結(jié)合日本《仿制藥生物等效性試驗指導(dǎo)原則(2012版)》中的溶出度研究內(nèi)容[7],篩選出4種溶出介質(zhì),分別為pH 1.2鹽酸溶液、pH 4.0醋酸鹽緩沖液、pH 6.8磷酸鹽緩沖液、水。溶出體積依據(jù)硝酸甘油片進口藥品注冊標準JX20010267[4],選擇常用體積中的500 mL。
2.2.3 取樣時間的選擇 硝酸甘油片為舌下含服的快速起效降壓藥,其取樣時間的選擇與普通口服固體制劑的取樣時間的選擇存在一定差異。根據(jù)美國FDA溶出曲線庫中的方法和硝酸甘油片進口藥品注冊標準JX20010267[4]中溶出度、崩解時限檢驗方法,選擇硝酸甘油片溶出度試驗的取樣時間分別為1、2、3、5、8、10 min。
2.3 溶出曲線測定的方法學(xué)考察
2.3.1 對照品溶液的制備 精密稱取硝酸甘油溶液標準物質(zhì)適量,置于10 mL量瓶中,加無水乙醇溶解并稀釋至刻度,搖勻,即得質(zhì)量濃度為0.1 mg/mL的對照品貯備液。精密量取上述貯備液1 mL,置于100 mL量瓶中,加溶出介質(zhì)溶解并稀釋至刻度,搖勻,即得對照品溶液。
2.3.2 供試品溶液的制備 取樣品1片,分別以pH 1.2 鹽酸溶液、pH 4.0醋酸鹽緩沖液、pH 6.8磷酸鹽緩沖液、水為溶出介質(zhì),按槳法、轉(zhuǎn)速為50 r/min、溶出介質(zhì)體積為500 mL進行溶出度試驗。分別于1、2、3、5、8、10 min時,吸取溶出液 1 mL(每次取液后均補加相同溫度的溶出介質(zhì) 1 mL),用 0.45 μm 微孔濾膜過濾后,作為供試品溶液。平行操作12片。
2.3.3 色譜條件 色譜柱:Waters Symmetry C18(250 mm×4.6 mm,5 μm);流動相:甲醇-水(40 ∶ 60,V/V);檢測波長:220 nm;柱溫:30 ℃;流速:1.0 mL/min;進樣量:100 μL。
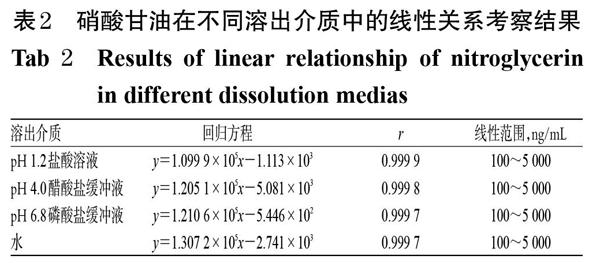
2.3.4 線性關(guān)系考察 精密量取“2.3.1”項下對照品貯備液0.1、0.2、0.5、1.0、2.0、5.0 mL,分別置于不同100 mL量瓶中,再分別以pH 1.2 鹽酸溶液、pH 4.0醋酸鹽緩沖液、pH 6.8磷酸鹽緩沖液、水稀釋至刻度后,按“2.3.3”項下色譜條件進樣測定,記錄峰面積。以硝酸甘油質(zhì)量濃度(x,ng/mL)為橫坐標、峰面積(y)為縱坐標進行線性回歸分析,結(jié)果見表2。
表2 硝酸甘油在不同溶出介質(zhì)中的線性關(guān)系考察結(jié)果
2.3.5 檢測限與定量限考察 精密量取“2.3.1”項下硝酸甘油對照品溶液,以溶出介質(zhì)逐級稀釋后,按“2.3.3”項下色譜條件進樣分析。當(dāng)信噪比為3 ∶ 1時,硝酸甘油在pH 1.2 鹽酸溶液、pH 4.0醋酸鹽緩沖液、pH 6.8磷酸鹽緩沖液、水中的檢測限分別為54、51、58、55 ng/mL;當(dāng)信噪比為10 ∶ 1時,硝酸甘油在上述4種溶出介質(zhì)中的定量限分別為177、168、193、181 ng/mL。
2.3.6 精密度試驗 精密稱取A廠家的硝酸甘油片樣品(批號:N30287)適量,按“2.3.2”項下方法制成供試品溶液,再按“2.3.3”項下色譜條件連續(xù)進樣測定6次,記錄峰面積。結(jié)果,硝酸甘油在pH 1.2鹽酸溶液、pH 4.0醋酸鹽緩沖液、pH 6.8磷酸鹽緩沖液、水中峰面積的RSD分別為0.33%、0.47%、0.61%、0.58%(n=6),表明本方法精密度良好。
2.3.7 穩(wěn)定性試驗 精密稱取A廠家的硝酸甘油片樣品(批號:N30287)適量,按“2.3.2”項下方法制成供試品溶液,分別于室溫下放置0、1、2、4、6、8、12 h時,按“2.3.3”項下色譜條件進樣測定,記錄峰面積。結(jié)果,硝酸甘油在pH 1.2鹽酸溶液、pH 4.0醋酸鹽緩沖液、pH 6.8磷酸鹽緩沖液、水中峰面積的RSD 分別為1.0%、1.2%、0.9%、1.4%(n=7),表明供試品溶液在室溫下放置12 h穩(wěn)定性良好。
2.3.8 重復(fù)性試驗 精密稱取A廠家的硝酸甘油片樣品(批號:N30287)適量,共6份,按“2.3.2”項下方法制成供試品溶液,再按“2.3.3”項下色譜條件進樣測定,記錄峰面積,計算溶出度。結(jié)果硝酸甘油在pH 1.2 鹽酸溶液、pH 4.0醋酸鹽緩沖液、pH 6.8磷酸鹽緩沖液、水中溶出度的RSD分別為 0.6%、0.7%、0.5%、0.8%(n=6),表明本方法的重復(fù)性良好。
2.3.9 回收率試驗 按硝酸甘油片平均溶出量的80%、100%、120%精密稱取硝酸甘油溶液標準物質(zhì)適量,共9份,每個濃度3份,按規(guī)格為0.6 mg的硝酸甘油片處方比例加入相應(yīng)的混合輔料,置于 10 mL量瓶中,用無水乙醇溶解并稀釋至刻度,濾過。取續(xù)濾液1 mL,置于100 mL 量瓶中,分別加 pH 1.2 鹽酸溶液、pH 4.0醋酸鹽緩沖液、pH 6.8 磷酸鹽緩沖液、水稀釋至刻度,按“2.3.3”項下色譜條件進樣測定,記錄峰面積,代入回歸方程計算含量及回收率。結(jié)果,硝酸甘油在上述4種溶出介質(zhì)中的平均回收率分別為 98.6%、99.7%、98.2%、99.4%,RSD均小于2.0%(n=9),表明本方法的準確度良好。
2.4 溶出儀的選擇
分別選用UDT-812 型智能溶出度試驗儀和EDT- 14Lx型智能試驗溶出儀,取A廠家的硝酸甘油片樣品(批號:N30287)適量,分別以 pH 1.2鹽酸溶液、pH 4.0醋酸鹽緩沖液、pH 6.8磷酸鹽緩沖液和水500 mL作為溶出介質(zhì),按槳法(轉(zhuǎn)速50 r/min)進行溶出試驗。分別于1、2、3、5、8、10 min時吸取溶出液(每次取樣后補充同溫度的等量溶出介質(zhì)),過濾后,按“2.3.3”項下色譜條件進樣測定計算溶出量和累積溶出度,繪制溶出曲線。每種溶出介質(zhì)中測試 12 片樣品。結(jié)果,2個品牌儀器測定繪制的溶出曲線相似,測定結(jié)果基本一致,本研究以UDT-812型智能溶出度試驗儀為溶出儀進行評價。不同溶出儀測得的樣品在4種溶出介質(zhì)中的溶出曲線見圖1。
2.5 參比制劑和仿制制劑溶出曲線一致性考察
2.5.1 參比制劑和仿制制劑溶出曲線繪制 取收集到的硝酸甘油片1批參比制劑和4批國產(chǎn)仿制制劑樣品,按“2.2”項下條件進行溶出度試驗,再按“2.3.3”項下色譜條件進樣測定,代入回歸方程計算每片樣品各取樣點的累積溶出度。每批樣品平行12片操作,以各時間點12片樣品的累積溶出度平均值為縱坐標、溶出時間為橫坐標繪制溶出曲線。結(jié)果,C、D廠家樣品與A廠家參比制劑樣品在pH 1.2鹽酸溶液、pH 4.0醋酸鹽緩沖液、pH 6.8磷酸鹽緩沖液、水4種溶出介質(zhì)中的溶出行為均不相似,B、E廠家樣品與參比制劑的溶出曲線較為相似,溶出曲線見圖2。
2.5.2 參比制劑與仿制制劑溶出曲線的一致性評價 美國FDA 和我國藥品審評中心的指導(dǎo)原則均推薦采用相似因子(f2)法來評價試驗藥品與對照藥品體外溶出曲線的差異,當(dāng)f2值在50~100范圍內(nèi)時,認為 2 條溶出曲線相似[5]。在pH 1.2鹽酸溶液、pH 4.0醋酸鹽緩沖液、pH 6.8磷酸鹽緩沖液、水4種溶出介質(zhì)中,以時間點2、5、8 min[6]的累積溶出度計算f2來判斷仿制制劑與參比制劑的相似性。結(jié)果,C、D廠家樣品在4種溶出介質(zhì)中的體外溶出曲線與參比制劑不相似,B、E廠家樣品的體外溶出曲線與參比制劑相似,與“2.5.1”項下溶出曲線圖結(jié)果一致。仿制制劑與參比制劑的f2計算結(jié)果見表3。
表3 仿制制劑與參比制劑的f2計算結(jié)果(n=12)
3 討論
通過查閱2015年版《中國藥典》(二部)[2]、《美國藥典》41版[3]、《日本藥典》第17改正版[8]和硝酸甘油片進口藥品注冊標準JX20010267[4],比較各質(zhì)量標準中有關(guān)硝酸甘油片含量測定和有關(guān)物質(zhì)項下色譜條件、系統(tǒng)適用性試驗、檢驗限度等的要求,發(fā)現(xiàn)《日本藥典》第17改正版和《美國藥典》41版均未收載硝酸甘油片有關(guān)物質(zhì)檢查項,2015年版《中國藥典》(二部)中硝酸甘油片含量測定的檢驗限度較寬泛。綜合以上國內(nèi)外質(zhì)量標準,最終確定采用硝酸甘油片進口藥品注冊標準JX20010267對硝酸甘油片中硝酸甘油及有關(guān)物質(zhì)含量進行測定。結(jié)果顯示,C、D廠家樣品的有關(guān)物質(zhì)相對較高,主藥含量相對較低。
本研究建立的硝酸甘油片溶出曲線方法,其中所采用的溶出方法、溶出介質(zhì)、轉(zhuǎn)速、溶出體積等條件均符合2015年版《中國藥典》(四部)通則0931溶出度與釋放度測定法[9]的要求,所采用的高效液相色譜法具有較高的靈敏度和較好的準確度,適用于該品種的相關(guān)質(zhì)量評價。
經(jīng)查閱NMPA網(wǎng)站可知,目前國內(nèi)生產(chǎn)硝酸甘油片的廠家共有13家,網(wǎng)站公布的已批準通過仿制藥質(zhì)量和療效一致性評價的品種目錄中還未出現(xiàn)該品種,但在公布的第一批參比制劑目錄中已收錄了硝酸甘油片。由此可見,對硝酸甘油片仿制制劑與參比制劑進行一致性評價具有一定的研究價值。本文參照相關(guān)文獻方法[10-14],對收集到硝酸甘油片1批參比制劑和4批仿制制劑進行評價。從溶出曲線和f2的結(jié)果可以看出,C、D廠家樣品溶出行為與參比制劑差異較大。經(jīng)筆者調(diào)研考察,分析以上結(jié)果可能是生產(chǎn)企業(yè)在生產(chǎn)中未控制好混合后濕顆粒的干燥溫度,而硝酸甘油對熱不穩(wěn)定所致[15]。建議相關(guān)企業(yè)考察硝酸甘油片樣品與參比制劑是否具有體內(nèi)生物等效性。
參考文獻
[ 1 ] 英國大不列顛藥物學(xué)會.馬丁代爾大藥典[S]. 36版.倫敦:藥典出版社,2009:1248-1250.
[ 2 ] 國家藥典委員會.中華人民共和國藥典:二部[S]. 2015年版.北京:中國醫(yī)藥科技出版社,2015:1291-1293.
[ 3 ] 美國藥典委員會.美國藥典[S]. 41版.巴爾的摩:聯(lián)合圖書出版社,2018:4067-4068.
[ 4 ] 國家食品藥品監(jiān)督管理局. JX20010267? ?進口藥品注冊標準[S]. 2001-02.
[ 5 ] 張啟明,謝沐風(fēng),寧保明,等.采用多條溶出曲線評價口服固體制劑的內(nèi)在質(zhì)量[J].中國醫(yī)藥工業(yè)雜志,2009,40(12):946-955.
[ 6 ] 仉文升,李安良.藥物化學(xué)[M].北京:高等教育出版社,2002:290.
[ 7 ] 日本厚生省.仿制藥生物等效性試驗指導(dǎo)原則:2012版[S]. 2012-02-29.
[ 8 ] 日本藥局方編輯委員會.日本藥典[S].第17改正版.東京:日本厚生省,2017:1317-1318.
[ 9 ] 國家藥典委員會.中華人民共和國藥典:四部[S]. 2015年版.北京:中國醫(yī)藥科技出版社,2015:121-124.
[10] 郭曉梅,趙青威,馬葵芬,等.環(huán)孢素軟膠囊原研藥與仿制藥體外一致性評價[J].中國現(xiàn)代應(yīng)用藥學(xué),2016,33(6):759-762.
[11] 朱培曦,魏煒,陸靜嫻,等.去痛片溶出度測定方法的研究[J].中國現(xiàn)代應(yīng)用藥學(xué),2017,34(2):272-275.
[12] 國家食品藥品監(jiān)督管理總局.普通口服固體制劑溶出度試驗技術(shù)指導(dǎo)原則[S]. 2015-02-05.
[13] 孫婷,姜建國,郭永輝,等.不同廠家比沙可啶腸溶片仿制制劑與參比制劑溶出曲線的相似性評價[J].中國藥房,2017,28(9):1268-1271.
[14] 孫婷,姜建國,劉云,等.雙溶出-HPLC 系統(tǒng)在鹽酸特拉唑嗪片一致性評價中的應(yīng)用[J].沈陽藥科大學(xué)學(xué)報,2017,34(11):987-993.
[15] 汪磊,陳玉文,郝桂明.國家評價性抽驗結(jié)果論硝酸甘油片的質(zhì)量[J].沈陽藥科大學(xué)學(xué)報,2016,33(3):249-252.
(收稿日期:2019-07-05 修回日期:2019-10-12)
(編輯:鄒麗娟)

