基于廣西普通野生稻染色體片段代換系的落粒性QTL鑒定及相關主效QTL定位
袁睿智 黃澤鍵 羅亮 趙能 陳媛 梁燕青 萬瑤 劉芳 李容柏


摘要:【目的】挖掘廣西普通野生稻(Oryza rufipogon Griff.)蘊藏的落粒性基因,為廣西普通野生稻進化及栽培稻起源等研究提供參考依據。【方法】通過雜交、回交和分子標記輔助選擇(MAS)等方法構建廣西普通野生稻DP30和DP15的染色體單片段代換系(CSSLs)群體(DP30-CSSLs和DP15-CSSLs),對CSSLs群體進行落粒性鑒定和數量性狀位點(QTL)分析;并以篩選出的強落粒性代換系Y99(CSSL-Y99)與受體親本93-11雜交構建次級F2群體,對落粒性相關QTL進行定位。【結果】構建出由144個CSSLs組成的DP30-CSSLs群體和由59個CSSLs組成的DP15-CSSLs群體。DP30-CSSLs群體代換片段累計全長737.5 Mb,對DP30全基因組的覆蓋率約為94.71%;DP15-CSSLs群體代換片段累計全長337.36 Mb,對DP15全基因組的覆蓋率約為73.11%。從2個廣西普通野生稻CSSLs群體中鑒定出12個落粒性CSSLs(CSSL-Y104、CSSL-Y68、CSSL-Y83、CSSL-Y328、CSSL-Y235、CSSL-Y64、CSSL-Y63-2、CSSL-Y303、CSSL-Y99、CSSL-Y106-3、CSSL-Z37和CSSL-Z38),檢測出6個落粒性QTLs(qSH2.1、qSH4.1、qSH5.1、qSH9.1、qSH11.1和qSH11.2)。其中,qSH11.1的加性效應(-37.5)和表型貢獻率(-23.4%)最高。利用在qSH11.1所在區間內開發的6對InDel分子標記(M1、M2、M3、M4、M5和M6)對從次級F2群體進行基因型分析,篩選出4個重組單株(43、167、128和136),并將落粒性主效QTL qSH11.1定位于第11染色體M5~M6間約1.5 Mb的范圍內。【結論】從構建的廣西普通野生稻核心種質資源(DP30和DP15)CSSLs群體中檢測出6個落粒性QTLs,主效QTL qSH11.1定位于第11染色體M5~M6間約1.5 Mb的范圍內,是新發現的落粒性QTL。
關鍵詞: 普通野生稻;落粒性;染色體片段代換系(CSSLs);數量性狀位點(QTL);廣西
中圖分類號: S511.9? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ?文獻標志碼: A 文章編號:2095-1191(2020)05-1004-09
Abstract:【Objective】Based on exploitation of the shattering genes from Guangxi common wild rice(Oryza rufipogon Griff.), in order to provide a reference for the study of the evolution of Guangxi common wild rice and the origin of cultivated rice (O. sativa L.). 【Method】DP30-CSSLs and DP15-CSSLs, two chromosome segment substitution lines (CSSLs) populations of Guangxi common wild rice were constructed respectively by hybridization, backcrossing and molecular marker-assisted selection(MAS), which were used for shattering identification and quantitative trait loci(QTL) analysis. The secondary F2 population was constructed by crossing the strong shattering substitution line Y99 (CSSL-Y99) with the recipient parent 93-11 to map the shattering-related QTL. 【Result】DP30-CSSLs population consisted of 144 DP30-CSSLs and DP15-CSSLs population consisted of 59 DP15-CSSLs were obtained. The total length of DP30-CSSLs population was 737.5 Mb, covering 94.71% of DP30 genome; while the total length of DP15-CSSLs population was 337.36 Mb, covering 73.11%. of DP15 genome. Twelve CSSLs(CSSL-Y104,CSSL-Y68,CSSL-Y83,CSSL-Y328, CSSL-Y235,CSSL-Y64,CSSL-Y63-2,CSSL-Y303,CSSL-Y99,CSSL-Y106-3,CSSL-Z37 and CSSL-Z38) showed shattering trait and six grain-shattering QTLs(qSH2.1, qSH4.1, qSH5.1, qSH9.1, qSH11.1 and qSH11.2) were identified from the two Guangxi common wild rice CSSLs populations. Among them, qSH11.1 had the highest additive effect(-37.5) and phenotypic contribution rate(-23.4%). Six pairs of InDel molecular markers(M1, M2, M3, M4, M5 and M6) were developed in the interval of qSH11.1 to analyze the genotypes from the secondary F2 population, and four recombinant plants(43,167,128 and 136) were selected. A major grain-shattering QTL qSH11.1 from CSSL Y99 was mapped to the approximately 1.5 Mb region between M5-M6 on chromosome 11. 【Conclusion】Six shattering QTLs are detected from DP30-CSSLs and DP15-CSSLs. Among them, the major QTL qSH11.1 is located in the range of about 1.5 Mb between the M5-M6 on chromosome 11, which is a newly discovered shattering QTL.
Key words:common wild rice(Oryza rufipogon Griff.); grain shattering; chromosome segment substitution lines (CSSLs); quantitative trait loci (QTL); Guangxi
Foundation item: Guangxi Innovation Driven Development Special Project (Guike AA17204070)
0 引言
【研究意義】普通野生稻(Oryza rufipogon Griff.)是水稻育種的種質資源寶庫,具有許多與栽培稻(O. sativa L.)存在顯著差異的優良性狀(Huang et al.,2012;Stein et al.,2018)。栽培稻在長期的人工馴化過程中,丟失了許多優良性狀且遺傳基礎變窄(Doebley et al.,2006;江川等,2018),優良數量性狀位點(QTL)的丟失極大限制了栽培稻產量和品質的進一步提高(Wu et al.,2020)。因此,加強普通野生稻農藝及抗逆等優良性狀的研究與利用,對揭示水稻的馴化起源及提高栽培稻的產量和品質均具有重要意義。【前人研究進展】經人工馴化后,許多不同物種間的相同性狀被固定下來,如分蘗角度、株型及種子落粒性變化等(Yu et al.,2008;Zhang et al.,2009;Wu et al.,2013)。落粒性對水稻種子傳播有積極作用,但不利于人們收獲。相對于野生稻而言,栽培稻種子成熟時仍保留在穗部(Zhang et al.,2009)。因此,不落粒性作為水稻馴化過程中一個人為選擇的重要性狀,有效保證了水稻的收獲產量,而開展落粒性研究對了解水稻起源演化具有重要意義(Zhao et al.,2015)。水稻落粒性是一個復雜的生物學性狀,其中離層(Abscission zone,AZ)形成和斷裂是控制落粒的主要原因(Zhou et al.,2012)。AZ是小枝梗與種子間的連接部位,由一層或數層形態相似的致密細胞組成(Yan et al.,2015)。在前人的相關研究中,已有多個控制水稻落粒性的QTLs被檢測出來,并克隆獲得SH1、SHAT1和GL4等落粒性基因(Lin et al.,2007;Zhang et al.,2009;Huang et al.,2012;Zhou et al.,2012;Wu et al.,2017)。其中,SH1基因位于第1染色體上,cDNA序列全長2450 bp,包含4個外顯子,編碼612個氨基酸殘基。qSH1基因開放閱讀框12 kb的5'端調節區存在一個單核苷酸多態性(SNP)位點,在Kasalath中為G,在日本晴中則為T(Zhang et al.,2009)。qSH1基因編碼一個BEL1類型的同源異型蛋白,主要影響水稻AZ的發育。qSH1基因在花器官分化期及花序軸和枝梗快速伸長期的花序原基表達,還在花藥和小穗基部將要形成脫離層的區域表達;花序軸形成期在不落粒品種日本晴的花序原基也有表達,但在花器官分化期及花序軸和枝梗快速伸長期的小穗基部將要形成脫離層的區域并未表達(Huang et al.,2012)。SH4基因是一個影響水稻落粒性的主效QTL,且編碼一個未知功能的轉錄因子,而影響水稻AZ形成(Xiong et al.,1999)。Lin等(2007)從栽培稻克隆獲得的SHAT1基因與SH4基因是等位基因,二者的不同之處在于SHAT1基因并不影響AZ形成。SHAT1基因編碼的APETALA2轉錄因子是落粒性形成的必需條件,并參與AZ發育(Lin et al.,2007)。SHAT1基因在亞洲栽培稻中廣泛存在,對其進行研究有助于探索水稻的秈粳分化機理(Zhou et al.,2012)。在水稻的馴化過程中,SH4非落粒等位基因被人為選擇保留下來(Zhang et al.,2009)。除了SH1和SHAT1基因外,GL4基因通過調控外穎和內穎縱向細胞的伸長,而控制非洲栽培稻的粒長,同時能調控種子落粒性,主要在幼穗中表達,其次是莖部,在葉片和根部不表達;GL4基因發生單核苷酸突變時提前產生終止密碼子,致使種子粒長寬變小、落粒性喪失,進而影響水稻產量(Wu et al.,2017)。【本研究切入點】染色體單片段代換系(CSSLs)是基因挖掘的理想群體,可從普通野生稻CSSLs群體中挖掘出更多新的落粒性基因。廣西野生稻遺傳多樣性豐富,但至今鮮見有關廣西普通野生稻落粒性基因挖掘的研究報道。【擬解決的關鍵問題】通過構建CSSLs群體發掘廣西普通野生稻中與落粒性相關QTL,為落粒性基因精細定位和克隆打下基礎,同時為廣西普通野生稻進化及栽培稻起源等研究提供參考依據。
1 材料與方法
1. 1 試驗材料
試驗材料包括普通野生稻DP30和DP15及栽培稻品種93-11。其中,DP30和DP15是廣西普通野生稻核心種質,由亞熱帶農業生物資源保護與利用國家重點實驗室提供,易落粒;93-11為測序品種,是優良栽培秈稻中的常用恢復系,不易落粒。
1. 2 普通野生稻CSSLs群體構建
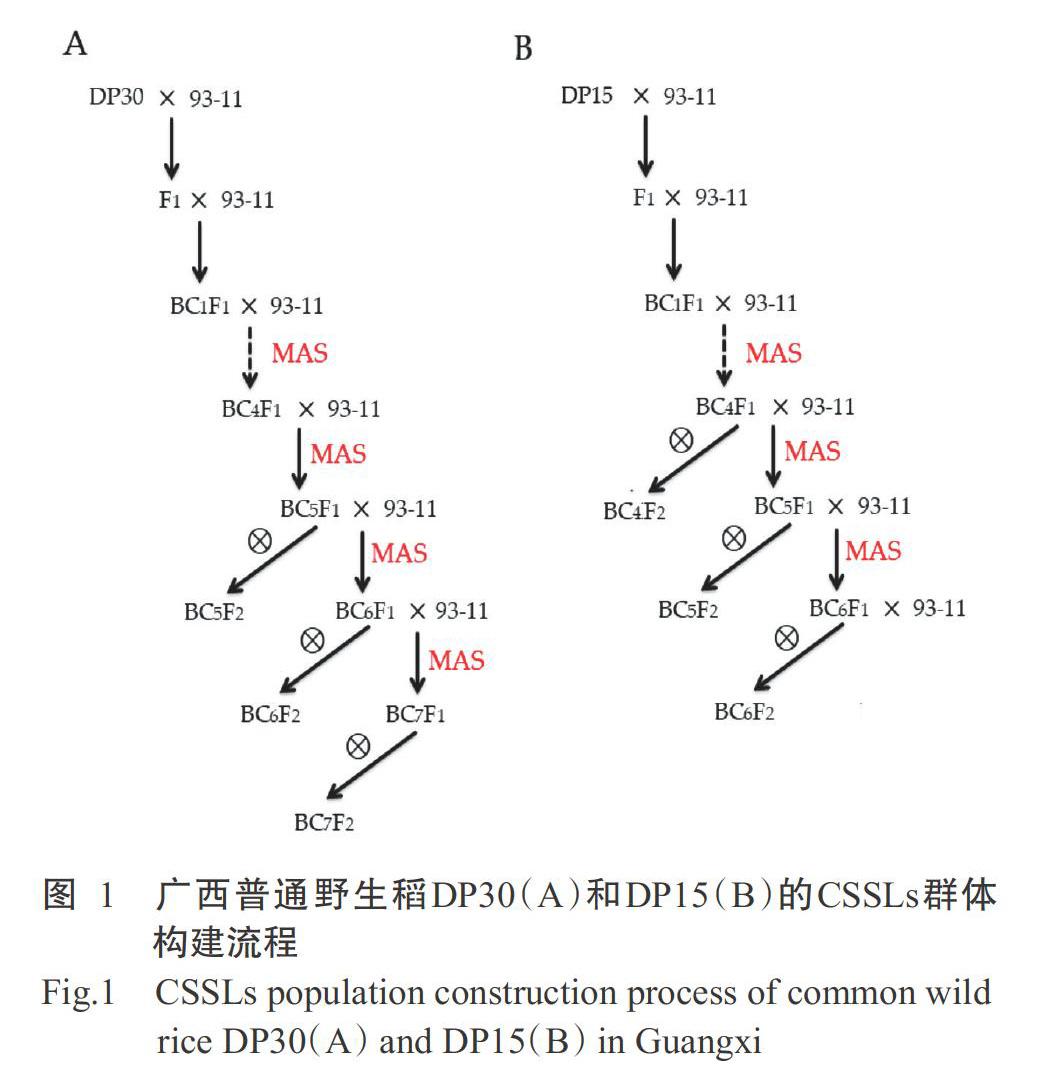
參考T?rjék等(2008)的研究方法,通過雜交、回交和分子標記輔助選擇(MAS)等方法構建廣西普通野生稻DP30和DP15的CSSLs群體(DP30-CSSLs和DP15-CSSLs)。93-11與DP30和DP15分別雜交獲得F1。93-11作輪回親本,與雜交后代連續回交,從BC1F1開始每個世代均通過MAS跟蹤目標DNA片段,選擇含有目標DNA片段植株再繼續回交;直至獲得高世代回交群體BC4F2、BC5F2、BC6F2和BC7F2,從BC4F1開始通過MAS檢測目標片段植株的遺傳背景,篩選出攜帶少數幾個或1個供體親本片段的CSSLs(圖1)。由此構建獲得DP30-CSSLs群體和DP15-CSSLs群體。
1. 3 落粒性表型調查
在2018年晚稻(7—11月)栽培條件下,采用隨機區組設計(RCBD)每3 d在廣西大學試驗田(東經108°13′,北緯22°38′)記錄1次表型數據。具體方法:所有表型數據記錄重復3次,取平均值,每次重復選取15株種植材料進行表型調查。參考Zhou等(2012)關于落粒/非落粒的判定方法,即種子完熟后,自然條件下每穗脫落種子數量占每穗種子總數的百分比,80%以上記為落粒,10%以下為不落粒。參考呂樹偉(2018)的方法判斷落粒性強弱,即種子開花至種子完熟間各階段采用永紅牌拉力儀測量拉力值。具體步驟:夾子掛在拉力儀掛鉤上,用夾子固定穎殼中部,在水平方向上對其進行拉拽,使種子與小枝梗分離,記錄測得的最大拉力值,重復3次,記錄平均值。表型值(TV)選取拉力值大幅變化時,即第6 d的拉力值(Zhao et al.,2019)。
1. 4 基因組測序及分子標記開發
采用Illumina HiSeq 2500?提取試劑盒制備DP30和DP15基因組樣品,并委托北京諾禾致源生物信息科技有限公司進行測序。樣品制備和測序均遵循標準的Illumine方案,參考已公布的93-11基因組序列(Kechin et al.,2017)。使用FastQC和Adapt進行測序結果質量檢測(Pared質量評分),參數為-O 5和-m 32(Zhao et al.,2016);以Burrow-Wheeler Aligner(BWA)進行基因組比對分析(McKenna et al.,2010)。通過GATK檢測1~50 bp的插入或缺失情況,并提取測序深度高(DP,≥50倍)的InDel區大片段(≥2 bp)設計InDel分子標記,所得候選分子標記經數據庫(https://www.ncbi.nlm.nih.gov/)搜索,篩選出最終的分子標記(Wu et al.,2017)。
1. 5 基因組DNA提取及PCR
采用CTAB法提取基因組DNA,PCR擴增產物經7%聚丙烯酰胺變性凝膠分離后,用銀染法顯色(Zhou et al.,2012);參照Yoon等(2015)的方法確認PCR擴增產物的電泳條帶和基因分型。
1. 6 QTL定位與數據分析
以Graphical Geno-Types 2(GGT 2.0)繪制CSSLs群體基因型圖譜(van Berloo,2008)。參考Brondani等(2002)的方法分析CSSLs群體中普通野生稻DNA代換片段長度。采用重疊群QTL分析法檢測CSSLs群體的QTL,具體方法:若具有重疊代換片段的幾個CSSLs表型相同,相關QTL可能位于其重疊代換片段上(Furuta et al.,2014)。利用QTL IciMapping 4.1.0的復合區間作圖法(CIM)進行QTL定位,根據排列(組合)進行檢驗,排列=1000,P=0.001,若LOD值≥2.5,則在P≤0.001水平上認定一個可能的QTL。參考Zhao等(2019)的方法判定QTL加性效應(A)和表型貢獻率(AP),具體計算公式如下:
2 結果與分析
2. 1 全基因組測序及CSSLs群體構建情況
利用Illumina高通量測序技術對廣西普通野生稻DP30和DP15進行測序,結果(圖2)表明,DP30和DP15與93-11間的SNPs分別為1900132和1894103 bp。針對DP30-CSSLs群體和DP15-CSSLs群體分別開發285和254對親本間具有多態性的分子標記。相鄰分子標記的平均間距分別為4.92和5.62 cM,經數據庫(https://www.ncbi.nlm.nih.gov/)搜索篩選,最終構建出由144個CSSLs組成的DP30-CSSLs群體和由59個CSSLs組成的DP15-CSSLs群體。DP30-CSSLs群體代換片段累計全長737.5 Mb,對DP30全基因組的覆蓋率約為94.71%;DP15-CSSLs群體代換片段累計全長337.36 Mb,對DP15全基因組的覆蓋率約為73.11%。
2. 2 DP30-CSSLs群體和DP15-CSSLs群體的落粒性鑒定結果
分別調查CSSLs群體和親本的落粒性,從開花當天(第0 d)到種子成熟(第21 d)期間每隔3 d對CSSLs群體和親本的種子拉力值進行測量,結果表明種子拉力值與其落粒性呈負相關(表1)。93-11種子未脫落,不具落粒性,在整個觀察期間的落粒率為0,拉力值維持在155~165 g;而DP30、DP15及12個CSSLs群體(CSSL-Y104、CSSL-Y68、CSSL-Y83、CSSL-Y328、CSSL-Y235、CSSL-Y64、CSSL-Y63-2、CSSL-Y303、CSSL-Y99、CSSL-Y106-3、CSSL-Z37和CSSL-Z38)除空癟粒外,其余種子均已完全脫落,具有落粒性。從第6 d起DP30、DP15及12個CSSLs群體的拉力值開始下降,第9 d的拉力值持續下降,至第12 d各拉力值均降為0 g。其中,CSSL-Y99(圖3)在第0~3 d不落粒,其拉力值維持在200 g左右;從第6 d起開始出現脫落,落粒率約30%,拉力值下降至80 g;至第9 d種子大量脫落,落粒率約75%,拉力值下降至0 g;第9 d除空癟粒外種子幾乎完全脫落,落粒率約94%。可見,相對于其余11個CSSLs群體,CSSL-Y99的落粒率最高,拉力值下降最快。
2. 3 次級F2群體表型鑒定及遺傳分析結果
CSSL-Y99是CSSLs群體中表型最強的CSSLs,為進一步明確其種子落粒性,故選取CSSL-Y99和93-11構建次級F2群體。遺傳分析結果表明,雜交后代F1均具有落粒性,且相關分子標記顯示供試F1的基因型均為雜合型。經自交一代后,共獲得F2群體188株,其中落粒141株、不落粒47株,分離比為3∶1[χ2=1.630<χ2(0.05,1)=3.84],符合一對基因分離規律,說明CSSL-Y99與93-11的落粒性差異是受單個顯性基因控制。
2. 4 落粒性QTL檢測結果
由表2和圖4可知,在2個CSSLs群體中共發現12個落粒性CSSLs,依據重疊群QTL分析檢測出6個不同的落粒性QTLs(qSH2.1、qSH4.1、qSH5.1、qSH9.1、qSH11.1和qSH11.2),分別分布在第2、4、5、9和11染色體上。其中,qSH2.1位于第2染色體的C2-21~ C2-22,3.28 Mb區間,表型貢獻率為-7.8%;qSH4.1位于第4染色體的C4-22~C4-23,2.01 Mb區間,表型貢獻率為-10.9%,通過與前人的相關研究結果比較,發現該區間含有已克隆的SH4基因(Li et al.,2006);qSH5.1位于第5染色體的RM3227~5M13153,4.41 Mb區間,表型貢獻率為-15.6%,通過與前人的相關研究結果比較,發現該區間含有已克隆的SH5基因(Yoon et al.,2015);qSH9.1位于第9染色體的C9-8~C9-9,1.25 Mb區間,貢獻率為-10.9%;qSH11.1和qSH11.2分別位于第11染色體的C11-5~C11-8和C11-16~C11-17,4.5 Mb和0.5 Mb區間,貢獻率分別為-23.4%和-15.6%。其中,qSH11.1的加性效應最強(-37.5),因而用于進行連鎖分析。
2. 5 落粒性QTL qSH11.1連鎖分析結果
CSSL-Y99與93-11的落粒性存在明顯差異,是一個完全落粒性的CSSLs,所攜帶的qSH11.1表型貢獻率(-23.4%)在6個落粒性QTLs中最高。CSSL-Y99的代換片段位于第11染色體的C11-4~C11-11區間,通過與CSSL-Y303、CSSL-Y106-3和CSSL-Y274的代換片段重疊而將qSH11.1縮小至CSSL-Y99、CSSL-Y303和CSSL-Y106-3的重疊片段上,即第11染色體的C11-5~C11-8區間。參考測序結果,本研究在qSH11.1所在區間內開發6對InDel分子標記(M1、M2、M3、M4、M5和M6)(表3),從構建的次級F2群體分析中篩選出4個重組單株(43、167、128和136),基于重組單株的基因型和表型,可將qSH11.1定位于InDel分子標記M5和M6間約1.5 Mb的范圍內(圖5),LOD值為25.0。
3 討論
至今,針對廣西普通野生稻各類性狀的QTL定位已有較多研究報道(桑洪玉,2014;潘英華等,2017;劉劍鑌,2018),但落粒性狀QTL定位相對滯后。本研究從廣西普通野生稻DP30-CSSLs群體和DP15-CSSLs群體中篩選出12個具有落粒性的CSSLs,檢測出6個落粒性QTLs(qSH2.1、qSH4.1、qSH5.1、qSH9.1、qSH11.1和qSH11.2),且均呈負效應,對應的表型貢獻率分別為-7.8%、-10.9%、-15.6%、 -10.9%、-23.4%和-15.6%。其中,qSH11.1的效應最強,qSH4.1與SH4基因(34231186~34233373 bp)在同一染色體區間內(Li et al.,2006),qSH5.1與SH5基因(22353997~22358568 bp)在染色體相同位置(Yoon et al.,2015)。在利用CSSLs構建次級F2群體定位落粒性QTL方面,鄭麗媛(2017)以日本晴為受體親本、優良恢復系R225為供體親本,通過回交并結合MAS,鑒定了一個攜帶主效易落粒基因的水稻CSSL(Z481),并將SH6(t)定位于RM253~ZLY722,其物理距離在69 kb區間內;宗玉龍(2015)從236個植株中篩選出6個交換株,并將qSH4初步定位于RM6441~ RM1113,其物理距離為377 kb。本研究選取落粒性強、表型貢獻率大的CSSL-Y99與93-11進行雜交,構建次級F2群體,從181個植株中篩選出4個交換株,將qSH11.1初步定位在第11染色體M5~M6間約1.5 Mb的區間內。由于該區間內未見已報道的落粒性基因,故推測其是一個新的落粒性基因。
本研究在DP30-CSSLs群體和DP15-CSSLs群體中新發現的QTL,可為后續精準定位新基因打下基礎。除了精細定位外,CSSLs/SSSLs在QTL的聚合上也有廣泛應用。譚全亞(2016)利用66個SSSLs對水稻柱頭外露率QTL進行鑒定和聚合。徐建軍和梁國華(2011)研究證實,通過遺傳背景相同的CSSLs雜交可將不同代換片段上的多個優良基因聚合在一起,而培育出具有更多優良性狀的新品種。本研究結果表明,12個攜帶落粒性QTL的CSSLs群體遺傳背景中輪回親本的回復率較高,且其他性狀與93-11相似。由于93-11作為我國廣泛栽培的優良品種,故這些CSSLs可直接搭配雜交組合。
數量性狀遺傳復雜,通過CSSLs群體進行QTL定位可消除遺傳背景干擾,將復雜性狀分解為單個孟德爾因子進行研究,避免不同QTL間的干擾(Brondani et al.,2002;Zhao et al.,2015),使基于CSSLs群體的QTL定位結果相對于利用F2初級作圖群體的QTL定位結果更可靠(張向陽等,2014;汪欲鵬等,2016)。CSSLs群體是將親本間的差異性狀分離到各CSSLs中,降低各性狀間的相互干擾,使得表型鑒定更直觀。本研究對2個普通野生稻CSSLs群體進行全基因組深度測序,全面掌握其代換片段和遺傳背景的信息,為落粒性QTL鑒定和基因克隆、QTL互作分析及雜種優勢機理研究等提供了重要參考依據。
4 結論
從構建的廣西普通野生稻核心種質資源(DP30和DP15)CSSLs群體中檢測出6個落粒性QTLs,其中主效QTL qSH11.1定位于第11染色體M5~M6間約1.5 Mb的范圍內,是新發現的落粒性QTL。
參考文獻:
江川,朱業寶,張丹,鄭蘋立,王金英. 2018. 稻種資源收集、保存和更新中存在的問題及對策[J]. 江西農業學報,30(9):16-20. [Jiang C,Zhu Y B,Zhang D,Zheng P L,Wang J Y. 2018. Existent problems in collection,preservation and regeneration of rice germplasm resources and their countermeasure[J]. Acta Agriculturae Jiangxi,30(9):16-20.]
劉劍鑌. 2018. 廣西普通野生稻苗期耐冷QTL qCTS12精細定位及其調控模式研究[D]. 南寧:廣西大學. [Liu J B. 2018. The fine mapping and regulation model research of common wild rice in Guangxi QTL qCTS12,a locus positively responses chill in rice seedling stage[D]. Nanning:Guangxi University.]
呂樹偉. 2018. 非洲野生稻落粒基因SH3的克隆及其分子演化[D]. 北京:中國農業大學. [Lü S W. 2018. Cloning and molecular evolution of ObSH3 controlling seed shattering in African wild rice(Oryza barthii A. Chev.)[D]. Beijing:China Agricultural University.]
潘英華,溫國泉,徐志健,梁云濤. 2017. 利用野栽雜交分離群體定位水稻結實率QTLs[J]. 西南農業學報,30(7):1473-1478. [Pan Y H,Wen G Q,Xu Z J,Liang Y T. 2017. Mapping of QTLs for seed setting rate using hybrid popu-lation of Oryza rufipogon Griff. ×cultivated rice[J]. Southwest Journal of Agriculture Sciences,30(7):1473-1478.]
桑洪玉. 2014. 廣西普通野生稻育性恢復基因Rf3、Rf4的恢復效應及Rf3基因的定位[D]. 南寧:廣西大學. [Sang H Y. 2014. Research on effects of restorer genes Rf3 and Rf4 from Guangxi common wild rice(Oryza rufipogon Griff.) and mapping of Rf3[D]. Nanning:Guangxi University.]
譚全亞. 2016. 基于SSSL水稻柱頭外露率QTL的鑒定和聚合效應分析[D]. 廣州:華南農業大學. [Tan Q Y. 2016. Identification and pyramiding of QTL related to stigma exsertion rate based on SSSL in rice[D]. Guangzhou:South China Agricultural University.]
汪欲鵬,段里成,龍啟樟,徐林典,武志峰,萬建林,石慶華,潘曉華,吳自明. 2016. 大穗型水稻穗部性狀的QTL定位[J]. 南方農業學報,47(9):1445-1449. [Wang Y P,Duan L C,Long Q Z,Xu L D,Wu Z F,Wan J L,Shi Q H,Pan X H,Wu Z M. 2016. QTL analysis of panicle traits in large panicle rice[J]. Journal of Southern Agriculture,47(9):1445-1449.]
徐建軍,梁國華. 2011. 水稻染色體片段代換系群體的構建及應用研究進展[J]. 安徽農業科學,39(4):1935-1938. [Xu J J,Liang G H. 2011. Research progress of construction and application of rice(Oryza sativa L.) chromosome segment substitution lines[J]. Journal of Anhui Agricultural Sciences,39(4):1935-1938.]
張向陽,張紅宇,徐培洲,陳曉瓊,田永航,王志,黃廷友,吳先軍. 2014. 重穗型水稻穗部性狀及劍葉寬的QTL定位[J]. 雜交水稻,29(6):56-61. [Zhang X Y,Zhang H Y,Xu P Z,Chen X Q,Tian Y H,Wang Z,Huang T Y,Wu X J. 2014. QTL mapping of flag leaf width and panicle traits of heavy-panicle rice[J]. Hybrid Rice,29(6):56-61.]
鄭麗媛. 2017. 水稻落粒染色體片段代換系Z481的鑒定及SH6(t)定位[D]. 重慶:西南大學. [Zheng L Y. 2017. Identification of rice chromosome segment substitution line Z481 with seed shattering and fine mapping of the SH6(t)[D]. Chongqing:Southwest University.]
宗玉龍. 2015. 水稻易落粒突變體的鑒定與基因定位[D]. 南京:南京農業大學. [Zong Y L. 2015. Evaluation and gene mapping of a grain shatting mtuttant in rice(Oryza sativa L.)[D]. Nanjing:Nanjing Agricultural University.]
Brondani C,Rangel P,Brondani R,Ferreira M. 2002. QTL mapping and introgression of yield-related traits from Oryza glumaepatula to cultivated rice(Oryza sativa) using microsatellite markers[J]. Theoretical and Applied Gene-tics,104(6-7):1192-1203.
Doebley J F,Gaut B S,Smith B D. 2006. The molecular genetics of crop domestication[J]. Cell,127(7):1309-1321.
Furuta T,Uehara K,Angeles-Shim R B,Shim J,Ashikari M,Takashi T. 2014. Development and evaluation of chromosome segment substitution lines(CSSLs) carrying chromosome segments derived from Oryza rufipogon in the genetic background of Oryza sativa L[J]. Breeding Scien-ce,63(5):468-475.
Huang X H,Kurata N,Wei X H,Wang Z X,Wang A H,Zhao Q,Zhao Y,Liu K Y,Lu H Y,Li W J,Guo Y L,Lu Y Q,Zhou C C,Fan D L,Weng Q J,Zhu C R,Huang T,Zhang L,Wang Y C,Feng L,Furuumi H,Kubo T,Miyabayashi T,Yuan X P,Xu Q,Dong G J,Zhan Q L,Li C Y,Fujiyama A,Toyoda A,Lu T T,Feng Q,Qian Q,Li J Y,Han B. 2012. A map of rice genome variation reveals the origin of cultivated rice[J]. Nature,490(7421):497-501.
Kechin A,Boyarskikh U,Kel A,Filipenko M. 2017. CutPri-mers:A new tool for accurate cutting of primers from reads of targeted next generation sequencing[J]. Journal of Computational Biology,24(11):1138-1143.
Li C B,Zhou A L,Sang T. 2006. Rice domestication by reducing shattering[J]. Science,311(5769):1936-1939.
Lin Z W,Griffith M E,Li X R,Zhu Z F,Tan L B,Fu Y C,Zhang W X,Wang X K,Xie D X,Sun C Q. 2007. Origin of seed shattering in rice(Oryza sativa L.)[J]. Planta,226(1):11-20.
McKenna A,Hanna M,Banks E,Sivachenko A,Cibulskis K,Kernytsky A,Garimella K,Altshuler D,Gabriel S,Daly M,DePristo M A. 2010. The genome analysis toolkit:A mapreduce framework for analyzing next-generation DNA sequencing data[J]. Genome Research,20(9):1297-1303.
Stein J C,Yu Y,Copetti D,Zwickl D J,Zhang L,Zhang C J,Chougule K,Gao D Y,Iwata A,Goicoechea J L,Wei S,Wang J,Liao Y,Wang M H,Jacquemin J,Becker C,Kudrna D,Zhang J W,Londono C E M,Song X,Lee S,Sanchez P,Zuccolo A,Ammiraju J S S,Talag J,Dano-witz A,Rivera L F,Gschwend A R,Noutsos C,Wu C C,Kao S M,Zeng J W,Wei F J,Zhao Q,Feng Q,Baidouri M E l,Carpentier M C,Lasserre E,Cooke R,da Rosa Farias D,da Maia L C,Dos Santos R S,Nyberg K G,McNally K L,Mauleon R,Alexandrov N,Schmutz J,Flowers D,Fan C,Weigel D,Jena K K,Wicker T,Chen M S,Han B,Henry R,Hsing Y I C,Kurata N,de Oliveira A C,Panaud O,Jackson S A,Machado C A,Sanderson M J,Long M Y,Ware D,Wing R A. 2018. Genomes of 13 domesticated and wild rice relatives highlight genetic conservation,turnover and innovation across the genus Oryza[J]. Nature Genetics,50(2):285-296.
T?rjék O,Meyer R C,Zehnsdorf M,Teltow M,Strompen G,Witucka-Wall H,Blacha A,Altmann T. 2008. Construction and analysis of 2 reciprocal arabidopsis introgression line populations[J]. The Journal of Heredity,99(4):396-406.
van Berloo R. 2008. GGT 2.0:Versatile software for visualization and analysis of genetic data[J]. The Journal of Heredity,99(2):232-236.
Wu W G,Liu X Y,Wang M H,Meyer R S,Luo X J,Ndjion-djop M N,Tan L B,Zhang J W,Wu J Z,Cai H W,Sun C Q,Wang X K,Wing R A,Zhu Z F. 2017. A single-nucleo-tide polymorphism causes smaller grain size and loss of seed shattering during African rice domestication[J]. Nature Plants,3:17064. doi:/10.1038/nplants.2017.64.
Wu X R,Tang D,Li M,Wang K J,Cheng Z K. 2013. Loose plant architecture1,an indeterminate domain protein involved in shoot gravitropism,regulates plant architecture in rice[J]. Plant Physiology,161(1):317-329.
Wu Y B,Li G,Zhu Y J,Cheng Y C,Yang J Y,Chen H Z,Song X J,Ying J Z. 2020. Genome-wide identification of QTLs for grain protein content based on genotyping-by-resequencing and verification of qGPC1-1 in rice[J]. International Journal of Molecular Sciences,21(2):408. doi:10.3390/ijms21020408.
Xiong L Z,Liu K D,Dai X K,Xu C G,Zhang Q F. 1999. Identification of genetic factors controlling domestication-related traits of rice using an F2 population of a cross between Oryza sativa and O. rufipogon[J]. Theoretical and Applied Genetics,98(2):243-251.
Yan H X,Ma L,Wang Z,Lin Z M,Su J,Lu B R. 2015. Multiple tissue-specific expression of rice seed-shattering gene SH4 regulated by its promoter pSH4[J]. Rice,8:12. doi:10.1186/s12284-015-0047-4.
Yoon J M,Cho L H,Kim S L,Choi H,Koh H J,An G. 2015. The BEL1-type homeobox gene SH5 induces seed shatte-ring by enhancing abscission-zone development and inhi-biting lignin biosynthesis[J]. The Plant Journal,79(5):717-728.
Yu B S,Lin Z W,Li H X,Li X J,Li J Y,Wang Y H,Zhang X,Zhu Z F,Zhai W X,Wang X K,Xie D X,Sun C Q. 2008. TAC1,a major quantitative trait locus controlling tiller angle in rice[J]. The Plant Journal,52(5):891-898.
Zhang L B,Zhu Q H,Wu Z Q,Ross I J,Gaut B S,Ge S,Sang T.2009. Selection on grain shattering genes and rates of rice domestication[J]. The New Phytologist,184(3):708-720.
Zhao L,Tan L B,Zhu Z F,Xiao L T,Xie D X,Sun C Q. 2015. PAY1 improves plant architecture and enhances grain yield in rice[J]. The Plant Journal,83(3):528-536.
Zhao H W,Sun L L,Xiong T Y,Wang Z Q,Liao Y,Zou T,Zheng M M,Zhang Z,Pan X P,He N,Zhang G Q,Zhu H T,Liu Z Q,He P,Fu X L. 2019. Genetic characterization of the chromosome single-segment substitution lines of O. glumaepatula and O. barthii and identification of QTLs for yield-related traits[J]. Molecular Breeding,39:51. doi:10.1007/s11032-019-0960-0.
Zhao S S,Wang C H,Ma J,Wang S,Tian P,Wang J L,Cheng Z J,Zhang X,Guo X P,Lei C L. 2016. Map-based cloning and functional analysis of the chromosome gene C in rice(Oryza sativa L.)[J]. Journal of Plant Bio-logy,59(5):496-505.
Zhou Y,Lu D F,Li C Y,Luo J H,Zhu B F,Zhu J J,Shangguan Y Y,Wang Z X,Sang T,Zhou B,Han B. 2012. Genetic control of seed shattering in rice by the APETALA2 transcription factor shattering abortion 1[J]. The Plant Cell,24(3):1034-1048.
(責任編輯 蘭宗寶)

