MCP-1/CCR2信號途徑介導酒精誘導的乳腺癌血管新生*
季 丹,何曉剛,汪 剛,羅 濤,張 露,徐曉丹,徐曉軍,3,李菲菲△
(1安徽醫科大學基礎醫學院,安徽合肥230032;2安徽醫學高等專科學校,安徽合肥230061;3安徽醫科大學第一附屬醫院乳腺外科,安徽合肥230022)
近年來,許多惡性疾病被認為是免疫異常的結果,其中細胞因子和趨化因子作為重要的炎癥介質,參與了腫瘤的發生與惡性轉化,涉及腫瘤細胞生物學的許多方面,包括監管腫瘤細胞的生長、血管生成、腫瘤轉移以及宿主的免疫反應[1-2]。單核細胞趨化蛋白 1(monocyte chemoattractant protein-1,MCP-1)也被稱為CC趨化因子配體2(CC chemokine ligand 2,CCL2),其受體為CC趨化因子受體2(CC chemokine receptor 2,CCR2)。研究表明,MCP-1/CCR2信號途徑在炎癥反應中發揮招募和激活單核細胞、調節免疫反應的重要作用[3]。新近文獻報道,MCP-1的分泌及其受體CCR2的表達與酒精導致的細胞毒性、免疫損傷及腫瘤侵襲性生長相關[4]。乳腺癌作為女性發病率和致死率最高的惡性疾病,其發生發展機制復雜。流行病學調查表明,飲酒會以劑量依賴的方式增加患乳腺癌的風險[5-6],但酒精促進乳腺癌發生發展的分子機制是否與MCP-1相關還有待進一步闡明。本研究旨在觀察酒精促進乳腺癌生長轉移與趨化因子MCP-1/CCR2介導的腫瘤血管新生的關系。
材料和方法
1 主要材料和試劑
小鼠乳腺癌E0771細胞和人乳腺癌MDAMB231細胞由Dr.Enrico Mihich(Roswell Park Cancer Institute,Buffalo,NY)提供。DMEM培養基、纖維蛋白原、蛋白酶抑制劑、凝血酶和酒精購自Sigma;抗MCP-1抗體和抗CCR2抗體購自BD Biosciences;Cytodex 3微珠購自Amersham Pharmacia Biotech;其它試劑材料為本實驗室常規保存。
2 實驗方法
2.1 細胞培養 E0771細胞用含有10%胎牛血清、1×105U/L青霉素、100 mg/L鏈霉素和0.25 mg/L兩性霉素B的DMEM培養基于37℃、5%CO2的細胞培養箱中培養。MDA-MB231細胞和小鼠血管內皮細胞SVEC4-10EE2(SVEC)用含10%胎牛血清、1×105U/L青霉素和100 mg/L鏈霉素的DMEM培養基于37℃、5%CO2的細胞培養箱中培養。MDA-MB231細胞是具有侵襲性的乳腺癌細胞并且對酒精暴露敏感。用1 g/LⅠ型膠原酶使人臍靜脈內皮細胞(human umbilical vein endothelical cells,HUVEC)脫離新鮮的人類胎盤,并于EGM-2培養基中培養。
2.2 小鼠乳腺腫瘤移植瘤模型的建立 健康C57BL/6小鼠購自江蘇集萃藥康生物有限公司,許可證號為SCXK(蘇)2018-0008。將C57BL/6小鼠隨機分成2組,每組8只:(1)正常對照(control)組;(2)2%酒精(EtOH)組。其中,control組給予常規滅菌飲用水;EtOH組晚上8點到次日早上8點給予含2%酒精的飲用水,再換回常規滅菌飲用水,到晚上8點再換成2%酒精,依次循環。飲酒后1周進行腫瘤細胞接種:取對數生長期的E0771細胞,胰酶消化,離心后用PBS或無胎牛血清的DMEM重懸,將細胞混勻,用1 mL無菌注射器抽取0.3 mL的細胞懸液,將細胞皮下接種到C57BL/6小鼠下腹部第2乳腺處,每只小鼠接種0.1 mL的細胞懸液,即每只小鼠接種3.5×105個E0771細胞。細胞接種后,每2~3 d觀察腫瘤生長情況,并稱重小鼠體重,于第21天處死小鼠,取瘤組織、稱重固定,-80℃保存。
2.3 免疫組化和微血管密度檢測 從上述移植瘤標本取癌組織和癌旁組織,按常規程序脫水、固定、切片制成組織切片。分別加Ⅰ抗[抗MCP-1、CCR2、血小板內皮細胞黏附分子1(platelet endothelial cell adhesion molecule-1,PECAM-1)和血管內皮生長因子(vascular endothelial growth factor,VEGF)抗體]孵育后PBS清洗4次,Ⅱ抗孵育25 min后PBS清洗4次,然后顯色、封片、拍照。以每張切片超過10%腫瘤細胞漿或細胞膜呈棕黃色者,作為MCP-1和CCR2蛋白的陽性表達。微血管密度(microvessel density,MVD)的測定:以PECAM-1(CD31)單抗染成鮮紅色的單個內皮或內皮細胞群作為一個微血管,在40倍鏡下選取5個血管豐富的視野,于100倍鏡下用北航CMIAS圖像分析系統對染色陽性血管進行密度定標。由計算機自動求和并取平均值。
2.4 3D腫瘤細胞-內皮細胞共培養系統 HUVEC或SVEC被胰蛋白酶消化后(1×106)與Cytodex微珠(3×103)在4 mL培養基(HUVEC用EGM-2培養基,SVEC用DMEM培養基)中混合,加入50 mL離心管中。混合物在5%CO2、37℃環境下孵育4 h,每隔20 min混勻一次。在孵育的第4 h,加入4 mL的培養基后繼續孵育4 h。然后將包被有內皮細胞的微載體混合液轉移到25 mL的組織培養瓶中繼續培養過夜,使細胞不附著到微珠但附著在瓶體。第2天,將培養瓶輕輕沖洗后將混合液轉移到50 mL離心管中,用不含Ca2+和Mg2+的PBS輕洗3遍,重懸于含有2.5 g/L纖維蛋白原和1.5×102U/L蛋白酶抑制劑的DMEM培養基中。在24孔板中加入0.625 U的凝血酶包被,再加入0.5 mL的微載體和纖維蛋白原溶液的混合液,室溫靜置凝結5 min,然后37℃、5%CO2孵育20 min。形成的纖維蛋白凝膠中內皮細胞粘附在微珠上。每孔加入1 mL含1.5×102U/L蛋白酶抑制劑的培養基,使其與纖維蛋白凝塊平衡在37℃培養箱中孵育30 min。將24孔板內培養基吸掉,加入1 mL含1.5×102U/L蛋白酶抑制劑的新鮮培養基,于37℃恒溫、5%CO2孵箱中培養,5~96 h后4%多聚甲醛固定,鄰苯二甲酸二烯丙酯(diallyl phthalate,DAP)染色,觀察倒置顯微鏡下“出芽”(sprouts)的情況;對照組為不含腫瘤細胞的空白培養基模型。結果判斷:在規定觀察時點,每個培養孔在倒置顯微鏡下,隨機取3個視野,觀察“出芽”情況,計算出芽的微珠占總數的百分比(percentage of beads with sprouts)。
2.5 乳腺癌細胞酒精暴露實驗 在培養基中添加酒精(95%酒精),稀釋至所需水平的酒精濃度(0.2%)。培養的細胞被放置在一個有密封蓋子的塑料容器中。在每個容器底部都有200 mL的水浴,水浴中酒精的濃度與培養基中相同。密封每個容器之前,注入60 mL CO2。將容器置于加濕的環境中,并維持在37℃、5%CO2環境中。用這種方法,培養基中的酒精濃度可以準確地維持。
2.6 細胞遷移實驗 將Transwell小室插入培養板中,由一個孔徑為8 μm的膜分成一個上室和一個下室。上室接種SVEC(3×104)并用含2%胎牛血清的DMEM維持。下室充滿了含2%胎牛血清和不同濃度MCP-1(0.5和10 μg/L)的培養基。將小室放于37℃、5%CO2環境下孵育12 h。用甲醇固定膜,殘留在上室的細胞被除去。遷移的細胞吉姆薩染色并計數,每個孔選擇5個隨機的鏡下視野進行計數,每個孔得到3個視野的平均數。
3 統計學處理
各組數據均以均數±標準差(mean±SD)表示,兩組間均數比較用t檢驗,多組間均數比較用單因素方差分析,以P<0.05為差異有統計學意義。所有的統計分析使用SPSS 10.0軟件進行。
結 果
1 MCP-1和CCR2在飲酒的乳腺癌移植腫瘤小鼠的癌組織中高表達且與血管新生指標相關
小鼠乳腺癌組織免疫組化染色結果顯示,MCP-1和CCR2在腫瘤組織中均呈陽性表達,在飲酒小鼠組織中強陽性表達,見圖1A,且與微血管標志物PECAM-1和VEGF表達水平正相關,見圖1B。微血管計數顯示,飲酒組小鼠腫瘤組織中微血管密度顯著高于非飲酒的對照組腫瘤組織(P<0.05),見圖1C。
2 成功建立乳腺癌細胞和內皮細胞共培養3D血管生成模型
在乳腺癌細胞和內皮細胞共培養系統中內皮細胞附著在Cytodex微珠表面生長,形成一個3D毛細管狀網絡結構,表明血管生成。如圖2A所示,SVEC附著Cytodex微珠從微珠發芽形成短而狹窄的條索狀結構。在這個系統中加入乳腺癌細胞(2×104或4×104E0771細胞)共培養可以明顯增加了SVEC“出芽”的數量和長度:SVEC單獨培養的“出芽”率為57.2%,SVEC和E0771共培養的“出芽”率顯著提高(P<0.05);然而,高密度的E0771細胞(4×104)并沒有進一步增加出芽,表明適宜的腫瘤細胞數更能促進血管新生,見圖2B。
3 MCP-1可以通過其受體CCR2促進腫瘤血管生成
為了研究MCP-1是否直接參與腫瘤血管生長,我們利用三維血管生成的體外模型,共培養血管內皮細胞和腫瘤細胞(乳腺癌細胞E0771或MDAMB231),觀察在MCP-1直接誘導下,微載體表面的血管生成情況。結果顯示:E0771或MDA-MB231細胞與內皮細胞共培養時,都可見明顯的內皮細胞出芽式血管生成(E0771組68%,MDA-MB231組70%);然后,在內皮細胞的三維培養體系里加入在MCP-1誘導以代替腫瘤細胞的共培養,同樣觀察到了微載體表面有大量微血管形成(兩組分別為65.3%與69.7%),與誘導前的對照組相比顯著增多(P<0.01);而使用MCP-1受體CCR2的抑制劑(CCR2 antagonist,CCR2 AT)處理后,血管生成分別降至52.7%和51.9%,與MCP-1誘導組相比顯著減少(P<0.05),見圖3。由此可見,MCP-1不僅直接誘導內皮細胞形成微血管的能力,并且是為血管形成所必需的因子之一。
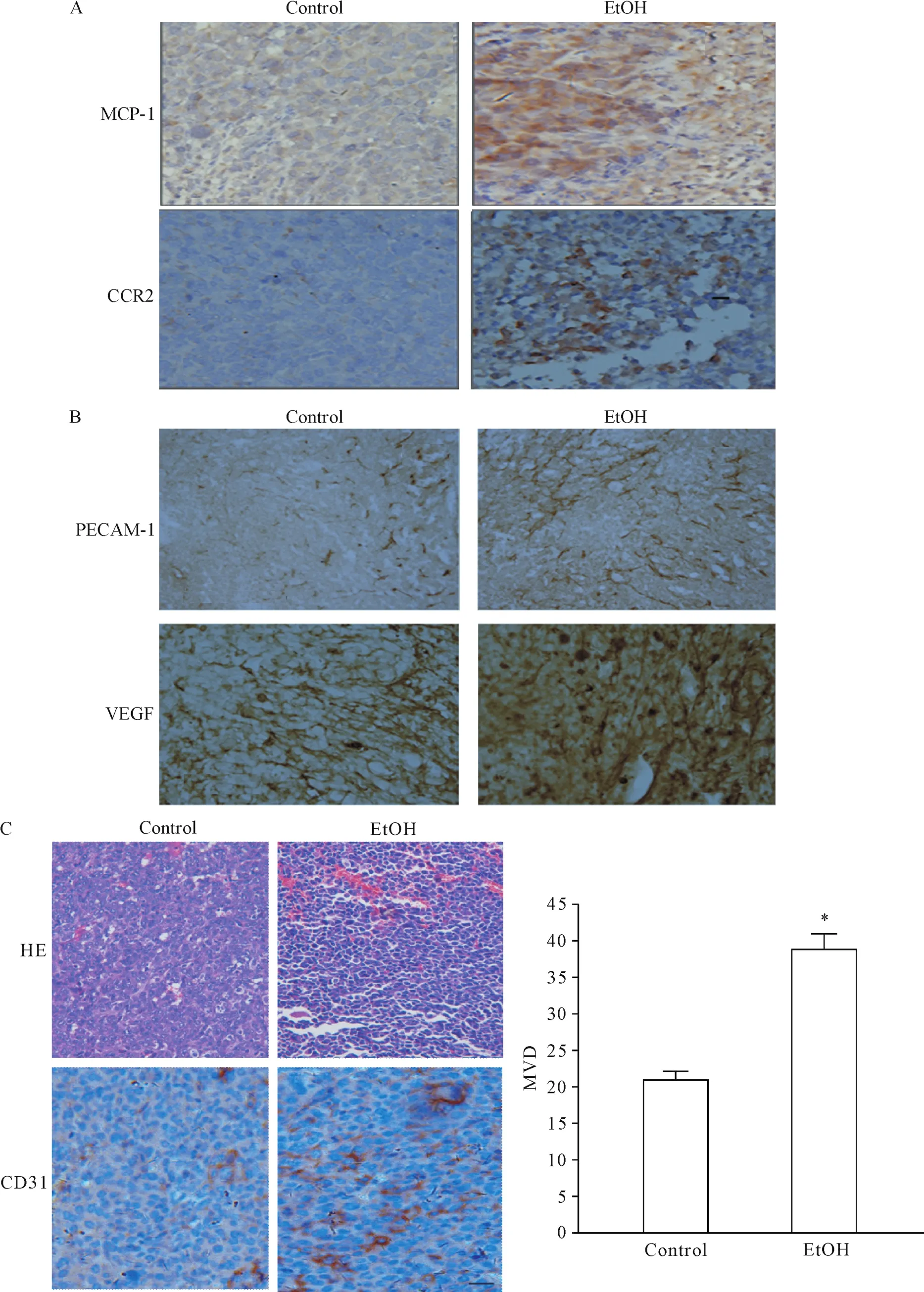
Figure 1.Analysis of MCP-1,CCR2 and angiogenesis of the breast cancer tissues in mice between ethanol consumption group(EtOH)and control group(Con).A:immunohistochemical staining of MCP-1 and CCR2 in breast tumor tissues(×100);B:immunohistochemical staining of PECAM(CD31)and VEGF in breast tumor tissue(×100)C:effect of ethanol on microvessel density(MVD)of E0771 transplanted tumor tissues.Mean±SD.n=8.*P<0.05 vs control group.圖1 MCP-1和CCR2的組織表達與微血管分布的相關性
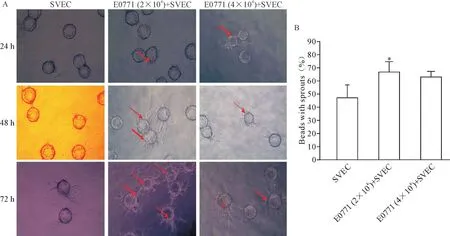
Figure 2.Sprouts and new micro-vessels formation in three-dimensionalin culture models of SVEC and Cytodex in fibrin medium.A:sprouts were observed on the beats surface as shown in red arrows per 24 h;B:sprouts were counted at 72 h after co-cultured in 3D medium.Mean±SD.n=6.*P<0.05 vs SVEC group.圖2 臍靜脈內皮細胞SVEC、Cytodex微載體及E0771細胞在Fibrin膠中3D共培養時新生血管生成的情況
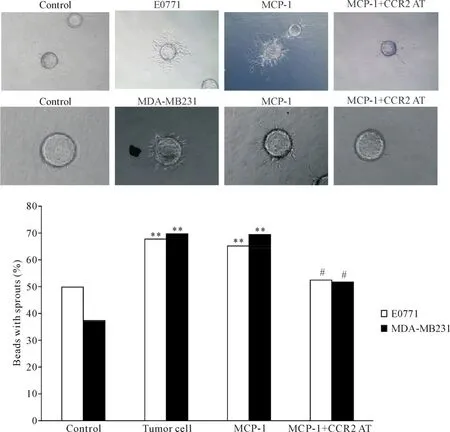
Figure 3.MCP-1 can increase angiogenesis in vitro.E0771 or MB231 were co-cultured with SVEC pre-beaded with cytodex in 3D angiogenesis system.Then cells were treated with MCP-1 or MCP-1 antagonist.After 96 h,besds with sprouts were counted under microscope.Mean±SD.n=6.*P<0.05,**P<0.01 vs control group;#P<0.05 vs tumor cell group and MCP-1 group.圖3 MCP-1在體外誘導腫瘤血管生成
4 CCR2抑制劑可以特異性阻斷酒精誘導的腫瘤血管生成
我們在腫瘤細胞與內皮細胞三維共培養體系中加入MCP-1受體拮抗劑,觀察對血管生成的影響。結果顯示:內皮細胞SVEC4-10-EE2單獨培養時,無論加入酒精與否,都未見有明顯的“出芽”。在與E0771共培養后,微載體表面形成較多的微血管樣結構,加入0.2%的酒精刺激后,微血管結構進一步增多(P<0.05)。在使用CCR2AT后,無論有無酒精刺激,血管生成均明顯受到抑制(P<0.01),見圖4。由此可見,當CCR2生物學效應被阻斷時,酒精加速的血管生成的誘導腫瘤效應明顯減弱,酒精相關乳腺腫瘤血管生成與MCP-1/CCR2信號密切相關。
5 MCP-1/CCR2過增加內皮細胞遷移促進血管新生
血管生成是由內皮細胞的活化調節的,包括內皮細胞的增殖增加或遷移兩種主要形式。為了進一步了解MCP-1/CCR2途徑究竟通過何種機制來促進血管新生,我們觀察檢測了MCP-1/CCR2對內皮細胞增殖和遷移的影響。結果顯示,MCP-1并不能引起人臍靜脈內皮細胞的增殖;但是通過遷移實驗發現,5 ng和10 ng計量的MCP-1均可以顯著刺激內皮細胞的遷移,而這種遷移被CCR2拮抗劑阻斷(P<0.01),見圖5B。以上結果說明MCP-1/CCR2信號途徑是通過增加血管內皮細胞遷移來促進血管新生的。
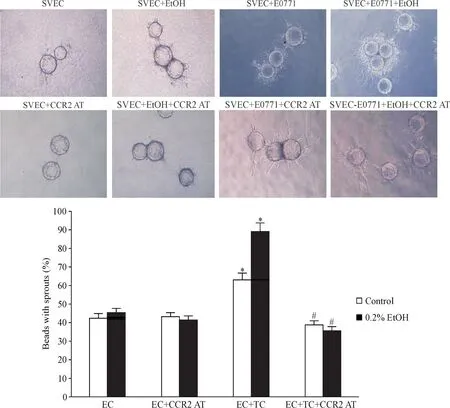
Figure 4.CCR2 antagonist inhibited tumor angiogenesis with or without Ethanol in vitro.A:morphologic change of tumor angiogenesis after treatment of CCR2 antagonist with or without ethanol in vitro;B:statistics of beads with sprouts in different groups.Mean±SD.n=6.*P<0.05 vs control,**P<0.01 vs control and 0.2%EtOH groups.TC:tumor cell;EC:endothelial cell.圖4 CCR2阻斷劑CCR2AT可以抑制體外腫瘤血管新生
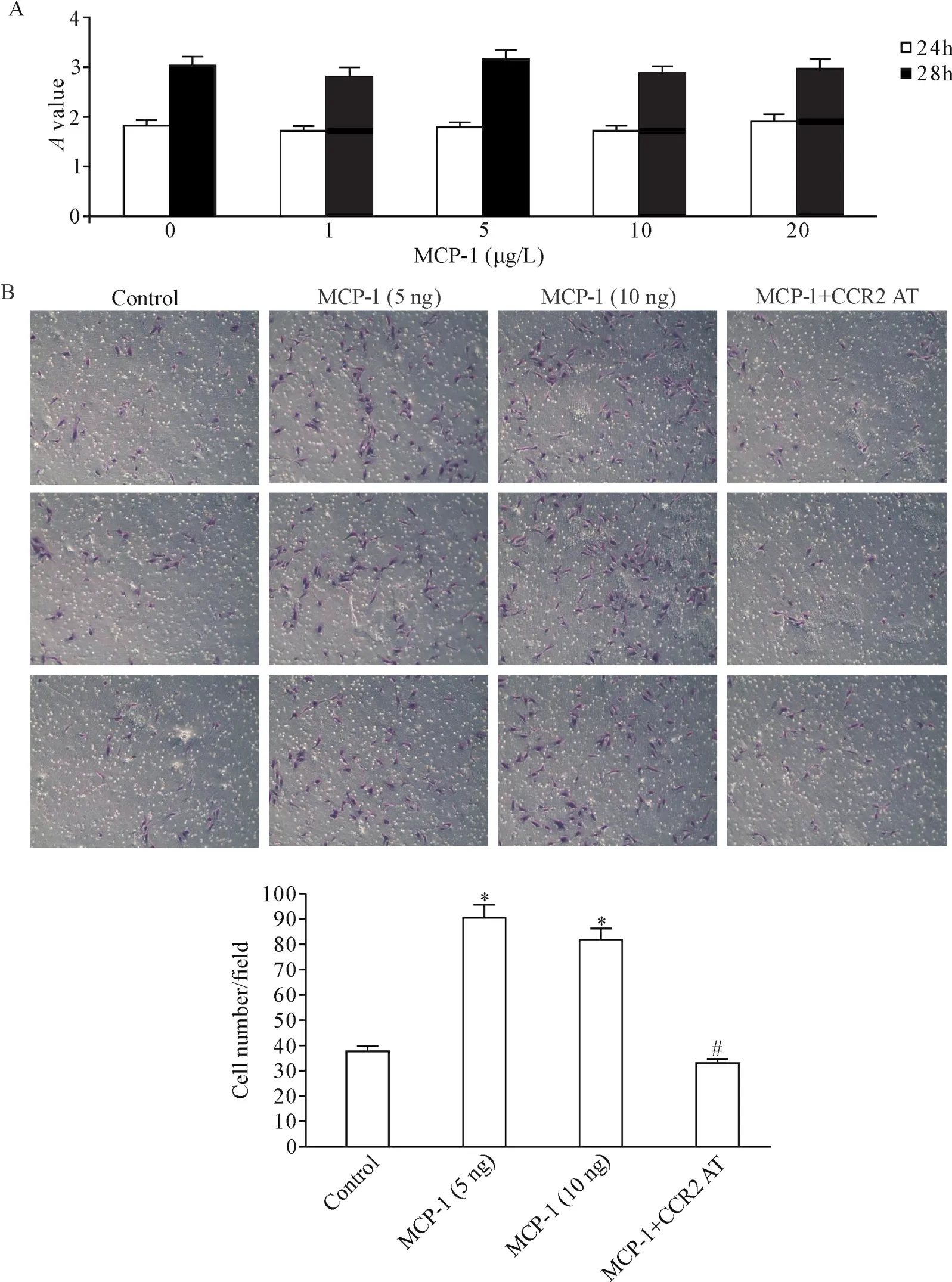
Figure 5.The effects of MCP-1/CCR2 on HUVEC proliferation and migration.A:MCP-/CCR2 didn’t affect HUVEC proliferation;B:MCP-1 promted HUVEC migration.Mean±SD.n=6.*P<0.05 vs control group;**P<0.05 vs MCP-1 group.圖5 MCP-1/CCR2途徑對內皮細胞增殖和遷移直接影響
討 論
在腫瘤新生血管的來源中,其中一個重要理論就是認為腫瘤細胞自身分泌的多種細胞因子可以活化內皮細胞,從而刺激其增殖或遷移,形成新的脈管結構[7]。在本研究中我們通過使用3D腫瘤-內皮細胞共培養模型,來評估酒精是否能刺激腫瘤細胞,引起腫瘤細胞和內皮細胞的相互作用,促進血管新生。實驗結果表明,在這個3D系統中加入乳腺癌細胞共培養一段時間,明顯刺激了血管生成,在此基礎上我們進一步研究證明了酒精的刺激可以增強此種血管新生作用,其作用機制是與MCP-1相關,當使用MCP-1抑制劑或者其受體CCR2抑制劑,血管新生效應大大受到抑制。
MCP-1是炎癥領域單核細胞和巨噬細胞的一個強有力的趨化因子,并且參與感染性疾病、腫瘤發生發展[8-9]。MCP-1在正常乳腺上皮導管細胞中極少表達,但在乳腺癌細胞中廣泛表達[10]。已經有大量研究表明MCP-1是乳腺癌發生發展的重要促進因子。它介導的親腫瘤活性可能與以下因素有關:(1)刺激有害的腫瘤相關巨噬細胞(tumor-associated macrophages,TAM)的增加,從而抗腫瘤T細胞活性的抑制;(2)增加腫瘤細胞和腫瘤微環境的細胞之間的相互適應,起到促腫瘤生長轉移作用;(3)對乳腺癌細胞的遷移和侵襲特性直接增加[11-13]。
此外,近年來還發現MCP-1也是一種促血管生成因子,它可以通過增加TAM的活性,通過TAM促進血管生成因子VEGF等分泌,從而促進血管新生[14]。乳腺腫瘤在發生發展中血管新生密度顯著增加,在飲酒患者中尤為顯著,那MCP-1是否能通過酒精作用,進一步促進腫瘤血管生成和腫瘤生長的呢?本研究結果證實,外源的MCP-1可以直接促進腫瘤血管新生作用,這種作用可能是通過腫瘤細胞分泌MCP-1,介導血管內皮細胞遷移來實現的。使用MCP-1受體拮抗劑CCR2 AT能有效抑制了酒精處理過的乳腺癌細胞促血管生成作用;在沒有MCP-1刺激時,同培養體系也能出現大量新生血管,但是如果用CCR2抑制劑則可以大大阻斷這一效應,提示乳腺癌細胞可能以旁分泌的方式產生MCP-1,通其受體CCR2介導酒精暴露刺激下的腫瘤血管新生。
酒精介導的血管生成和促腫瘤機制非常復雜,可能涉及多種參與者和調節者。除了其他潛在途徑,本研究闡明了MCP-1在酒精誘導血管生長和腫瘤生長中的作用及其調節腫瘤生長轉移的可能機制。

