多表位丙型肝炎病毒抗原的表達和分析
蘇秋東 郭敏卓 伊 瑤 畢勝利 賈志遠 邱 豐
丙型肝炎病毒(hepatitis C virus, HCV)屬于黃病毒科肝炎病毒屬,是一種由脂膜包裹的正鏈RNA病毒。其基因組RNA長約9600nt,包含一個多蛋白開放閱讀框,編碼約3000個氨基酸的多聚蛋白,結構蛋白主要有C、E1和E2,非結構蛋白主要有NS2、NS3、NS4A、NS4B、NS5A和NS5B。HCV是慢性肝炎的主要致病因子,預估全球有7110萬慢性丙肝患者,約10%~20%慢性肝炎患者在20~30年里將會發展為肝纖維化和肝硬化甚至肝癌[1]。2015年全球HCV感染診斷率僅為20%,其中只有15%確診丙肝患者得到了有效治療,HCV的診斷治療問題亟待解決[2]。在目前直接抗病毒(direct-acting antivirals, DAAs)療法對HCV有效的情況下,提高診斷及治療率對于實現世界衛生組織2030年消除病毒性肝炎的目標至關重要。
HCV實驗室診斷主要包括核酸和血清學診斷。需要提取病毒核酸、受型別特異性限制、成本高以及需要專業操作是核酸檢測的弊端。而血清學檢測簡單易行,成本低廉,所以一直是HCV臨床診斷的主要輔助手段。HCV病毒蛋白 C、NS3、NS4和NS5區擁有保守的免疫顯性區域[3]。因此HCV抗體檢測用診斷抗原主要圍繞這4個區設計。第1代HCV抗體檢測使用NS4的一段抗原,第2代為包含C、NS3和NS4免疫顯性區的重組抗原,目前使用的第3代檢測試劑加入NS5區抗原且優化了NS3區抗原[4]。迄今已經發現HCV存在8個基因型和86個基因亞型[5,6]。因此目前常用的抗體檢測試劑都使用3~6種重組抗原或合成肽,大大增加了檢測成本和非特異性反應。多表位HCV診斷抗原的設計為解決這些問題提供了一條很好的途徑。最早的多表位抗原出現在2006年,隨后不同的設計層出不窮[7]。我國HCV主要流行亞型為1b和2a[8]。此研究將這兩種主要流行亞型的6個主要免疫區域進行串聯,制備新型HCV抗體診斷抗原,并利用陰陽性血清評價其診斷效能。
材料與方法
1.主要材料與試劑:BL21(DE3)感受態細胞購自北京全式金生物技術有限公司。M48載體,為本科室構建,由pET43.1a載體,在Nde Ⅰ和Nco Ⅰ酶切位點之間插入Trx標簽改造所得。限制性內切酶NcoⅠ和XhoⅠ以及T4 DNA連接酶購自美國NEB公司。預螯合Ni2+親和層析介質為美國GE公司產品。山羊抗人IgG H&L(HRP)酶標物為英國Abcam公司產品。50份HCV陽性血清參照WS213-2018丙型肝炎診斷標準:①生化指標異常;②血液抗-HCV陽性;③血液HCV RNA陽性,核酸定量范圍為4.97(4.52,6.34)[Log轉換,中位數(Q1,Q3)];④來源于科室現存血清庫。50份HCV陰性血清:①血液抗-HCV陰性;②血液HCV RNA陰性;③來源于科室現存血清庫。HAV、HBV、HDV及HEV陽性血清各20份,由實驗室和臨床確診,來源于科室現存血清庫。
2.HCV多表位診斷抗原表達質粒的制備:根據參考文獻[4,9~13]與相關經驗,將HCV NS3(1b)aa 1201-1464、Core(1b)aa 1-34、NS4A(1b)aa 1681-1735、NS4A(2a)aa 1681-1735、NS4B(2a) aa 1929-1935及NS5A(2a)aa 2273-2307等6個抗原區域用(GGGS)3進行串聯,5′端添加CCATGG(Nco Ⅰ)酶切位點,3′端添加CTCGAG(Xho Ⅰ)酶切位點,密碼子優化后交由日本TaKaRa公司進行基因合成,命名為H65F。利用Nco Ⅰ和Xho Ⅰ限制性內切酶及T4 DNA連接酶將H65F亞克隆到M48表達載體上,轉化BL21(DE3)感受態細胞。16h后挑取6個單菌落(1~6號)接種于2ml培養基中(10g/L蛋白胨,5g/L酵母提取液,10g/L NaCl,50μg/ml氨芐霉素)振蕩培養,誘導進行小量表達,提取質粒進行測序并雙酶切鑒定,驗證正確的質粒命名為H65。
3.HCV多表位診斷抗原的制備:選擇4號作為菌株進行大量表達(3L),誘導條件為30℃,1mmol/L IPTG,5h。離心(3500r/min, 10min, 4℃)收集沉淀,用溶解緩沖液(20mmol/L 磷酸鹽緩沖液,20mmol/L咪唑,0.5mol/L NaCl,pH 7.0)重懸后用超聲儀破碎(功率300W,超聲時間20s,間歇時間20s,共20個循環),離心(11000r/min, 10min, 4℃)收集上清。將上清加載于預螯合Ni2+親和層析介質中。分別用0、0.1、0.5mol/L咪唑(溶于溶解緩沖液中)進行梯度洗脫。取樣進行SDS-PAGE(恒流35mA,45min)電泳,分析H65蛋白的含量以及分布情況。將H65蛋白蛋白含量最高、純度最好的洗脫液于PBS (137mmol/L NaCl,2.7mmol/L KCl,10mmol/L Na2HPO4,2mmol/L KH2PO4, pH 7.4)中透析,并于0℃保存備用。
4.HCV多表位診斷抗原抗原性初步分析:H65蛋白抗原性的初步分析利用Western blot法檢測。取10μl透析后H65蛋白進行SDS-PAGE電泳(恒流35mA,45min),半干轉膜法(恒壓15V,35min)至PVDF膜上。室溫,封閉液(1% BSA,0.05% 吐溫-20,溶于PBS中)振蕩孵育PVDF膜1h。室溫,1∶10稀釋HCV陰陽性血清后分別處理兩塊PVDF膜1h,而后用PBS洗膜10min。用山羊抗人IgG H&L(HRP)酶標物(1∶5000)室溫處理PVDF膜1h后用高鹽緩沖液(0.5mol NaCl,0.2% SDS,溶于PBS中)洗膜30min后超純水洗膜,用DAB顯色,清水終止顯色。
5.HCV多表位診斷抗原診斷效能評價:利用蛋白H65建立血清HCV-IgG抗體檢測間接法ELISA試劑盒,對“金標準”確診的陰陽性血清樣本以及其他肝炎病毒陽性標本進行檢測,評價其對陰陽性血清標本的鑒別能力,并與某商品化試劑盒進行比較,評價其優劣。包被緩沖液(50mmol/L碳酸鹽緩沖液,pH 9.6)1∶300稀釋蛋白H65后加入ELISA板中,37℃孵育2h。37℃,封閉液孵育1h后用PBST洗滌。每孔加PBS和待測血清各50μl,37℃孵育1h后洗滌;加入山羊抗人IgG H&L(HRP)酶標物(1∶6000),37℃孵育1h后洗滌;加新鮮配制TMB液顯色,2mol/L H2SO4終止反應。用酶標儀測定450nm處各孔吸收度值(A值)。
利用某商品化HCV-IgG ELISA檢測試劑盒檢測待測同批血清,具體操作遵循廠家說明書,最后用酶標儀測定450nm處吸收度值(A值)。
6.統計學方法:實驗數據采用SPSS 22.0統計學軟件進行統計分析,用GraphPad Prism 8.00軟件繪制6組血清A值散點圖。對HCV陰陽性兩組血清A值分布進行Wilcox檢驗(獨立樣本Mann-WhitneyU檢驗),原假設為在兩組類別上,A值分布相同。根據經驗選取陰性血清A值均值2.1倍作為臨界值。用McNemer檢驗及Kappa一致性檢驗評價兩種檢測方法的一致性,以P<0.05為差異有統計學意義。
結 果
1.融合表達層析純化可獲得高純度蛋白H65:HCV 6個抗原區域用(GGGS)3串聯并進行密碼子優化后,片段大小為1608bp(圖1A),構建好的表達質粒經測序、雙酶切鑒定(圖1B)及小量表達(圖2A)證實構建成功,命名為H65質粒。

圖1 H65表達質粒的構建A.H65表達區段示意圖;B.H65表達質粒的鑒定;1.H65表達質粒雙酶切鑒定;2.H65基因片段
H65蛋白小量表達SDS-PAGE結果發現,與未誘導菌比較,誘導菌組在約74.2kDa處有明顯表達條帶(圖2A),H65蛋白在大腸桿菌中表達良好。大量表達(3L)發現H65蛋白占菌體總蛋白的39.82%(圖2B)。超聲處理后發現蛋白H65主要存在上清中(圖2B)。經親和層析純化后H65蛋白主要存在于0.5mol/L咪唑洗脫液中,濃度為2.991mg/ml,純度為94.53%(圖2B)。

圖2 蛋白H65表達及純化電泳分析A.小量表達;B.大量表達及純化。1.未誘導菌;2~6.誘導菌;7.超聲后總菌體蛋白;8.超聲液上清;9.超聲液沉淀;10.親和層析上樣;11.穿柱;12.0.1mol/L咪唑洗脫液;13.0.5mol/L咪唑洗脫液
2.蛋白H65可以與HCV-IgG陽性血清發生特異性反應:利用Western blot法,初步鑒定蛋白H65的抗原性。HCV陽性血清作為一抗,山羊抗人IgG H&L(HRP)酶標物作為二抗,在NC膜上相應位置出現了明顯條帶(圖3A);而HCV陰性血清作為一抗,在NC膜上相應位置無條帶(圖3B)。并且無論是用HCV陰陽性血清,無蛋白H65表達菌(空載體)都未見明顯條帶(圖3)。

圖3 蛋白H65的Western blot法分析A.HCV陽性血清作為第一抗體,羊抗人IgG H&L (HRP)作為第二抗體;B.HCV陰性血清作為第一抗體,羊抗人IgG H&L(HRP)作為第二抗體;1.陰性對照;2.H65蛋白
3.基于蛋白H65的間接法ELISA可以很好地鑒別HCV-IgG陰陽性血清標本:蛋白H65作為包被抗原建立間接法ELISA試劑,分別對50份HCV陽性和陰性血清樣本進行檢測。陽性樣本A值分布為1.487±0.055,陰性血清樣本A值分布為0.082±0.007。兩組數據分布比較使用Wilcox檢驗,結果發現兩組數據分布明顯不同(P<0.01),根據經驗陰性血清A值均值2.1倍作為臨界值得出臨界值為0.171。McNemer檢驗顯示結果,新制備診斷試劑與“金標準”比較,P=1.00,Kappa=0.940,提示診斷結果與“金標準”一致性優異。
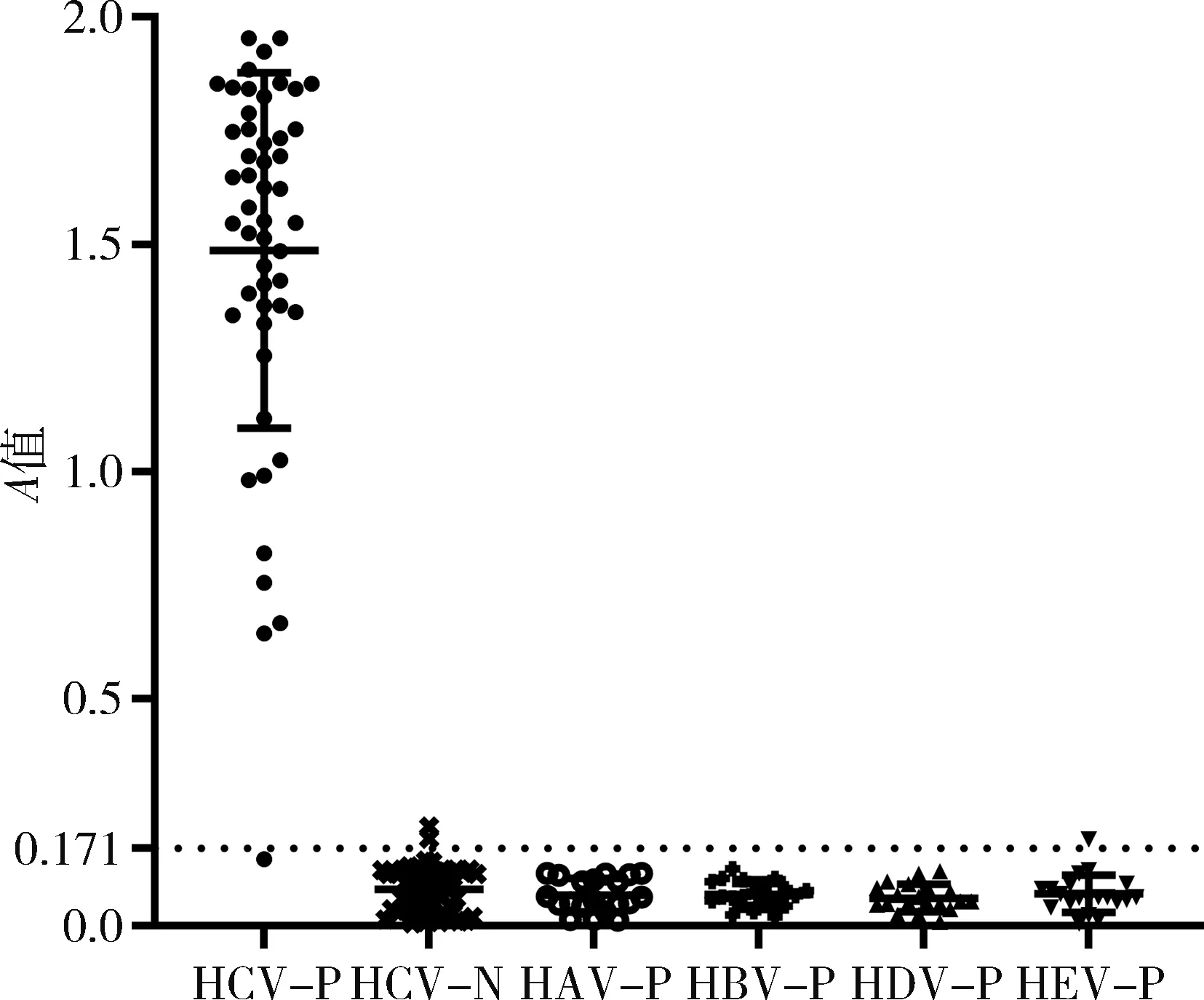
圖4 蛋白H65在HCV感染血清學診斷效果P.陽性血清;N.陰性血清
應用某商品化試劑盒檢測相同的血清(按照說明書判定陰陽性),陽性結果46份(46/50),陰性結果44份(44/50)。與新型試劑盒進行比較,詳見表1,進行McNemer檢驗發現,P=1.00,Kappa=0.900。

表1 新制備與商品化試劑盒比較(n)
討 論
多表位抗原區域的選擇依賴于4個關鍵因素:①免疫顯性區域;②對HCV抗體特異;③屬于線性或連續性表位;④在不同基因型之間進化保守[4]。除了NS3區抗原區段大小達到264個氨基酸外,其他5個抗原區段大小都低于60個氨基酸。Palenzuela等[14]推論NS3蛋白所表現出的高免疫原性很可能是由構象型表位觸發的,因此為了促使NS3區構象型表位的形成,在其區域片段的選擇上并沒有局限于文獻所報道的表位區域。同樣,其他5個免疫顯性區域的選擇也在文獻報道表位區的基礎上上下游延伸部分氨基酸,以盡力確保完整表位的展現[15,16]。考慮到我國HCV的主要流行株為1b和2a,尤其是1b占主導地位[8]。因此在抗原區域的選擇上,NS3、C和NS4A選取1b基因亞型,NS4A、NS4B和NS5A選取2a基因亞型。其中NS4A在1b和2a基因亞型中不保守,因此共存了這兩個相似表位[17]。
多表位串聯表達增加了蛋白高級結構的呈現及表達的難度[18]。首先,表位區域上下游的延伸以及GGGS連接臂的加入大大降低了各抗原區域之間的相互影響。選取的免疫顯性區主要為線性表位,加之連接臂的存在,大大降低了錯誤折疊的發生。其次,Trx標簽的融合,大大提高了可溶性表達的概率。再者,密碼子的優化并不單單考慮最優密碼子的替換,同時還考慮了轉錄和翻譯以及核酸二級結構的動能變化。最后,表達條件的優化讓大部分目的蛋白以可溶性形式存在,且表達量占菌體總蛋白的39.82%(圖2B)。
基于多表位HCV診斷抗原建立的間接法ELISA敏感度為98.00%(cut-off值為0.171),特異性為96.00%,陽性預測值為96.08%,陰性預測值為97.96%,符合率為97.00%。雖然與某商品化試劑盒比較不能否定一致性檢驗存在差異(Kappa=0.900),但參考上述指標,新制備檢測試劑更加優異。而且包被抗原只使用1個融合蛋白,相對于傳統診斷試劑使用3~6個融合蛋白大大降低了診斷試劑的成本以及假陽性結果的出現,為血清學診斷的普遍使用及HCV診斷率的提高奠定基礎[19]。
本研究不足之處在于沒有評價新制備試劑對不同基因型HCV血清標本的診斷效能。下一步工作將利用不同基因型(對HCV 1b和2a基因型血清標本診斷效能優異,數據未發表)血清對抗原的診斷效能進行全面評價。
總之,多表位HCV診斷抗原能夠在原核表達系統中可溶性表達,以這一融合蛋白建立的間接法ELISA能夠對HCV陰陽性血清標本鑒別診斷。

